理化学研究所(理研)環境資源科学研究センターバイオ高分子研究チームの宮本昂明特別研究員、沼田圭司チームリーダーらの研究チームは、複数のドメイン(領域)から成る人工の膜透過ペプチド[1]が新奇な細胞内取り込み機構を誘起することにより、タンパク質を植物細胞へ高効率に導入できることを明らかにしました。
本研究成果は、機能性タンパク質の直接導入によるDNAフリーな植物改変の実現に貢献するとともに、これまで知見が限られていた植物での細胞内取り込み機構の解明に寄与すると期待できます。
今回、研究チームは、人工ペプチド(dTat-Sar-EED4)を利用した簡便な手法により、蛍光タンパク質や酵素を活性な状態で植物細胞内へ導入することに成功しました。また、この人工ペプチドがこれまで動物細胞では確認されていたものの、植物細胞では未報告であった「マクロピノサイトーシス[2]」と呼ばれる細胞内取り込み機構に類似する機構を誘起していることを初めて発見しました。
本研究は、科学雑誌『JACS Au』オンライン版(1月5日付:日本時間1月6日)に掲載されます。
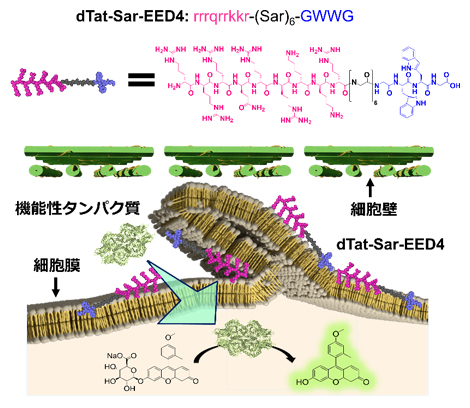
新奇な細胞内取り込み機構を誘起する人工膜透過ペプチド(dTat-Sar-EED4)を用いた植物細胞への機能性タンパク質の導入
背景
植物の改変には、その手法として遺伝子組換え[3]がこれまで盛んに利用されてきました。しかし、遺伝子組換え植物は人体や環境への影響が懸念されるため、その利用を規制する法律が定められています。このため、遺伝子組換えに頼らないDNAフリーな植物改変を実現するべく、植物細胞に直接タンパク質を導入する技術が求められています。
従来のタンパク質導入には、パーティクル・ガン法[4]やPEG法[5]が利用されてきましたが、これらの手法には、導入効率が低い、高価な装置が必要、プロトプラスト[6](細胞壁を取り除いた植物細胞)だけに適用可能であるなどの制限がありました。一方、膜透過ペプチドを利用するタンパク質導入法は、これらの制限を克服し得る技術として期待されています。
しかし、膜透過ペプチドを植物へ適用した例は限られており、特にペプチドがどのような機構でタンパク質を植物細胞内へ導入しているのか、またペプチドによって導入されたタンパク質は植物細胞内で活性を維持しているかについては未解明でした。
研究手法と成果
研究チームは、複数の機能性ドメイン(領域)から成る人工の膜透過ペプチド(dTat-Sar-EED4)により、加水分解酵素β-グルクロニダーゼ(GUS)[7]を活性な状態で植物細胞内へ導入できるか検討しました。種々のモデル植物(タバコ培養細胞、シロイヌナズナ子葉、イネカルス[8])をdTat-Sar-EED4とGUSの混合液に浸漬させ、後からGUSの基質を取り込ませたところ、細胞内へ導入されたGUSが酵素活性を維持していることを確認しました(図1A)。また、これまで植物に適用されてきた他の膜透過ペプチドと比較して、dTat-Sar-EED4のGUS導入効率は最大で20倍程度高くなることが分かりました。
次に、dTat-Sar-EED4の細胞内取り込み機構を明らかにするため、種々の阻害剤で処理したシロイヌナズナの根におけるGUS導入効率を比較しました。その結果、動物細胞でマクロピノサイトーシス阻害剤として用いられるサイトカラシンDやウォルトマンニンがGUSの導入効率を有意に低下させる一方で、クラスリン依存性エンドサイトーシス[9]の阻害剤ES9-17は導入効率に影響を与えないことが分かりました(図1B)。さらに、dTat-Sar-EED4を処理したシロイヌナズナの根を高圧凍結し、透過型電子顕微鏡[10]で観察しました。その結果、マクロピノサイトーシスの特徴である細胞膜の突出構造と直径200ナノメートル(nm、1nmは10億分の1メートル)を超える細胞内小胞の形成が確認されました(図1C)。これらの結果は、植物細胞ではこれまで未報告であったマクロピノサイトーシス様の細胞内取り込み機構が、dTat-Sar-EED4によって誘起されていることを示すものです。
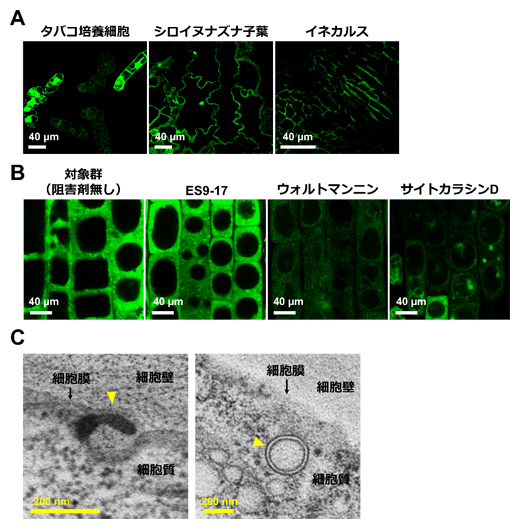
図1 人工膜透過ペプチドによる植物への機能性タンパク質導入とその細胞内取り込み機構の解明
- (A)人工膜透過ペプチド(dTat-Sar-EED4)により加水分解酵素β-グルクロニダーゼ(GUS)が活性な状態で、三つのモデル植物へそれぞれ導入されたことを示す蛍光顕微鏡画像。
- (B)各種エンドサイトーシス阻害剤で処理したシロイヌナズナの根におけるGUSの細胞内導入効率の比較。画像中の蛍光強度が大きいほど、細胞内へ導入されたGUSの活性が高いことを意味する。
- (C)dTat-Sar-EED4を処理したシロイヌナズナの根の透過型電子顕微鏡画像。左画像では特異な細胞膜の突出構造(黄矢印)が観察され、右画像では直径200nmを超える細胞内小胞の形成(黄矢印)を確認した。
今後の期待
本研究では、複数のドメインから成る人工の膜透過ペプチド(dTat-Sar-EED4)を利用する手法により、機能性タンパク質を活性な状態で植物へ導入することに成功しました。この手法は、高価な装置の使用やプロトプラストの調製が不要なため、機能性タンパク質の直接導入によるDNAフリーな植物改変に貢献すると期待できます。
また本研究では、dTat-Sar-EED4がマクロピノサイトーシス様の細胞内取り込み機構によってタンパク質を植物へ導入していることを明らかにしました。マクロピノサイトーシスは、これまで動物細胞ではその存在が確認されていましたが、植物細胞にこの機構が備わっているかは未解明でした。このため、本研究で得られた知見は、細胞外の物質がどのように植物細胞内へ取り込まれているのかを理解する上で重要な手がかりになると考えられます。
補足説明
- 1.膜透過ペプチド
細胞膜を透過して細胞内へ移行する機能を持ったペプチド。 - 2.マクロピノサイトーシス
細胞外の物質を細胞内へと取り込む機構の一種。取り込みの過程で特徴的な細胞膜の突出構造と直径200nmを超える細胞内小胞の形成が見られる。 - 3.遺伝子組換え
有用な性質を持った遺伝子を植物などの遺伝子に組込み、望みの性質を持たせる技術。 - 4.パーティクル・ガン法
核酸やタンパク質を吸着させた金粒子を高圧下で射出し、細胞内へ取り込ませる物理的な物質導入手法。 - 5.PEG法
細胞壁を除いた植物細胞にポリエチレングリコールを作用させることにより細胞内へ核酸やタンパク質を取り込ませる手法。 - 6.プロトプラスト
細胞壁を酵素処理によって取り除いた植物細胞。プロトプラストから植物体を再生することができるが、多くの植物種で再生は達成されていない。 - 7.加水分解酵素β-グルクロニダーゼ(GUS)
加水分解酵素は、ある種の化学結合の加水分解反応を触媒する機能を持ったタンパク質。β-グルクロニダーゼは、グルクロン酸抱合体を加水分解する。多くの植物細胞内では、β-グルクロニダーゼの活性が低いため、植物細胞を対象とした実験によく利用される。 - 8.カルス
分化していない状態の植物細胞の塊。自然界では植物の傷口にカルスの形成が見られるが、植物ホルモンの添加により、さまざまな組織からカルスを人為的に誘導することもできる。 - 9.クラスリン依存性エンドサイトーシス
細胞外の物質を細胞内へと取り込む機構の一種。取り込みの過程で細胞膜のくぼみが見られ、クラスリンと呼ばれる籠型のタンパク質複合体が被覆した細胞内小胞を形成する。 - 10.透過型電子顕微鏡
電子線を利用して試料をナノオーダーで詳細に観察できる顕微鏡の一種。
研究チーム
理化学研究所 環境資源科学研究センター バイオ高分子研究チーム
チームリーダー 沼田 圭司(ぬまた けいじ)
(京都大学 大学院工学研究科 教授)
特別研究員 宮本 昂明(みやもと たかあき)
研究員 小田原 真樹(おだはら まさき)
客員主管研究員 児玉 豊(こだま ゆたか)
(宇都宮大学 バイオサイエンス教育研究センター 教授)
研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 総括実施型研究ERATO「沼田オルガネラ反応クラスタープロジェクト(研究総括:沼田圭司)」による支援を受けて行われました。
原論文情報
- Takaaki Miyamoto, Kiminori Toyooka, Jo-Ann Chuah, Masaki Odahara, Mieko Higchi-Takeuchi, Yumi Goto, Yoko Motoda, Takanori Kigawa, Yutaka Kodama and Keiji Numata., "A Synthetic Multi-Domain Peptide That Drives a Macropinocytosis-Like Mechanism for Cytosolic Transport of Exogenous Proteins into Plants", JACS Au, 10.1021/jacsau.1c00504
発表者
理化学研究所
環境資源科学研究センター バイオ高分子研究チーム
特別研究員 宮本 昂明(みやもと たかあき)
チームリーダー 沼田 圭司(ぬまた けいじ)
 宮本 昂明
宮本 昂明
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
