理化学研究所(理研)生命医科学研究センター免疫器官形成チームの古関明彦チームリーダー(千葉大学大学院医学研究院細胞分子医学教授)、千葉大学大学院医学研究院細胞分子医学の大日向康秀講師(理研生命医科学研究センター免疫器官形成チーム客員研究員)らの共同研究グループは、マウスにおける「原始内胚葉幹細胞」の樹立に世界で初めて成功しました。
本研究成果は、わずか数十個の細胞からなる初期胚が個体生命を発生させる能力を持つ仕組みの解明と、今後、幹細胞だけを用いて試験管内で初期胚を再構成する技術の実現への貢献が期待されます。
初期胚である「胚盤胞[1]」は、主に胚を派生させる「エピブラスト」、胎盤を派生させる「栄養膜」、卵黄嚢[2]を派生させる「原始内胚葉」の3種類の細胞で構成されています。これまでに、エピブラストからはES細胞(胚性幹細胞)[3]、栄養膜からはTS細胞(栄養膜幹細胞)[4]が樹立されていますが、残る原始内胚葉の幹細胞(PrES細胞)の樹立は実現していませんでした。
今回、共同研究グループは、マウス胚盤胞を特殊な培地で培養することで、PrES細胞を樹立できることを発見しました。PrES細胞を胚盤胞に注入したところ、原始内胚葉に速やかに取り込まれ、卵黄嚢の派生に寄与することが分かりました。また、本来なら発生初期に死んでしまうはずの原始内胚葉を欠失させた胚盤胞にPrES細胞を注入し、偽妊娠マウス[5]の子宮に移植したところ、全ての原始内胚葉系列の組織が派生し、正常な仔マウスが生まれました。さらに、PrES細胞、ES細胞、TS細胞を試験管内で組み合わせて作製したETP複合体を偽妊娠マウスの子宮へ移植した結果、一部が着床し、卵黄嚢様の組織に囲まれた幹細胞由来組織が派生しました。
本研究は、科学雑誌『Science』オンライン版(2月3日付:日本時間2月4日)に掲載されます。
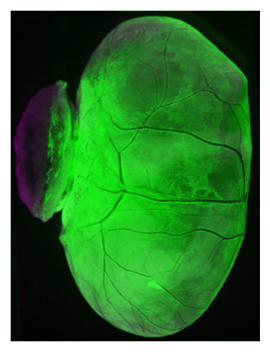
原始内胚葉を欠失したマウス胚盤胞にPrES細胞を注入して得られたキメラ(受精後18.5日)
背景
私たちの生命はたった一つの受精卵から始まります。受精卵は卵割を繰り返し、やがて「胚盤胞」と呼ばれる初期胚を形成します。胚盤胞は、主に胚を派生させる「エピブラスト」、胎盤を派生させる「栄養膜」、卵黄嚢を派生させる「原始内胚葉」の三つの細胞系譜を持つ、全部で数十個の細胞からなる組織です(図1左)。しかし、このような単純な構造がどのように生命の始まりとして機能するのかは、まだ解明されていません。
胚の発生を支持する胚体外組織としては、胎盤がよく知られています。しかし、胎盤が胚と母体とのインターフェイスとして機能し始めるのは、マウスでは受精後10日目以降であり、それ以前は卵黄嚢が胚発生を支持するのに必須です(図1右)。このように胚発生は胚だけではなく、胎盤や卵黄嚢と密接に連携して進行します。しかし、卵黄嚢の発生や発生初期における、胚および胎盤との組織間相互作用についてはほとんど解明されていません。
胚発生の仕組みを調べるには、各細胞系譜に由来する幹細胞を試験管内で分化させることが有効です。これまでにエピブラストからはES細胞(胚性幹細胞)、栄養膜からはTS細胞(栄養膜幹細胞)が樹立されているものの、残る原始内胚葉の幹細胞(primitive endoderm stem cell;PrES細胞)の樹立は実現していませんでした。
また近年、幹細胞だけを用いて胚を再構成する研究が注目されていますが、従来のES細胞とTS細胞だけでは、胚盤胞を作るための"部品"が足りず、残るPrES細胞の樹立が求められていました。
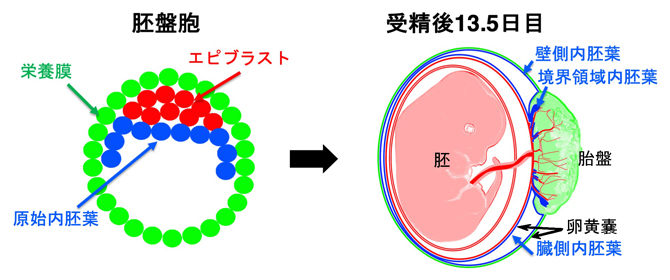
図1 胚盤胞と生じる受胎産物(胚と胚体外組織)の模式図
胚盤胞はエピブラスト(赤)、栄養膜(緑)、原始内胚葉(青)の3種、全部で数十個の細胞で構成される(左)。胚はエピブラストから、胎盤は栄養膜から、卵黄嚢(壁側内胚葉、臓側内胚葉、境界領域内胚葉)は原始内胚葉から生じる。
研究手法と成果
共同研究グループは、マウス胚盤胞をさまざまな培養条件に置き、PrES細胞を樹立・維持可能な条件を探索しました。その結果、無血清培地にグリコーゲン合成酵素3(GSK3)阻害剤であるCHIR99021、線維芽細胞増殖因子のFGF4、抗血液凝固薬のヘパリン、血小板由来増殖因子のPDGF-AAの四つを添加することで、PrES細胞の樹立に成功しました。樹立されたPrES細胞を単一細胞遺伝子解析[6]により調べたところ、ES細胞やTS細胞とは異なる遺伝子発現パターンを示し、受精後4.5日目胚の形成直後の原始内胚葉とよく似ていることが分かりました。また、PrES細胞にはES細胞などの多能性幹細胞[3]のマーカーであるOCT4やE-カドヘリンなどと、内胚葉のマーカーであるGATA6やSOX17などが共発現しており、既知の幹細胞とは異なる特徴的な遺伝子発現パターンを示していました。
次に、PrES細胞の機能を解析するためにPrES細胞を胚盤胞に注入したところ、速やかに原始内胚葉に取り込まれました。原始内胚葉は、壁側卵黄嚢の壁側内胚葉、臓側卵黄嚢の臓側内胚葉、境界領域内胚葉を派生する組織です。PrES細胞を注入した胚盤胞を偽妊娠マウスの子宮に移植すると、PrES細胞は壁側内胚葉、臓側内胚葉、境界領域内胚葉の全細胞の派生に寄与し、胚盤胞の細胞とPrES細胞が混ざったキメラ[7]を形成する能力を保持していることが分かりました。
4~8細胞期胚を、細胞の増殖や分化を制御するMEKを阻害するPD0325901で処理すると、原始内胚葉を欠失した胚盤胞を作製できますが、この胚盤胞は卵黄嚢を形成できないため、発生初期に死んでしまいます。そこで、原始内胚葉を欠失させた胚盤胞にPrES細胞を注入することで、胚が死ぬのを防げるか調べました。すると、PrES細胞は全ての原始内胚葉系列の組織を派生させ、正常な仔マウスが生まれました。この結果は、PrES細胞が原始内胚葉を補完する能力を持つことを意味しています。
ES細胞、TS細胞は、それぞれ胚盤胞のエピブラスト、栄養膜の性質を捉えた幹細胞です。PrES細胞の樹立によって、胚盤胞を構成する全ての細胞の幹細胞がそろいました(図2)。
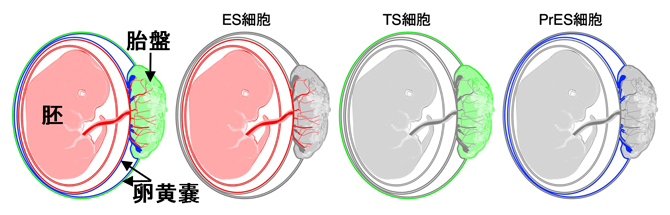
図2 ES細胞、TS細胞、PrES細胞の寄与の模式図
ES細胞は主に胚を、TS細胞は主に胎盤を、PrES細胞は主に卵黄嚢を形成する。これら三つの幹細胞がそろうことで、全ての受胎産物(左)がカバーされる。
さらに、三つの幹細胞を試験管内で組み合わせることで、人工的に胚様の構造を作製できるか調べました。ES細胞、TS細胞、PrES細胞を特殊な培養皿を用い、順に組み合わせて培養し、作製した組織(ETP複合体)について、単一細胞遺伝子発現解析を行ったところ、胚の着床前後の過程をある程度再現できることが分かりました。
また、偽妊娠マウスの子宮にETP複合体を移植したところ、移植した複合体のうち30%程度が着床しました。そして妊娠7.5日目には、壁側内胚葉様および臓側内胚葉様の二重の卵黄嚢で囲まれた胚に似た構造を形成することが分かりました(図3)。
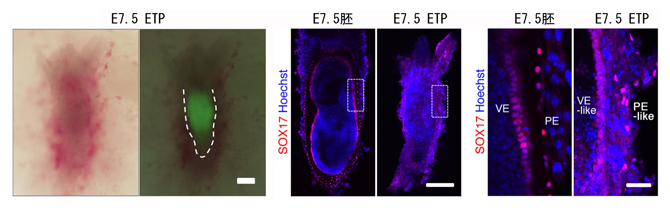
図3 マウスETP複合体から派生した胚様構造(妊娠7.5日目)
- 左:ETP複合体は偽妊娠マウス子宮への移植後、胚様構造を派生した。左は明視野、右は緑色蛍光タンパク質(GFP)でPrES細胞の寄与を可視化したもの。破線はETP複合体と子宮の境界を示す。スケールバーは500マイクロメートル(μm、1μmは1,000分の1mm)。
- 中:左は通常の受精による7.5日目の胚で、右はETP複合体から派生した妊娠7.5日目の胚様構造。ETP胚様構造は、内胚葉マーカーのSOX17陽性(赤)のニ重の卵黄嚢様シートに囲まれている。Hoechst(青)はDNAの染色。スケールバーは500μm。
- 右:中の四角部分を拡大した画像。右のETP複合体から派生した胚様構造は、壁側内胚葉様(PE-like)および臓側内胚葉様(VE-like)を示している。スケールバーは100μm。
今後の期待
私たちの生命は胚だけで生じることはなく、胚体外組織である胎盤や卵黄嚢と密接に連携して発生が進行します。今回、卵黄嚢の幹細胞であるPrES細胞が樹立されたことで、特に初期胚内での細胞間相互のシグナル伝達ネットワークの理解、つまり、わずか3種類、数十個の細胞の相互作用で生命の萌芽が形成される過程の解明が進むと期待できます。
また、胚を用いずに、幹細胞だけで人工胚を作製する研究は現在世界的に競争が激しい分野ですが、PrES細胞の登場によって、人工胚の作製や人工生命の研究もさらに進展すると期待できます。
補足説明
- 1.胚盤胞
哺乳動物の初期胚。一つの細胞である受精卵は卵割を繰り返し、均一だった細胞集団は徐々にさまざまな細胞種に分かれていく。マウスの場合、胚盤胞は受精後3日目に形成され、将来、主に胚になる細胞(エピブラスト)、胎盤になる細胞(栄養膜)、卵黄嚢になる細胞(原始内胚葉)で構成される。 - 2.卵黄嚢
壁側卵黄嚢(外側)と臓側卵黄嚢(内側)からなる二重の袋で、それぞれが二重の細胞層で形成されている。壁側卵黄嚢の内側の細胞層が内側内胚葉、臓側卵黄嚢の外側の細胞層が臓側内胚葉で、原始内胚葉に由来する。これら卵黄嚢の境界は胎盤の内部に入り込み、境界領域内胚葉を形成している。 - 3.ES細胞(胚性幹細胞)、多能性幹細胞
ES細胞(Embryonic stem cell)は、着床前エピブラストの性質を持つ幹細胞で、胚の全ての細胞・組織に分化する能力を持つことから、多能性幹細胞、万能細胞などとも呼ばれる。胎盤や卵黄嚢には分化しない。 - 4.TS細胞(栄養膜幹細胞)
TS細胞(Trophoblast stem cell)は主に胎盤に分化する能力を持つ。胚や卵黄嚢の内胚葉には分化しない。 - 5.偽妊娠マウス
代理母として用いられる。精管をカットした雄と交配した雌。卵管、あるいは子宮に外科的に初期胚を移植すると妊娠し、仔を産む。 - 6.単一細胞遺伝子解析
一細胞レベルの解像度で、遺伝子の発現を解析する手法。本研究では一つ一つの細胞について、次世代シークエンサーを用いて全遺伝子の発現を解析している。複数の細胞種で構成される細胞集団の遺伝子発現をより詳細に解析できる。 - 7.キメラ
胚盤胞に幹細胞を移植することで、胚盤胞由来と幹細胞由来の細胞が混ざった個体または組織を作製でき、これをキメラと呼ぶ。
共同研究グループ
理化学研究所 生命医科学研究センター
免疫器官形成研究チーム
上級研究員 近藤 隆(こんどう たかし)
テクニカルスタッフⅡ(研究当時) 公文 麻美(くもん まみ)
テクニカルスタッフⅡ 古関 庸子(こせき ようこ)
専門技術員 飯塚 裕介(いいづか ゆうすけ)
専門技術員 川元 由里衣(かわもと ゆりえ)
大学院生リサーチ・アソシエイト(研究当時) 椙下 紘貴(すぎした ひろき)
チームリーダー 古関 明彦(こせき はるひこ)
(千葉大学 大学院医学研究院 細胞分子医学 教授)
統合ゲノミクス研究チーム
技師 遠藤 高帆(えんどう たかほ)
技師 渡辺 貴志(わたなべ たかし)
千葉大学 大学院医学研究院 細胞分子医学
講師 大日向 康秀(おおひなた やすひで)
(理化学研究所 生命医科学研究センター 免疫器官形成研究チーム 客員研究員)
技術専門職員 更屋 敦則(さらや あつのり)
かずさDNA研究所
副所長 小原 收(おはら おさむ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究(研究領域提案型)「全能性プログラム:デコーディングからデザインへ(領域代表:小倉淳郎)」における研究課題「着床前胚に由来する幹細胞を用いた全能性の再構築(研究分担:大日向康秀)」、同挑戦的研究(開拓)「幹細胞による人工胚盤胞の作製(研究代表:大日向康秀)」、同新学術領域研究(研究領域提案型)「多様かつ堅牢な細胞形質を支える非ゲノム情報複製機構(領域代表:中西真)」における研究課題「ポリコム群による抑制ドメインの複製機構の解明(研究代表:古関明彦)」による支援を受けて行われました。
原論文情報
- Yasuhide Ohinata*, Takaho A. Endo, Hiroki Sugishita, Takashi Watanabe, Yusuke Iizuka, Yurie Kawamoto, Atsunori Saraya, Mami Kumon, Yoko Koseki, Takashi Kondo, Osamu Ohara, Haruhiko Koseki, "Establishment of mouse stem cells that can recapitulate the developmental potential of primitive endoderm", Science, 10.1126/science.aay3325
発表者
理化学研究所
生命医科学研究センター 免疫器官形成研究チーム
チームリーダー 古関 明彦(こせき はるひこ)
(千葉大学 大学院医学研究院 細胞分子医学 教授)
千葉大学 大学院医学研究院 細胞分子医学
講師 大日向 康秀(おおひなた やすひで)
(理化学研究所 生命医科学研究センター 免疫器官形成研究チーム 客員研究員)
 古関 明彦
古関 明彦
 大日向 康秀
大日向 康秀
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
千葉大学亥鼻地区事務部総務課企画係
Tel: 043-226-2841
Email: inohana-koho [at] chiba-u.jp
※上記の[at]は@に置き換えてください。
