理化学研究所(理研)脳神経科学研究センター神経老化制御研究チームの綿村直人研究員、西道隆臣チームリーダー、笹栗弘貴副チームリーダーらの共同研究グループは、アルツハイマー病(AD)[1]の初期病理であるアミロイドβペプチド(Aβ)[2]の蓄積を再現し、かつ「βセクレターゼ阻害剤[3]」の効果を正しく評価できるADモデルマウスの開発に成功しました。
本研究成果は、基礎研究のみならず臨床研究にも有用であり、AD治療薬として有望視されているβセクレターゼ阻害薬の開発に貢献すると期待できます。
これまで共同研究グループが作製したADモデルマウスには、アミロイド前駆体タンパク質(APP)[2]をコードするApp遺伝子に複数の家族性ADの原因遺伝子変異を導入していました。しかし、その一つのスウェーデン変異[4]はAPPからAβが産生される過程でβセクレターゼによって切断される部位の近くにあるため、βセクレターゼ阻害剤の効果を正しく評価することが困難でした。
今回、共同研究グループはCRISPR/Cas9[5]によるゲノム編集を利用し、三つの遺伝子変異を持つ既存のADモデルマウスからスウェーデン変異のみを取り除いたADモデルマウス(AppG-Fマウス)を作製しました。AppG-Fマウスでは、アミロイド病理やそれに付随する神経炎症[6]が再現されており、さらに、βセクレターゼ阻害薬の効果を正確に評価できます。また、脳の神経細胞でADに特徴的なエンドソーム[7]異常が起きており、ADの細胞病態解明にも応用可能です。
本研究は、科学雑誌『Science Advances』オンライン版(日本時間6月9日)に掲載されました。
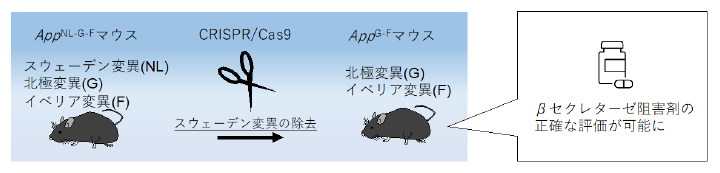
新しいアルツハイマー病モデルマウスの開発
背景
超高齢社会を迎えた日本では、加齢が主要因と考えられるアルツハイマー病(AD)の克服は喫緊の課題です。今後、介護などの社会的コストの増大による医療経済の圧迫も懸念され、有効な予防法および治療法の開発が切望されています。
AD患者の脳内では、初期病理としてアミロイド前駆体タンパク質(APP)から細胞外へ切り出されたアミロイドβペプチド(Aβ)が凝集し、蓄積すると考えられています。家族性ADでは、APPおよびAPPを切り出す酵素群に遺伝子変異があり、その影響で脳内のAβ量が上昇します。これまでに共同研究グループは、APPをコードするApp遺伝子に、ノックイン技法[8]を用いて家族性ADの原因遺伝子変異を導入することで、世界で初めてAPPの過剰発現に依存しないADモデルマウスの作出に成功しました注1, 2)。
しかし、これらのモデルマウスに導入された変異の一つであるスウェーデン変異は、APPの切断部位の近くに位置し、APP切断酵素βセクレターゼへの親和性を高めることで脳内のAβ量を増加させるため、これらのADモデルマウスを使ってβセクレターゼ阻害剤の効果を正しく評価するのは困難でした。βセクレターゼ阻害剤は、ADの大多数を占める孤発性ADの予防・治療薬として注目されていることから、共同研究グループはスウェーデン変異を持たない新たなADモデルマウスの開発に取り組みました。
- 注1)2014年4月14日プレスリリース「次世代型アルツハイマー病モデルマウスの開発に成功」
- 注2)2021年8月26日プレスリリース「第三世代アルツハイマー病モデルマウスの作製」
研究手法と成果
本研究ではまず、三つの遺伝子変異を持つ既存のADモデルマウス(AppNL-G-F)からCRISPR/Cas9を用いたゲノム編集によってスウェーデン変異のみを取り除き、新たなADモデルマウス(AppG-F)を作製しました(図1)。
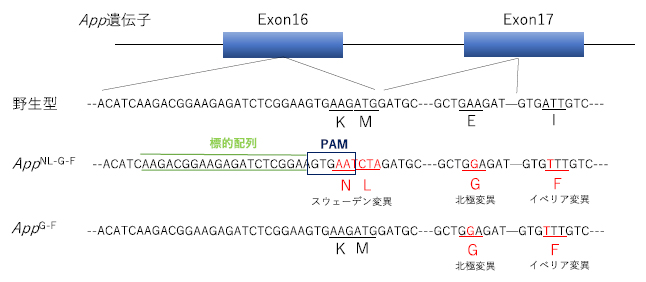
図1 CRISPR/Cas9を用いたAppG-Fマウスの作製方法
AppNL-G-Fマウスのエクソン16上にガイドRNAを設計し、CRISPR/Cas9を応用することで、スウェーデン変異を取り除き、北極変異とイベリア変異のみを残したAppG-Fマウスを作製した。
次に、AppG-Fマウスの病理について、組織・生化学的解析を行いました。その結果、加齢依存的に脳内でAβが増加・蓄積することや、グリア細胞[9](ミクログリア、アストロサイト)の活性化をはじめとする神経炎症が起きることを確認しました(図2)。また、Aβ蓄積周辺部位ではシナプスマーカー[10]が消失していました。これらのことから、AppG-Fマウスの脳は、AD患者脳と同様の病理像を示すといえます。
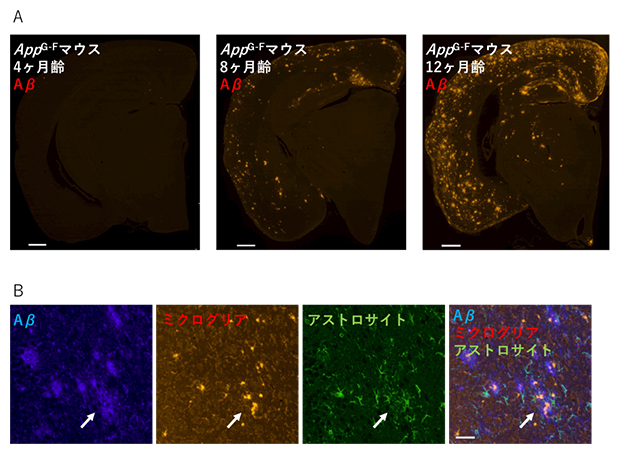
図2 AppG-Fマウスの表現型
- A:AppG-Fマウスの脳における加齢依存的なAβの蓄積。光点がAβが存在する位置を示す。スケールバーは500マイクロメートル(μm、1μmは1,000分の1mm)。
- B:左から、AppG-Fマウスの脳におけるAβ(青)、ミクログリア(赤)、アストロサイト(緑)、Aβ・ミクログリア・アストロサイトの三重染色。Aβが蓄積している白矢印の位置では、グリア細胞のミクログリアやアストロサイトが活性化していることから、神経炎症が起こっていると考えられる。スケールバーは100μm。
続いて、βセクレターゼ阻害剤の効果を確認するため、野生型マウス、AppG-FマウスおよびAppNL-G-Fマウスにβセクレターゼ阻害剤を投与しました。その結果、AppNL-G-Fマウスでは治療効果が認められませんでしたが、AppG-Fマウスでは野生型マウス同様、脳内のAβが減少することが示されました(図3)。
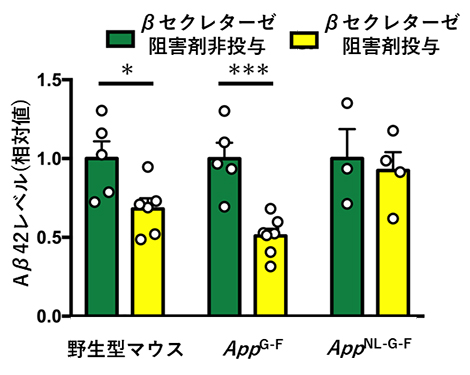
図3 AppG-Fマウスに対するβセクレターゼ阻害剤の効果
βセクレターゼ阻害剤非投与・投与群におけるAβ42量を比較した。*はP<0.05、***はP<0.001の水準で統計学的に差が有意であることを示す。
ADの細胞病理学的な特徴として、エンドソームの異常が挙げられます。細胞を用いた他の研究チームの実験によって、βセクレターゼの切断で産生されるAPP断片(CTF-β)の増加がエンドソーム障害を引き起こすことが示唆されています注3)。そこで、共同研究グループがこれまでに作製したADモデルマウスを用いて、生体でもこの現象が起こるか調べました。スウェーデン変異を持つマウス(AppNL-FマウスおよびAppNL-G-Fマウス)は、βセクレターゼの切断が促進されているため、CTF-βが野生型マウスの10倍程度に増加し、脳内でエンドソーム障害(エンドソームの肥大化)が生じていました(図4)。一方、スウェーデン変異を持たないAppG-Fマウスでは、CTF-βの量はAppNL-G-Fマウスに比べて少ないものの(図4A)、AppNL-G-Fマウスと同様のエンドソーム障害を起こしていました(図4B)。つまり、ADの発症に伴うエンドソーム障害には、CTF-β量の増加以外の要因も関係していることが示唆されました。
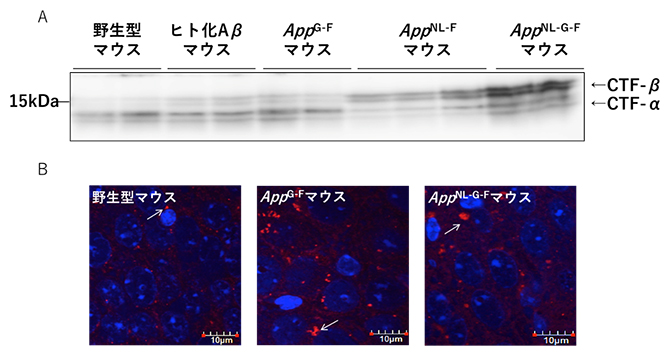
図4 ADモデルマウス脳内のAPP断片の量とエンドソーム障害
- A:左から野生型、ヒト化Aβ(Aβの配列のみヒト化されている)、AppG-F、AppNL-F、AppNL-G-FマウスにおけるCTF-α、CTF-β量の比較。CTF-αはαセクレターゼの切断で産生されるAPP断片のこと。
- B:左から野生型、AppG-F、AppNL-G-Fマウスを用いたエンドソームマーカーEEA1の免疫染色画像。赤がEEA1、青が核を示す。白矢印はEEA1が多く分布し、エンドソームが肥大化していることを示す。
- 注3)Kwart et al., A Large Panel of Isogenic APP and PSEN1 Mutant Human iPSC Neurons Reveals Shared Endosomal Abnormalities Mediated by APP β-CTFs, Not Aβ. Neuron (2019).
今後の期待
これまでのβセクレターゼ阻害剤の評価には、スウェーデン変異を持つマウスやAPP過剰発現型のマウスが使用されており、予防・治療効果を個体レベルで正確に調べるのは困難でした。本研究で開発したAppG-Fマウスは、βセクレターゼ阻害剤の評価に適したADモデルマウスであり、基礎研究や臨床研究での活用が期待できます。
さらに、エンドソーム障害のようなADの細胞病態を生体内で再現し、その機序を一部明らかにできたことから、複数のADモデルマウスを比較することはADの病態解明に有効な手段と考えられます。今後は、これまでに作製したADモデルマウスを使って、エンドソーム障害が起こる原因やメカニズムをさらに明らかにしていく予定です。
補足説明
- 1.アルツハイマー病(AD)
ドイツの精神科医、アルツハイマー博士により1905年に報告された進行性の記憶障害を伴う認知症。主に中高年で発症し、徐々に進行して生活に支障を来すようになり、最終的には意思疎通ができなくなる。日本を含む先進国では、高齢期発症の認知症のうち最も多いタイプの疾患である。家族歴を伴うものを家族性AD、伴わないものを孤発性ADと呼ぶ。 - 2.アミロイドβペプチド(Aβ)、アミロイド前駆体タンパク(APP)
アミロイドβペプチド(Aβ)は、アミロイド前駆体タンパク(APP)からタンパク分解酵素によって切断されて精製される40アミノ酸ほどの長さのペプチド。AβはAD患者の脳に出現する老人斑と呼ばれる凝集体の主要な構成成分であり、アルツハイマー病発症に関与する重要な分子と考えられている。 - 3.βセクレターゼ阻害剤
APPがタンパク質分解酵素のβセクレターゼとγセクレターゼによって切断されると、細胞外にAβが放出される。βセクレターゼ阻害剤はβセクレターゼの働きを弱め、脳内のAβ量を減らすことで、ADに対する予防・治療効果が期待される薬剤。 - 4.スウェーデン変異
ADの家族性変異の一つで、スウェーデンの家系で同定された。APPのβセクレターゼに対する親和性を高め、総Aβ産生量を上昇させる。 - 5.CRISPR/Cas9
DNAの二重鎖切断を引き起こし、ゲノム配列の任意の場所の切断、挿入、置換が可能なゲノム編集技術の一つ。化膿レンサ球菌の免疫システムから発見された。 - 6.神経炎症
ADの病理学的特徴の一つ。グリア細胞の活性化などによって特徴づけられ、ADの発症や進行に大きく関わっていることが明らかとなってきている。 - 7.エンドソーム
エンドサイトーシスによって、細胞内に取り込まれた小胞。取り込んだタンパク質の選別を行う初期エンドソーム、リソソームと融合し分解する後期エンドソーム、細胞膜に戻すリサイクリングエンドソームなどに分類される。AD患者の脳では、神経細胞内のエンドソームの数が多く、肥大化などが見られる。 - 8.ノックイン技法
導入遺伝子を用いて、目的の遺伝子を置換したり、遺伝子座にもともと存在しない配列を挿入したりする技術。 - 9.グリア細胞
神経系を構成する神経細胞ではない細胞で、主にアストロサイト、ミクログリア、オリゴデンドロサイトに分類される。脳内環境の維持や代謝的支援、神経伝達の補助的な役割を担う。 - 10.シナプスマーカー
シナプス特有に局在するタンパク質で、シナプスの定量などに用いられる分子。本研究では、プレシナプスマーカーとしてシナプトフィジン、ポストシナプスマーカーとしてPSD-95を免疫染色によって検出した。
共同研究グループ
理化学研究所 脳神経科学研究センター 神経老化制御研究チーム
研究員 綿村 直人(わたむら なおと)
チームリーダー 西道 隆臣(さいどう たかおみ)
副チームリーダー 笹栗 弘貴(ささぐり ひろき)
大学院生リサーチ・アソシエイト(研究当時) 佐藤 香織(さとう かおり)
名古屋市立大学大学院 医学系研究科
教授 斉藤 貴志(さいとう たかし)
名古屋大学大学院 医学系研究科
特任助教 永田 健一(ながた けんいち)
早稲田大学大学院 先進理工学研究科
教授 大島 登志男(おおしま としお)
研究支援
本研究は、日本医療研究開発機構(AMED)「脳とこころの研究推進プログラム(革新的技術による脳機能ネットワークの全容解明プロジェクト)(代表者:西道隆臣)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「ゲノム編集技術を利用した変異プレセニリンによるアルツハイマー病機序の系統的解析(研究代表者:笹栗弘貴)」、武田科学振興財団「ビジョナリーリサーチ助成(スタート)(研究代表者:笹栗弘貴)」による支援を受けて行われました。
原論文情報
- Naoto Watamura, Kaori Sato, Gen Shiihashi, Ayami Iwasaki, Naoko Kamano, Mika Takahashi, Misaki Sekiguchi, Naomi Yamazaki, Ryo Fujioka, Kenichi Nagata, Takashi Saito, Toshio Ohshima, Takaomi C. Saido, Hiroki Sasaguri., "An isogenic panel of App knock-in mouse models: profiling β-secretase inhibition and endosomal abnormalities.", Science Advances, 10.1126/sciadv.abm6155
発表者
理化学研究所
脳神経科学研究センター 神経老化制御研究チーム
研究員 綿村 直人(わたむら なおと)
チームリーダー 西道 隆臣(さいどう たかおみ)
副チームリーダー 笹栗 弘貴(ささぐり ひろき)
 綿村 直人
綿村 直人
 西道 隆臣
西道 隆臣
 笹栗 弘貴
笹栗 弘貴
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
AMED事業に関すること
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
脳とこころの研究推進プログラム
(革新的技術による脳機能ネットワークの全容解明プロジェクト)
Tel: 03-6870-2286
Email: brain-m [at] amed.go.jp
※[at]は@に置き換えてください。
