理化学研究所(理研)生命医科学研究センター融合領域リーダー育成プログラムのイボ・ウー上級研究員(研究当時、現粘膜免疫研究チーム客員研究員)らの国際共同研究チームは、脂肪組織に存在し脂肪細胞[1]へと分化する脂肪前駆細胞(APCs)[2]をプロテオミクス[3]の手法を用いて網羅的に解析し、性別の違いや体内の組織部位の違いによって、脂肪前駆細胞の性質が多様に変化して、脂肪細胞の分化・増殖が制御されることを発見しました。
本研究成果は、近年社会的に増加している肥満を脂肪細胞から理解し、将来的な予防に向けて貢献すると期待できます。
今回、国際共同研究チームは、脂肪前駆細胞の機能的多様性を示すとともに、肥満状態下の雌では脂肪細胞の分化増殖が活性化していること、雄においても薬剤によって脂肪細胞への分化増殖を活性化できることを示しました。
本研究は、米国の科学雑誌『Cell Metabolism』オンライン版(4月20日付)に掲載されました。
背景
近年、肥満患者の数は増加の一途をたどり、2030年には世界の成人人口の半分に達すると予想されています。肥満は、糖尿病や心疾患、がんなどの慢性炎症疾患と関係することから、その経済的影響は毎年世界GDPの2%に及ぶと見積もられています。
脂肪組織には、白色脂肪細胞と褐色脂肪細胞があり、このうち、白色脂肪細胞は皮下や内臓に分布し、余分なエネルギーを中性脂肪として貯蔵する役割を持ちます。しかし、肥満が進行すると白色脂肪細胞は壊死し、周辺組織で慢性炎症を起こすことが分かってきました。褐色脂肪細胞は主に鎖骨上部や脊椎付近に分布し、脂肪を燃焼して熱を産生する働きを担っています。
これまでに、国際共同研究チームのラナ・グプタ教授らは、脂肪細胞へと分化する脂肪前駆細胞が存在し、この前駆細胞が脂肪組織の場所によって異なる特徴を持つことや、肥満状態では、脂肪前駆細胞が活性化して新たな脂肪細胞へと分化・増殖し、新しい脂肪細胞を補填することで、体の代謝機能の維持に働くことを、明らかにしてきました。
本研究では、高度なタンパク質質量分析技術を用いて、脂肪前駆細胞が体内の部位や性別によってどのように異なる性質を持つのか、網羅的に解析しました。
研究手法と成果
国際共同研究チームはまず、雄と雌のマウスそれぞれから、性腺周囲の内臓脂肪にある白色脂肪組織と、鼠蹊部の皮下脂肪にある白色脂肪組織を採取し、さらにセルソーターを用いて、脂肪前駆細胞(白色脂肪前駆細胞)を多面的に解析するために、4種類のサブセットに分類しました。これらのサブセットは、内臓脂肪由来の脂肪前駆細胞(APCs)と線維炎症性前駆細胞(FIPs)[4]、皮下脂肪由来の脂肪前駆細胞のうち、ジペプチジルペプチダーゼ-4(DPP-4)[5]の低いグループ(DPP-4- APCs)とDPP-4の高いグループ(DPP-4+ APCs)で、DPP-4は血糖値の上昇や肥満と関係すると考えられています。
四つのサブセットごとに、高度な質量分析計[6]を用いた4,870種類のタンパク質のプロテオーム解析[7]と、次世代シーケンサー[8]を用いた15,477種類のRNAのトランスクリプトーム解析[9]を実施しました。その結果、4,540個の分子について、全てのサブセットでタンパク質レベルとRNAレベルでの解析を比較することができました。すると、タンパク質レベルの解析では、細胞サブセットごとに機能的な類似性が見られました。一方、RNAレベルの解析では、内臓脂肪あるいは皮下脂肪といった細胞の由来組織によって、発現レベルに類似性が見られました(図1)。
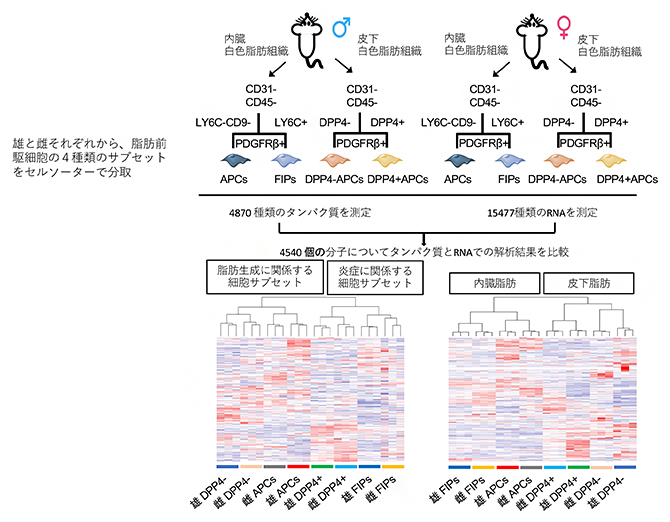
図1 脂肪前駆細胞の多面的解析(細胞サブセット、性別、局在部位で分類)
雄と雌のマウスそれぞれから、性腺周囲の内臓脂肪と鼠蹊部の皮下脂肪に存在する白色脂肪組織を採取し、セルソーターを用いて、それぞれ四つの細胞サブセットに分類した。これらの細胞サブセットごとに、高度な質量分析を用いて4,870種類のタンパク質を解析、次世代シーケンサーを用いて15,477種類のRNAを解析した。この結果、4,540の分子について、タンパク質レベルとRNAレベルとの両方で解析できた。タンパク質レベルでのクラスター分析から、細胞サブセットによる機能的な類似点や相違点が明らかになるとともに、RNAレベルでのクラスター分析から、内臓脂肪あるいは皮下脂肪といった細胞の由来組織によって、RNAの発現が変化することが分かった。
また、皮下脂肪由来のDPP-4-APC細胞の雌雄での違いをタンパク質レベルで比較したところ、エストロゲンという女性ホルモンに反応する37のタンパク質が雌でのみ増加しており、雄の脂肪前駆細胞とは異なる特徴を持つことが明らかになりました。これらのことから、タンパク質レベルのプロテオミクス解析によって、細胞サブセットのより機能的な推測が可能になると考えられました。
さらに、肥満状態における脂肪前駆細胞の雌雄差を比較するため、高脂肪食を与えた雄と雌のマウスから鼠蹊部の皮下脂肪にある白色脂肪細胞を採取し、その増殖を調べました。すると、雄のマウスでは高脂肪食を与えても脂肪細胞数が増えなかった一方で、雌のマウスに高脂肪食を与えると、脂肪前駆細胞が活性化して新たな脂肪細胞が分化増殖していました。新しい脂肪細胞が作られることで、雌では肥満による代謝異常が起きづらくなっていると考えられました。
そこで、雌の脂肪前駆細胞で見られるような脂肪細胞の増殖効果を、薬剤で模倣できないかと考えました。高脂肪食で肥満を誘導した雄と雌のマウスに、脂肪細胞の分化を制御するペルオキシソーム増殖剤活性化レセプターガンマ(PPARg)[10]を活性化するために、糖尿病の治療薬であるロシグリタゾンを投与し、PPARg 活性の抑制を解除するためにがんの治療薬であるトラメチニブをそれぞれ投与し、新たに増殖した脂肪細胞を測定しました。その結果、これらの薬剤投与によって、皮下脂肪細胞の増殖には、PPARgの活性が影響していること、雄のマウスにおいても脂肪前駆細胞を活性化し、脂肪細胞の分化増殖を誘導できることが分かりました(図2)。

図2 薬剤投与による皮下脂肪細胞の増殖亢進
新たな脂肪細胞の分化増殖を追跡可能にした遺伝子改変モデルマウス(Mural Chaserマウス)を用いて、皮下脂肪細胞の増殖を測定した。高脂肪食を与えて肥満状態を誘導した雄と雌のマウスで比較すると、雌のみで脂肪細胞の増殖が見られた(赤色)。糖尿病治療薬(ロシグリタゾン)を投与したところ、雄では2%の脂肪細胞が新たに増殖した一方、雌においては、30%の脂肪細胞増殖が見られた(左図青色)。がんの治療薬(MEK阻害薬トラメチニブ)を投与したところ、雄雌いずれにおいても、新たな脂肪細胞の分化増殖が有意に亢進することが示された(右図青色)。
今後の期待
本研究で明らかとなった脂肪細胞前駆細胞の網羅的なタンパク質情報を利用することで、分化増殖や脂肪組織炎症に重要なタンパク質を新たに探索することが可能になりました。脂肪細胞前駆細胞の網羅的解析情報は、PreadProfilerデータベースで公開されています。
また、性別や体の部位などによって、脂肪細胞前駆細胞が多様な性質を持つことが明らかになり、将来的には脂肪前駆細胞を標的とした新たな肥満治療につながるものと期待できます。
補足説明
- 1.脂肪細胞
白色脂肪細胞と褐色脂肪細胞があり、このうち、白色脂肪細胞は皮下や内臓に分布し、余分なエネルギーを中性脂肪として貯蔵する役割を持つ。肥満の進行によって白色脂肪細胞は壊死し、周辺組織で慢性炎症を起こす。一方の褐色脂肪細胞は主に鎖骨上部や脊椎付近に分布し、脂肪を燃焼し熱を産生する働きを担う。 - 2.脂肪前駆細胞(APCs)
脂肪組織の間質血管細胞群(stromal-vascular fraction(SVF))に存在する前駆細胞で、分裂によって、新たな脂肪細胞に分化する。APCsはAdipocyte precursor cellsの略。 - 3.プロテオミクス
生命体や生物システムに存在するタンパク質について、機能、局在部位、動態、構造や修飾、代謝、相互作用などを大規模に解析することで、生命現象の理解や医学、創薬などに広く貢献する研究領域。 - 4.線維炎症性前駆細胞(FIPs)
線維形成や炎症に関わる前駆細胞で、脂肪を生成せずコラーゲンを産生する。FIPsはFibro-inflammatory progenitorの略。 - 5.ジペプチジルペプチダーゼ-4(DPP-4)
ペプチド鎖の端から2番目のアミノ酸がプロリン、ヒドロキシプロリン、アラニンの場所で結合を切断し不活性化する酵素。GLP-1という食後高血糖を抑えるホルモンを分解することから、血糖値の上昇や糖尿病、肥満の病態と関係する。今回の実験では、脂肪前駆細胞(APCs)をさらに、DPP-4の発現が高いグループと低いグループで分類して解析した。 - 6.質量分析計
物質を構成する原子や分子をイオン化し、その質量と数を高感度に測定する分析計。物質の同定や定量に用いられる。 - 7.プロテオーム解析
細胞や組織で発現しているタンパク質を分離、同定、定量して得られた情報を分析し、生命システムを構成するタンパク質の機能および機能的つながりを解析する手法。 - 8.次世代シーケンサー
超高速で塩基配列を解読する装置。 - 9.トランスクリプトーム解析
ゲノムDNAからの転写産物(RNA)を網羅的に調べ、遺伝子発現の状態を計測する手法。 - 10.ペルオキシソーム増殖剤活性化レセプターガンマ(PPARg)
肥満や2型糖尿病に関係する転写因子で、脂肪細胞の分化制御に中心的役割を持つ。
国際共同研究チーム
理化学研究所 生命医科学研究センター 融合領域リーダー育成プログラム
上級研究員(研究当時) イボ・ウー(Yibo Wu)
(現 粘膜免疫研究チーム 客員研究員)
テクニカルスタッフⅠ(研究当時) クライブ・バーカー(Clive Barker)
(現 統合ゲノミクス研究チーム テクニカルスタッフⅠ)
テキサス大学 サウスウェスタン・メディカル・センター
教授 ラナ・グプタ(Rana Gupta)
ポスドク研究員(研究当時) ボ・シャン(Bo Shan)
ポスドク研究員(研究当時) モェンレイ・シャオ(Mengle Shao)
原論文情報
- Bo Shan, Clive S. Barker, Mengle Shao, Qianbin Zhang, Rana K. Gupta, Yibo Wu, "Multilayered omics Reveal Sex- and Depot-Dependent Adipose Progenitor Cell Heterogeneity", Cell Metabolism, 10.1016/j.cmet.2022.03.012
発表者
理化学研究所
生命医科学研究センター 融合領域リーダー育成プログラム
上級研究員(研究当時) イボ・ウー(Yibo Wu)
(現 粘膜免疫研究チーム 客員研究員)
 イボ・ウー
イボ・ウー
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
