理化学研究所(理研)生命機能科学研究センター発生幾何研究チームの森下喜弘チームリーダー、大塚大輔上級研究員らの研究チームは、周囲からの「力」を感じ応答する細胞の能力(力覚[1])の異常が、脊椎動物の先天性奇形の一つである単眼症[2]を引き起こすことを発見しました。
本研究成果は、単眼症を含む多くの先天性奇形発症の共通メカニズムの理解につながると期待できます。
左右の眼が融合する単眼症の原因遺伝子SHH[3]の欠損は、眼胞[4]細胞の増殖や分化の異常を引き起こすことが知られています。しかし、実際に眼胞の形を作り出す細胞集団の動きや組織の変形といった物理的なプロセスにどのような異常が現れるのかは不明でした。
今回、研究チームは、器官計測・操作が容易なニワトリ胚を用いて、高解像度イメージングや眼胞への外力負荷実験、数理解析や力学シミュレーション[5]などを駆使した複合的な実験・解析を行いました。その結果、(1)SHH遺伝子産物である分泌因子SHHを起点としたシグナル経路によって、細胞にかかる力の方向の感知とそれに対する応答が制御されていること、(2)SHHシグナルが働かなくなると細胞の力覚が異常になるため細胞集団の運動方向がランダムになり、結果として正常な組織変形が阻害され単眼症になることを発見しました。SHHシグナルはさまざまな臓器の形成に関わることから、先天性奇形の発症機構を細胞の力覚異常という視点から統一的に理解できる可能性があります。
本研究は、科学雑誌『Science Advances』オンライン版(7月13日付:日本時間7月14日)に掲載されました。
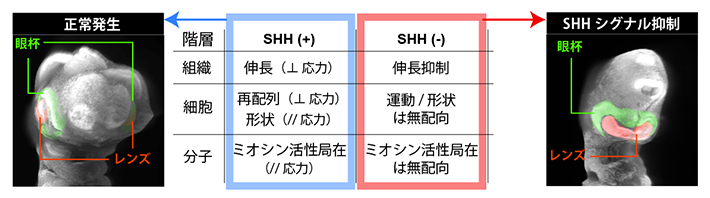
SHHシグナル依存的な細胞の力覚/極性形成の制御とその異常による単眼症の発症
背景
過去数十年にわたる遺伝学、分子生物学研究の進展により、先天性奇形を含むさまざまな臓器形態異常に関連する原因遺伝子が明らかになってきました。中でもSonic hedgehog(SHH)は、脳や心臓、四肢などの主要臓器や体の構造の形作りに必須な遺伝子の一つとして知られ、この遺伝子の異常はさまざまな先天性奇形を引き起こします。
全前脳胞症[2]は、ヒトをはじめ多くの脊椎動物のSHH欠損個体に見られる代表的な脳の奇形であり、最も重篤な場合には、単眼症と呼ばれる顔の中央に眼が一つしか形成されない表現型となります。これまで、全前脳胞症の発症機構に関する研究論文は数百以上報告されてきましたが、その多くはSHH遺伝子が担うSHHシグナル伝達経路により制御される、細胞増殖や細胞分化の空間パターン異常に焦点が当てられ、実際に形態異常が生じる物理的プロセス、つまり細胞集団の動きや組織変形を通じた形作りの過程、あるいは組織内応力[6]との関係性についてはほとんどが未解明のままでした。
そこで本研究では、モデル動物としてさまざまな計測・操作が可能なニワトリ胚を用いて、前脳初期発生過程においてSHHシグナルを抑制することにより、人為的に単眼症様表現型を模倣した実験系を利用し、二光子顕微鏡[7]による高解像度イメージング、細胞・組織ダイナミクスの定量解析、外力への細胞応答実験、力学シミュレーションなどを含む複合的な実験・解析を行い、奇形発症の物理的要因の解明を目指しました。
研究手法と成果
眼の発生は、前脳の初期発生の一部として生じます。前脳発生過程は、神経管と呼ばれる細胞一層から成る管状構造の変形から始まります。神経管の最前側(頭部側)である前脳領域に、左右1対の眼胞と呼ばれる突起状の構造ができ、それらが側方に伸長し将来的に眼胞の先端に眼が形成されます(図1上段・中段)。研究チームは、SHHシグナルを抑制する薬剤をニワトリ胚に投与した際に、神経管や眼胞の形態形成がどのような影響を受けるかを詳細に調べました。
まず、発生の初期からSHHシグナルを抑制し続けると、神経管の形成や眼胞原基の形成は正常に起こりますが、眼胞の伸長が著しく阻害され、最終的に顔の中央で左右のレンズが融合し、単眼症様の表現型となります(図1下段)。次に、眼胞が十分に伸長した後にSHHシグナルを抑制すると、左右のレンズ間距離は正常胚に比べて若干短くなるものの、レンズの融合は起きませんでした。これらのことから、眼胞伸長期にSHHシグナルが抑制されることが単眼症の発症には十分な条件と考えられ、約3週間に及ぶニワトリ胚発生のうち初期の6時間程度の期間に起きる分子、細胞、組織動態を解析の標的としました。
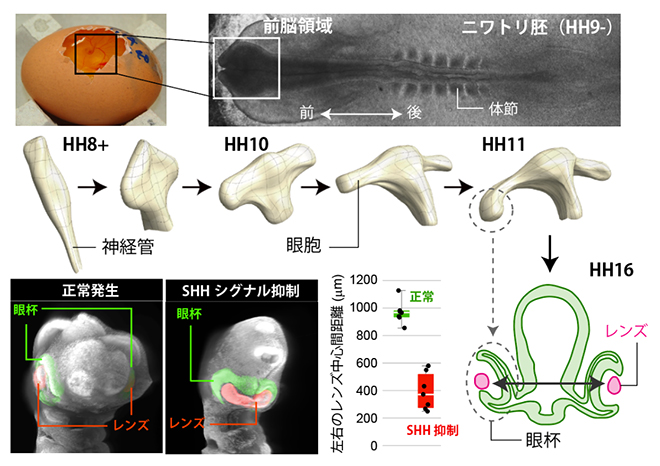
図1 前脳発生時の神経管の形態変化と正常胚・SHHシグナル抑制胚でのレンズ間距離
- 上段)卵の中で発生中のニワトリ胚と、発生ステージ9-の胚を背側から見た拡大図。
- 中段)神経管の形態の経時的変化。前方部(前脳)が左右に突起を形成し、眼胞となる。
- 下段)正常胚とSHHシグナル抑制胚での外形の比較写真(左)および左右のレンズ中心間距離の比較(右)。初期発生の適切な期間内にSHHシグナルを抑制すると、レンズ間の距離が短くなり、単眼症様の表現型となる。
研究チームは先行研究において、眼胞形成過程における組織変形パターンの定量解析を行い、(i)眼胞の伸長は細胞増殖を抑制しても正常に起こること、(ii)眼胞の先端だけでなく、前脳領域の全体にわたって、局所的な各組織片が側方軸方向に伸長し前後軸方向に収縮する「方向依存的な組織変形」により眼胞の伸長が実現されていることを明らかにしました注1)。これらの解析結果は、まず、眼胞の伸長が、細胞の分裂頻度の空間的な偏りや分裂方向の偏りなど細胞増殖を要因として進行するものではないことを示します。さらに、SHHシグナルの抑制が眼胞の伸長を阻害するという結果を合わせて考えると、SHHシグナルが方向依存的な組織変形を引き起こすための極性を持った細胞ダイナミクスを制御していることを強く示唆しています。
ショウジョウバエやゼブラフィッシュなどの組織形成を調べた研究では、SHHシグナルが分子モータータンパク質ミオシン[8]の活性を制御していることが分かっています。そこで、眼胞形成過程においてもSHHシグナルがミオシン活性[8]の局在や細胞形状の配向、細胞集団運動方向の制御に関与しているかを検討しました。先述のように、眼胞は神経管から左右の突起として形成されますが、形態的には背側と腹側で対称なT字形状をしています。その一方で、SHHシグナル活性は腹側のみに存在し、背腹非対称であることが知られています(図2左)。
ミオシン活性の細胞内分布を調べると、SHHシグナル活性が存在する腹側組織では、前後軸(頭尾軸)方向に沿った細胞間境界(エッジ)に強い局在を示しました。また、細胞形状も前後軸方向に明確な配向パターンを示しました(図2中)。これらの配向パターンは腹側でのSHHシグナルを抑制すると消失し、特にミオシン活性はエッジに局在はするものの、特定方向への局在はなくなり、ランダムな配向パターンを示しました(図2右)。これらの実験事実は、もともとSHHシグナル活性を持たない背側組織では、細胞形状とミオシン活性局在の配向性が腹側に比べて極めて弱いこととも整合する結果といえます。
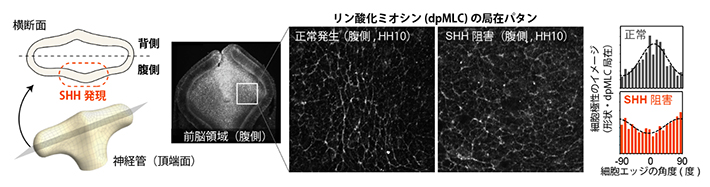
図2 正常胚腹側組織における細胞極性とSHHシグナル抑制による極性の消失
- 左)眼胞伸長時の神経管の模式図。神経管は形態的には背腹対称なT字型形状であるが、SHHシグナル活性は背腹非対称である。
- 中)前脳腹側領域の組織像。左の写真は前脳の水平断面像で、上が前側(頭側)を指す。四角で囲んだ領域の拡大像を右に示す。正常な腹側組織では、細胞形状、ミオシン活性局在(リン酸化ミオシン:dpMLC局在)ともに前後軸方向に強い配向を示すが、SHHシグナルを阻害するとこれらの極性は消失する。
- 右)前後軸(頭尾軸)方向を0度としたとき、細胞間境界(エッジ)やミオシン活性の局在がどの角度に分布しているかを示したグラフ。正常胚では0度付近にピークを持つ(前後軸方向に細胞エッジがそろう)が、SHHシグナルを阻害するとこれらがランダムになる。
また、組織内の細胞の動きについても興味深い結果が得られました。前脳領域の背側を外科的に切り取り、腹側組織のみにした神経管を作製しても眼胞は左右に伸長したのです(図3上段)。他方で、前脳領域の腹側を切り取ってしまうと、背側組織はそれ自身のみでは伸長しませんでした(図3下段)。これは、眼胞を左右に形成する神経管の自己組織化能が、前脳組織の腹側と背側で異なることを示します。つまり正常な発生過程では、腹側組織が能動的に形を変える自己組織化により、正常な眼胞形成を駆動する仕組みが機能していると結論できます。
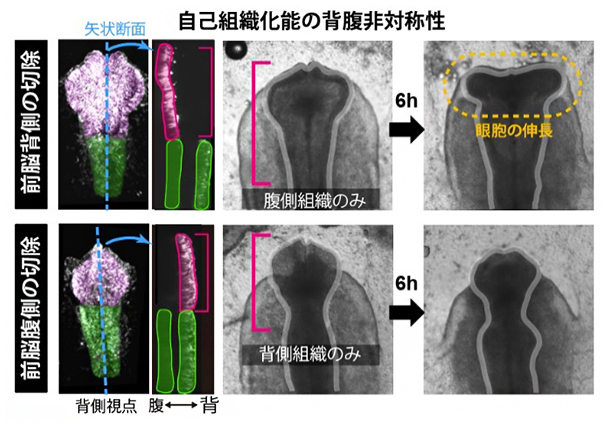
図3 自己組織化能の背腹非対称性
前脳領域の背側および腹側組織を切除すると、腹側組織はそれ単独で側方方向に伸長するが(上段)、背側組織のみにすると伸長は起こらない(下段)。この意味で前脳領域の自己組織化能には、背腹非対称性が存在する。
この自己組織化の過程において、細胞あるいは細胞集団レベルで何が起きているかを詳細に調べるため、二光子顕微鏡による高解像度イメージングを用いて個々の細胞を追跡し、細胞集団の変形量や細胞間の位置変化、細胞運動能の定量解析を行いました。その結果、背側領域が切り取られた状態では、腹側組織内の細胞は特定の方向に並び変わることで、集団として側方方向(前後軸と直交する方向)に伸長変形することが分かりました(図4上段)。一方、SHHシグナルを抑制すると細胞集団の変形方向はランダムになりました(図4下段)。ただ、細胞の隣同士の接触関係が変化する頻度や、個々の細胞移動距離の変化はなかったため、SHHシグナルは細胞の運動能には影響を与えず、細胞集団の運動の方向制御に関与していることが明らかになりました。
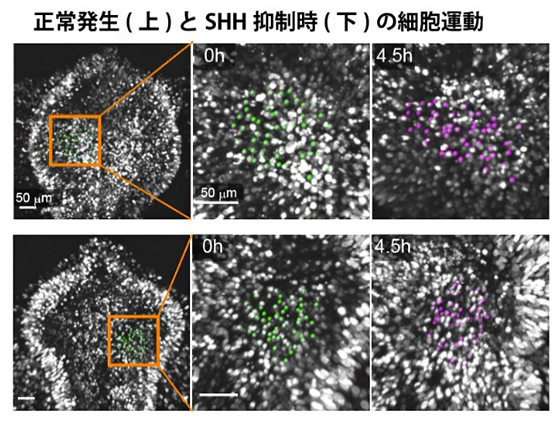
図4 SHHシグナル抑制時の腹側組織内の細胞運動
二光子顕微鏡を用いて、背側組織を切除した前脳領域の腹側組織内の細胞(核)軌道を計測した。緑で印をつけた核の4.5時間後の位置を紫で示す。正常組織(上段)では側方方向への伸長が見られる一方で、SHH抑制個体(下段)では組織伸長が大きく阻害される。
では、細胞内のミオシン活性の局在や細胞の形状・運動の「方向」は何によって決まるのでしょうか。最近研究が進んでいるメカノバイオロジー[9]の分野では、ミオシン活性や細胞運動と、その細胞が位置する組織内の「力」との関連が注目されており、細胞が周囲の環境から受ける力に反応する現象は細胞の力学応答と呼ばれます。
そこで、神経上皮組織に対して人工的に力を加えたときに、細胞内のミオシン活性の局在や細胞の運動にどのような影響があるかを調べました。具体的には神経管の前脳領域腹側組織を切り取り、組織伸展装置に貼り付けて、組織を弱く引っ張ることで、組織内に特定方向の引張応力を発生させ、細胞の力学応答を観察しました(図5左)。その結果、正常な組織では、ミオシン活性は力と平行な方向の細胞エッジに強く局在しました。つまり、細胞は力の方向を感じ取ることができるのです。さらに驚いたことに、各細胞の運動方向は、組織全体(細胞集団)が力と垂直方向に伸長するように調節されていました(図5右)。
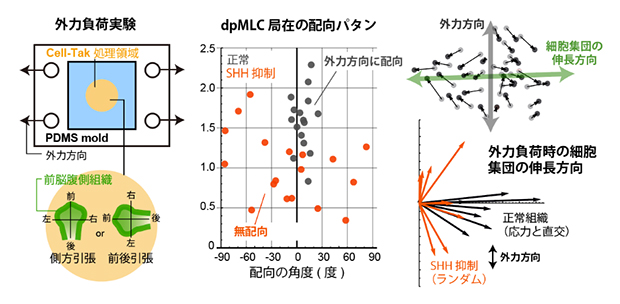
図5 外力負荷時の前脳腹側組織内での細胞応答
- 左)本実験で用いた組織伸展装置の模式図。組織用の接着剤(Cell-Tak)を塗布したシリコーンゴム(PDMS)に前脳腹側組織を貼り付け組織を引っ張ることで、人工的に応力を負荷することができる。
- 右)前後方向に引っ張った実験の結果。正常組織ではミオシン活性局在(dpMLC局在)は力と平行方向に配向する(黒丸)が、SHH抑制時には力の方向に関係なくミオシン活性局在は無配向となる(赤丸)。また、正常組織では細胞集団は能動的に動くことで外力と直交方向に伸長する(黒線)が、SHH抑制時には細胞集団はランダムな方向に変形する(赤線)。
日常的な感覚では、例えばゴムのような工業材料は引張力の方向と平行に材料は伸長します。しかし細胞集団の場合には、力の方向と伸長方向が直交したのです。これは、組織を構成する細胞が能動的に動くことで実現される「生物らしい」性質といえるでしょう。一方、SHHシグナルを抑制すると、ミオシン活性の局在も細胞集団の変形も、力の方向とは無関係にランダムな配向を示しました。
これらの外力負荷実験の結果から、SHHシグナルは、細胞に力覚を付与することで、細胞が力の方向を認識し自身の運動方向の決定を可能にするという、これまでに知られていた細胞増殖や分化制御とは異なる、SHHシグナルの新しい機能の発見につながりました。
最後に、3次元的な前脳領域内での応力パターン(各場所において引張応力が最大となる方向の空間パターン)を調べました。前脳組織は大きく、胚の深部にあり、レーザー破壊実験などによって直接力の方向を計測することができません。そこで、力学シミュレーションによって応力分布を見積もりました。現時点では前脳組織内の応力源は不明ですが、神経管内は生物流体で満たされているため、神経管内部に弱い静水圧の存在を仮定し、その条件下での組織内応力(最大主応力方向)の分布を計算しました(図6)。その結果、応力パターンは特に眼胞領域内ではクリアな前後軸方向の配向パターンを示し、組織の伸長方向と直交しました(図6右)。これは、前脳のT字形状をよく反映した応力パターンと解釈できます。
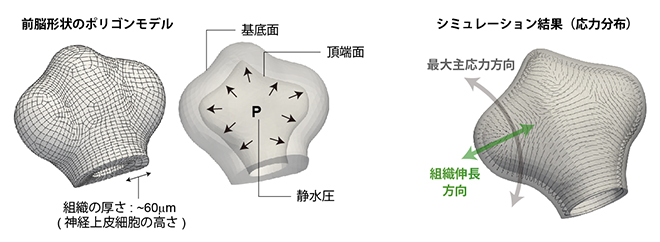
図6 力学シミュレーションによる応力計算
- 左)シミュレーションに用いた前脳形状のポリゴンモデル(複雑な立体を六面体の集合として近似したもの)。神経管内は液体(生物流体)で満たされているため、その液体による弱い静水圧の存在を仮定し、その条件下で前脳組織に発生する応力を計算した。
- 右)眼胞領域では前後軸方向に応力が最大になると見積もられた。
まとめると、前脳の正常発生過程では、(神経上皮)細胞はSHHシグナル依存的に組織内応力を認識し、これが細胞内極性を生み出し、応力と直交方向に再配列することで眼胞形成が進むことが明らかになりました。一方、SHHシグナルが抑制されると、細胞の力覚異常が生じ、動くべき方向を見失うことでランダムな組織変形を引き起こし、結果として眼胞伸長が阻害されます。眼胞の伸長阻害の結果、顔面の中央で左右のレンズが融合し単眼症を発症するという、奇形発症機構の一連の物理過程が明らかになりました。
- 注1)2017年5月2日プレスリリース「臓器が形作られる過程を復元する計算手法を開発」
今後の期待
本研究では、前脳初期発生過程においてSHHシグナルが抑制されると、細胞の力覚に異常が生じ、組織内で動くべき方向が分からなくなり、その結果正しく組織の形を作れず、単眼症という奇形が生じることが明らかになりました。本研究で研究対象とした前脳以外にも、さまざまな臓器ができる過程で、特定の方向にバイアスした組織の伸長・収縮が臓器固有の形作りのために必須であることが分かっています注2)。また、FGF[10]やWNT[10]といった、SHH以外の分泌因子(モルフォゲン[11])が、力学応答や組織伸長と関連することも報告されており、単眼症以外の先天性奇形の発症も、細胞の力覚異常による方向情報認識の喪失が原因である可能性は十分に考えられます。
そうした意味で、本研究を起点に、これまでに分子生物学が明らかにしてきた奇形の原因遺伝子と最終的なアウトプットである形態異常の間をつなぐ、物理プロセスの理解が進むことが期待できます。
同時に、形態異常の仕組みを理解することは、人為的な形態の制御可能性へとつながります。次世代再生医療の可能性の一翼を担うオルガノイド[12]研究において、臓器形態の成熟化は大きな壁の一つですが、本研究で明らかになった仕組みがその難問を解決する一つのきっかけになることも期待できます。
- 注2)2020年4月16日プレスリリース「心臓が左右非対称になる仕組み」
補足説明
- 1.力覚
細胞は、増殖因子のような化学シグナルだけではなく、細胞が存在する周囲の環境(隣接する細胞や細胞外基質を含む)から受ける「力」を感じて、自身の分裂、運動または分化状態を変化させることが知られている。このような細胞の能力を力覚(メカノセンセーション)と呼び、(1)細胞が周囲の環境から力を感知するプロセス(センシング)、(2)受け取った力を細胞内での化学シグナルに変換し伝達すること(トランスダクション)、(3)力に応じた細胞プロセスを引き起こすこと(レスポンス)の三つの要素から成る。 - 2.単眼症、全前脳胞症
全前脳胞症は、大脳などを含む前脳が左右に分離できずに生じる先天性形態異常の一つである。形態的には頭蓋顔面異常が認められる。形態異常の程度にはスペクトラムが見られ、重度のものでは眼の融合が見られる単眼症、軽度のものでは口唇裂および口蓋裂の症状が現れる。全前脳胞症の原因には、遺伝的要因と環境要因が知られており、原因遺伝子としてはSHH遺伝子を含むSHHシグナル経路の遺伝子群が含まれることが明らかになっている。なお、単眼症を表す英名Cyclopiaはギリシャ神話に登場する単眼の巨人サイクロプスに由来する。 - 3.SHH遺伝子
遺伝子の正式名称はソニックヘッジホッグ(sonic hedgehog)。遺伝子産物のSHHタンパク質は、細胞外に分泌される細胞増殖因子の一つである。脳や四肢などを含むさまざまな臓器の形成に関与し、細胞の増殖や分化状態を制御することが明らかになっている。また、腫瘍形成にも関わることが報告されているため、がん治療薬剤のターゲットとなる因子でもある。 - 4.眼胞
脊椎動物の発生過程では、神経管の最前部が前脳に分化した後、前脳の後部(間脳)から外側へ袋状の構造が外側に飛び出すように形成される。この袋状の構造を「眼胞」と呼ぶ。眼胞は発生が進むと眼杯となり、網膜が作られる。 - 5.力学シミュレーション
現時点では、前脳組織内の応力源は不明である。神経管内は生物流体で満たされているため、今回行ったシミュレーションでは神経管内部に弱い静水圧の存在を仮定し、その条件下での組織内応力(最大主応力方向)の分布を計算した。 - 6.組織内応力
応力は、単位面積当たりにかかる力のこと。生体組織では、細胞と細胞の間や、細胞と細胞外基質の間で押し合う力や引っ張り合う力が生じていると考えられ、これらの力を組織内応力と呼ぶ。 - 7.二光子顕微鏡
一般の蛍光顕微鏡法では、蛍光色素は1個の光子を吸収して蛍光を発する(一光子励起法)。これに対し、蛍光色素が2個の光子を同時に吸収して励起状態へと遷移し、蛍光を発する「二光子吸収」現象を応用したものを二光子顕微鏡と呼ぶ。二光子顕微鏡では、蛍光物質に一光子励起の半分のエネルギー(2倍の波長)の光子を2個吸収させるため、長波長帯域のレーザーを用いる。長波長の光は、組織など透過性が低い試料の内部に浸透しやすいことから、生体深部の観察に向いている。 - 8.ミオシン、ミオシン活性
ミオシンは、アデノシン三リン酸(ATP)の分解で生じる化学エネルギーなどを用いて、力学的な仕事をするモーター分子の一つ。筋肉型ミオシンと非筋肉型ミオシンが存在する。細胞を変形・収縮させる力は、細胞骨格アクチンとミオシンの働きにより生じる。この力を発生させるミオシンの活性は、リン酸化ミオシン(正確にはdi-phosphorylated myosin regulatory light chain, dpMLC)として検出できる。 - 9.メカノバイオロジー
生体における「力」の役割と仕組みを解明して、発生異常やがん、再生医療などの臨床的課題の解決をめざす分野。 - 10.FGF、WNT
SHHと同様に、細胞外に分泌されて標的細胞の増殖や分化などを制御するタンパク質。FGFの由来は線維芽細胞増殖因子(Fibroblast Growth Factor)、WNTの名称はショウジョウバエの遺伝子winglessとマウス乳がん遺伝子int-1に由来する。 - 11.モルフォゲン
濃度に応じて、細胞の運命を決定したり細胞の分化を誘導したりする分子。発生、変態、再生においては、モルフォゲンの局所的な産生によって濃度勾配ができ、こうした勾配のパターンが体の形作りを支配すると考えられている。 - 12.オルガノイド
発生過程を生体外で模倣することにより、多能性幹細胞または体性幹細胞から人工的に作製されるミニ臓器。臓器を標的とした創薬、再生医療への応用などが期待されている。現状の問題点としては、生体内の臓器の構造や機能を完全には再現していないことが挙げられる。このような問題点の解決に向け、世界中で研究開発が進んでいる。
研究チーム
理化学研究所 生命機能科学研究センター 発生幾何研究チーム
チームリーダー 森下 喜弘(モリシタ・ヨシヒロ)
上級研究員 大塚 大輔(オオツカ・ダイスケ)
研究員 木田 直樹(キダ・ナオキ)
研究員 李 尚雨(イ・サンウ)
客員研究員 川平 直史(カワヒラ・ナオフミ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)により実施し、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「組織変形動態解析を起点とした種間・器官間で保存された形態形成則の解明(研究代表者:森下喜弘)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「複雑な器官形態を実現する細胞集団運動方向のスイッチング機構-力学応答の観点から-(研究代表者:大塚大輔)」による支援を受けて行われました。
原論文情報
- Daisuke Ohtsuka, Naoki Kida, Sang-Woo Lee, Naofumi Kawahira, and Yoshihiro Morishita, "Cell disorientation by loss of SHH-dependent mechanosensation causes cyclopia", Science Advances, 10.1126/sciadv.abn2330
発表者
理化学研究所
生命機能科学研究センター 発生幾何研究チーム
チームリーダー 森下 喜弘(モリシタ・ヨシヒロ)
上級研究員 大塚 大輔(オオツカ・ダイスケ)
 森下 喜弘
森下 喜弘
 大塚 大輔
大塚 大輔
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
