理化学研究所(理研)生命機能科学研究センター比較コネクトミクス研究チームの幸長弘子研究員(研究当時)、宮道和成チームリーダー、福島県立医科大学生体情報伝達研究所生体機能研究部門の小林和人教授、加藤成樹准教授らの共同研究チームは、母体における出産・授乳時に鍵となるホルモン物質オキシトシン[1]を作る神経細胞(オキシトシン神経細胞)の脈動をリアルタイムに可視化する技術を開発しました。
本研究成果は、出産期・授乳期の母体機能を支える神経基盤を解明する上で重要な知見であり、将来的には産婦人科医療に貢献する基礎的知見へと発展するものと期待できます。
オキシトシンは出産時の子宮収縮に働くことが知られており、陣痛促進剤として利用されています。また、授乳時には母乳を乳腺から放出させる射乳と呼ばれる機能に必須です。陣痛や射乳に際して、オキシトシンは数分に1回の波(パルス)として脳下垂体から分泌され、子宮や乳腺に到達しますが、このリズムを作り出す仕組みはよく分かっていません。
今回、共同研究チームは、遺伝学ツールの発達したマウスを用いて、出産や授乳時のオキシトシン神経細胞の活動を詳細に記録することに初めて成功しました。また、オキシトシン神経細胞への入力神経マップを作製し、これを基に特定の神経細胞を活性化することで、母体におけるオキシトシンの脈動を人為的に操作できることを示しました。
本研究は、科学雑誌『Current Biology』オンライン版(7月21日付:日本時間7月22日)に掲載されました。
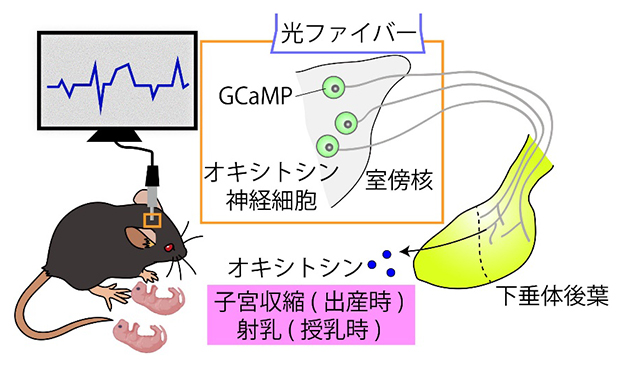
出産中や授乳中のオキシトシン神経細胞の活動をモニターするシステム
背景
出産時の陣痛には波があります。ヒトの場合、最初は10分間隔ほどの陣痛が発来し、お産の進行とともにペースが速くなり、かつ一つ一つの波が高くなっていきます。この波を作り出している正体の一つは、子宮収縮をつかさどるホルモン物質のオキシトシンです。脳視床下部[2]の室傍核[2]や視索上核[2]と呼ばれる領域には、オキシトシンを合成する神経細胞(オキシトシン神経細胞)があり、お産の進行に合わせて数分に一度激しく活動して大量のオキシトシンを血中に分泌します。これが子宮に到達して、子宮収縮のリズムを生み出していると考えられています。陣痛はいつ始まるのか、どのように進行するのかといった妊産婦や家族にとって重要な問題に対して、現時点では具体的な予測ができません。この一因には、オキシトシンの脈動リズムを作り出す仕組みがよく分かっていないことが挙げられます。
出産に比べるといささか分かりにくいですが、授乳にも波があります。ここでも鍵となるのはオキシトシンです。子が乳頭に吸い付く吸啜(きゅうてつ)刺激を母体に与えると、その情報は母体の脳のオキシトシン神経細胞を活性化させ、大量のオキシトシンが血中へと分泌されると考えられています。これが乳腺を収縮させて、貯蔵されていた母乳を乳管へと放出させます。この一連の反応を「射乳反射[3]」と呼びます。射乳反射はコンスタントに続くわけではなく、子が吸啜を続けていても全くオキシトシンの分泌されない時間が続き、約5分に1回、数秒間だけ大量のオキシトシンが分泌されます。このリズムを作り出す仕組みもよく分かっていません。
このように、出産や授乳におけるオキシトシンの分泌は神経内分泌学という分野で長らく研究されてきた題材ですが、現代の神経科学の観点からみて非常に基本的な部分に未解明の問題が残されています。これらの問題を解き明かすことは、出産期や授乳期の生活の質(QOL)を改善するためのさまざまな技術に貢献すると考えられます。
共同研究チームは、出産や授乳におけるオキシトシンの脈動リズムを研究する第一歩として、遺伝学的なツールの発達した実験動物であるマウスを用いて、オキシトシン分泌リズムを直接観察する技術を開発することが必要だと考えました。そこで、ファイバーフォトメトリー[4]と呼ばれるイメージングツールを、出産期や授乳期におけるマウスのオキシトシン神経細胞を観察する手法として世界で初めて用いました。
研究手法と成果
共同研究チームはまず、脳視床下部室傍核のオキシトシン神経細胞の活動を視覚的に捉えるため、カルシウムイオン(Ca2+)センサーとして働くタンパク質GCaMP[4]を妊娠している雌マウスに発現させました(図1A)。一般に、神経細胞が活動すると細胞内Ca2+の濃度が上昇し、GCaMPの蛍光強度の変化として可視化できます。GCaMPが正しくオキシトシン神経細胞に発現し、それ以外の細胞に発現していないことを確かめてから、室傍核の直上に光ファイバーを設置しました。出産予定日の前日から、雌マウスをファイバーフォトメトリーにつないで出産、その後の授乳の様子を観察しました。GCaMPの蛍光強度を捉えるのに加えて、マウスのケージを横と下からビデオ撮影し、母仔の様子も記録しました。
出産時のオキシトシン神経細胞は、仔が完全に膣外に出てくる10~15分前からリズミカルな活動を開始し、このリズムは娩出に至るまで持続することが分かりました(図1B)。さらに、出産期から授乳期までを連続して観察すると、分娩の終了からおよそ4時間後に母マウスが仔にまたがって授乳行動を開始し、出産時よりもはるかに高くリズミカルな波が発生する様子が捉えられました(図1C)。これらの観察は、マウスにおいて自然に進行する出産におけるオキシトシン神経細胞の活動パターンを初めて明らかにしたものです。
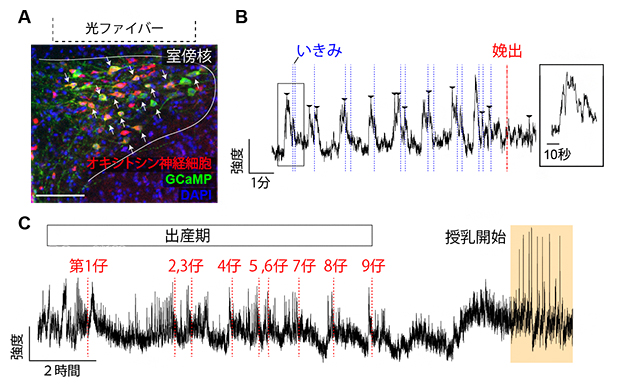
図1 出産におけるオキシトシン神経細胞の活動記録
- A.遺伝学的な手法を用いて脳視床下部室傍核のオキシトシン神経細胞(抗体染色により赤に染色)に特異的にCa2+インディケータ―として働くGCaMP(緑色に染色)を発現させた。DAPIは細胞の核を青く染色する試薬である。この手法でGCaMPを発現する緑色の細胞の大多数はオキシトシン神経細胞であることを確認した上で、光ファイバーを室傍核の直上に設置した。スケールバーは100マイクロメートル(μm、1μmは1,000分の1mm)。
- B.1匹の仔が産まれるまでの約10分間のフォトメトリーデータ。矢頭はオキシトシン神経細胞の活動ピークを示す。母体をビデオ観察し、腹部の収縮から「いきみ」を測定し青色破線で示した。「いきみ」はオキシトシン神経細胞の活動に続いて発生することが分かる。赤色破線は、仔が完全に膣外に娩出された時間を示す。右側の四角は一つの波を拡大したもの。波形の半値幅(ピーク最大値の半分に立ち上がってからピークに達し、半分に落ちるまでの波形の幅)は平均すると約8秒であった。
- C.出産期から授乳期への移行を継続的に観察した例。この母マウスは9匹の仔を娩出(赤色の破線)し、4時間ほど経過してから授乳を開始した。出産期に比べて、授乳期の方がより大きな波が規則正しく発生している様子が見られる。
次に、授乳期の母マウスにおけるオキシトシン神経細胞の活動を記録しました。出産後12日目の母マウスを一晩観察すると、非常に明瞭な神経活動のピークが観察されました(図2A)。このマウスは12時間の間に62回のピークを示しましたが、分布は明らかに一様ではなく、かたまり(クラスター)を作っていました。このことから、活発に授乳する時間帯と休憩している時間帯があると考えられます。クラスターの中では、およそ5分に1回のリズムが観察されました。
さらに継続して観察すると、授乳期の進展に伴って興味深い変化があることが分かりました。どの個体も、出産後1日目には波が小さいものの、授乳を続けると波が高くなり12日目までにはおよそ2倍の高さになりました。また、離乳後に再び妊娠・出産を経験すると、波の高さはいったん元に戻って、それからまた大きくなることも分かりました(図2B)。
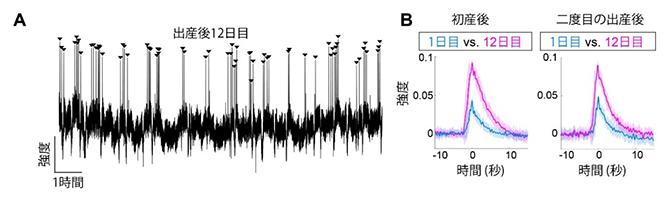
図2 授乳期におけるオキシトシン神経細胞の活動記録
- A.出産後12日目の母マウスにおけるオキシトシン神経細胞の代表的な活動記録(連続12時間)。矢頭はオキシトシン神経細胞の活動ピークを示す。オキシトシン神経細胞が活発に活動する時期(ピークがクラスターになっている)においては、おおむね5分に1回のリズムが見られた。
- B.オキシトシン神経細胞の波形を経時的に比べたもの。左グラフのシアン、マゼンタの実線は初産後の初日と12日目に見られたオキシトシン神経細胞のパルス状活動の平均を示し、それぞれの色の影は分散を示す。右グラフには同一の雌マウスを離乳後に再び妊娠・出産させた後、1日目と12日目を同様に比較したもの。いずれも、出産後の1日目の波に対して、12日目の波はおよそ2倍の高さになった。
授乳を続けると波が高くなる変化の理由には、仔が成長して吸啜が強くなったためか、それとも母マウス側でオキシトシン神経細胞自身が変化しているのかの二つの可能性が考えられます。そこで、生後間もない仔と十分成長した仔を用意して、人為的に仔を入れ替える里子実験を行いました。その結果、母マウスの示すオキシトシン神経細胞の活動ピークの高さは仔の日齢に影響を受けませんでした。従って、母マウスのオキシトシン神経細胞には自身の授乳経験に依存して、自律的に活動の強度を変化させる仕組みがあると考えられます。この自律的変化は、仔の成長に合わせて射乳反射の強度を調整する上で適応的だと考えられますが、その仕組みの解明には今後の研究が必要です。
ここまでの結果から、出産・授乳におけるオキシトシン神経細胞の脈動をリアルタイム・長期的に直接観察できることが初めて示されました。このリズムがどのような神経回路によって生み出されるのかという問題の解明に対する第一歩は、オキシトシン神経細胞に入力する上流の神経細胞を網羅的に可視化することです。
そこで、特定の神経細胞に入力するシナプス前細胞を特定するトランスシナプス標識法[5]を用いて、オキシトシン神経に入力する神経細胞のマップを作製したところ、視床下部のさまざまな神経核や視床下部の外側の構造、例えば分界条床核(BST)[6]に多くの標識が見られました(図3A)。標識された神経細胞の傾向を非妊娠状態の雌マウスと出産後1日目の母マウスで比較したところ、大きな違いは見つかりませんでした。また、標識される細胞の種類を調べてみると、興奮性、抑制性いずれのタイプの神経細胞も見いだされましたが、BSTではほとんどが抑制性の神経細胞でした。
そこで、新たに見つかった入力神経細胞の役割を調べるために、薬理遺伝学[7]を用いてこれらの神経細胞の活動を制御する実験を行いました。授乳中の母マウスに薬剤CNO[7]を投与してBSTの抑制性神経細胞を人為的に活性化すると、薬の効いている期間にオキシトシン神経細胞の脈動が少なくなることが分かりました(図3B-D)。この結果は、上流の神経回路への介入によってオキシトシン神経細胞の脈動を変動させることが可能なことを初めて明らかにしたものです。
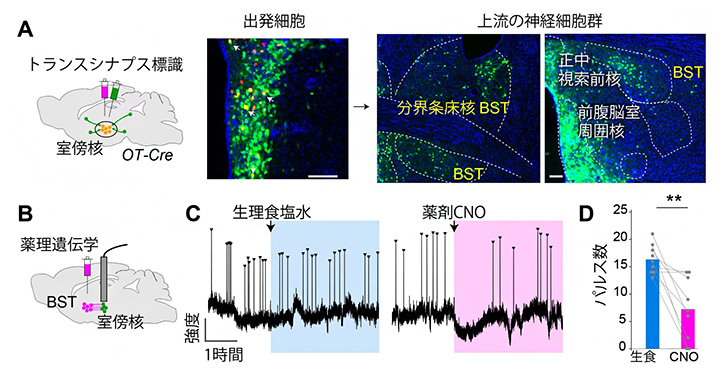
図3 神経回路に基づいてオキシトシン神経細胞の脈動を操作した結果
- A.(左図)トランスシナプス標識実験の模式図。室傍核のオキシトシン神経細胞を標識の起点とするため、2種類のウイルス試薬を導入した。まず、標識の起点を赤色に標識するウイルス試薬を打ち込み、次にこの赤色の細胞に感染して一段階だけ上流の神経細胞へとシナプス結合を経由して(トランスシナプス)感染を広げることのできるウイルス試薬(緑色蛍光タンパク質を発現し緑色に見える)を注入した。これにより、オキシトシン神経細胞とシナプス形成する一段階上流の神経細胞のみが緑色蛍光タンパク質で標識される。
(右写真)標識の起点となる出発細胞(中央写真の黄色の細胞、室傍核のオキシトシン神経細胞の一部。スケールバーは100μm)、および標識された上流の神経細胞群(右2枚。スケールバーは200μm)。さまざまな領域の神経細胞が標識されたが、本研究では黄文字で示した分界条床核(BST)に着目した。青の染色は細胞核を示す。 - B.薬理遺伝学実験の模式図。室傍核のオキシトシン神経細胞(緑)の活動をモニターしつつ、BSTに薬理遺伝学ツール(赤色の試薬)を導入した。
- C.CNO投与によりBSTの抑制性神経細胞を人為的に活性化した後のオキシトシン神経細胞の代表的な脈動パターン(矢頭)。対照実験(生理食塩水投与)と比較して、CNO投与後に脈動が減少した。
- D.生理食塩水(生食)あるいはCNO投与後3.5時間に起きたオキシトシン神経細胞の脈動(パルス)の頻度。**比較した二群の有意水準、p<0.01。
今後の期待
本研究では、遺伝子ノックアウトやウイルスツールなどさまざまな実験系が発達したマウスを用いて、母性機能に関連したオキシトシン神経細胞の活動を捉える技術の開発に成功しました。
本成果は、出産や授乳におけるオキシトシン神経細胞の脈動を作り出す分子基盤や神経回路基盤の解明に貢献するとともに、授乳の「質」や「量」に影響を与える遺伝的要因と環境因子の探索を促進し、授乳期のQOLの改善に貢献する技術の開発につながるものと期待できます。
特に、母親において子からの吸啜シグナルがオキシトシン神経細胞を強く活性化させる神経経路や増強の仕組みが解明できれば、人為的に効率良くオキシトシン系を活性化させる技術の開発につながる可能性があります。オキシトシン系の活性化は自閉症などの神経疾患の治療戦略としても着目されていることから、本研究の成果は母性機能の理解を超えた重要性を持つと考えられます。
補足説明
- 1.オキシトシン
視床下部室傍核や視索上核に存在するオキシトシン神経細胞によって合成され、下垂体後葉から分泌されるホルモンである。9個のアミノ酸残基から構成されるペプチドホルモンで、1906年、ヘンリー・デールによって子宮筋の収縮活性を指標に発見された。ヒトや愛玩動物の陣痛促進剤として広く使用されている。近年、古典的な母性機能に加えて、男性の生殖機能の制御や、両性ともに社会親和性を亢進させる作用が着目され、活発に研究が進められている。 - 2.脳視床下部、室傍核、視索上核
脳視床下部は、内分泌や自律機能の調節を担い生理機能をつかさどる中枢領域。視床下部は特定の機能をつかさどる数多くの神経核(細胞の集まり)から構成されており、室傍核や視索上核はその一つである。室傍核はオキシトシン神経細胞のほか、抗利尿ホルモンとして有名なバソプレシンや、ストレス応答に重要なコルチコトロピン放出ホルモンを分泌する神経細胞などから構成され、神経内分泌の中枢の一つである。 - 3.射乳反射
授乳期にプロラクチンなどの指令を受けて産出された母乳は、乳腺葉に貯蔵されているが、そのままでは子に届かない。子が乳頭に対して吸啜(きゅうてつ)刺激を与えると、感覚神経を介したシグナルが視床下部のオキシトシン神経細胞を活性化させ、下垂体後葉からオキシトシンの分泌に至る。オキシトシンが乳腺を収縮させると、母乳が乳管へと射出されることで、子に届くようになる。オキシトシンは射乳反射に必須の機能を持ち、オキシトシン遺伝子を欠損する変異マウスは重篤な授乳障害を呈する。 - 4.ファイバーフォトメトリー、GCaMP
ファイバーフォトメトリーはin vivo(生体内)蛍光検出法の一つ。脳などの臓器に蛍光プローブを導入後、その直上に光ファイバーを埋め込み、光ファイバーを介して励起光の照射と蛍光の検出を行う。蛍光プローブとしては、本研究でも使用したGCaMPなどのカルシウムイオン(Ca2+)センサーがよく用いられる。GCaMPは、緑色蛍光タンパク質、カルモジュリンのCa2+結合部分、ミオシン軽鎖キナーゼのM13ペプチドを遺伝子工学的に結合させたCa2+センサー蛍光タンパク質で、Ca2+が結合すると蛍光の明るさが変化する。Ca2+センサーのほかにも、シグナル伝達分子活性の可視化や小分子リガンドの検出などさまざまな用途に応用可能であるが、空間解像度は低く、通常、数百の細胞の集団的な蛍光強度変化を捉える手法である。 - 5.トランスシナプス標識法
ある神経細胞群へシナプス入力を送るシナプス前細胞群を網羅的に可視化する手法。本研究では、室傍核のオキシトシン神経細胞のシナプス前細胞を可視化した。本手法で用いた改変型の狂犬病ウイルスは、(i)哺乳類が本来持っていないTVAという受容体を人為的に発現させた細胞にだけ感染する、(ii)感染後にシナプス前細胞に広がるために必須なタンパク質RG(rabies glycoprotein)を作れない、そして(iii)感染した後に緑色蛍光タンパク質を発現する、という改変を施されている。そこで標的の細胞にTVAに加えてRGを発現させておくと、狂犬病ウイルスが特異的に感染した上で、宿主細胞の発現するRGを使って機能的なウイルス粒子を再構成できる。このウイルス粒子は一段階上流の細胞へと感染するが、そこではRGが発現していないためにウイルスはそれ以上広がることなく停止する。こうして、標的細胞から一段階だけ上流に位置する細胞を網羅的に標識できる。 - 6.分界条床核(BST)
分界条床核はストレス応答の中継核として知られ、高次脳領域からの下降性シグナルを視床下部-下垂体-副腎軸へと伝達する機能が想定されている。また、げっ歯類では同種他個体からの社会的シグナルや天敵の情報を伝達する鋤鼻嗅覚系の中継核としても知られている。BSTはbed nucleus of stria terminalisの略。 - 7.薬理遺伝学、CNO
神経科学のツールとしての薬理遺伝学とは、ある薬剤に特異的に応答して神経活動を操作できる人工的な受容体を用いて、特定の神経細胞集団の活動を操作する技術を指す用語である。本研究では、ヒトのアセチルコリン受容体を改変して薬剤CNOにより人為的に活性化され、神経活動を亢進させるhM3Dが用いられた。
共同研究チーム
理化学研究所 生命機能科学研究センター 比較コネクトミクス研究チーム
チームリーダー 宮道 和成(ミヤミチ・カズナリ)
研究員(研究当時) 幸長 弘子(ユキナガ・ヒロコ)
テクニカルスタッフ 萩原 光恵(ハギハラ・ミツエ)
テクニカルスタッフ(研究当時) 辻本 和子(ツジモト・カズコ)
パートタイマー(研究当時) シャオリン・チャン(Hsiao-Ling Chiang)
福島県立医科大学 生体情報伝達研究所 生体機能研究部門
教授 小林 和人(コバヤシ・カズト)
准教授 加藤 成樹(カトウ・シゲキ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業若手研究「周産期におけるオキシトシン神経回路の構造・機能的イメージング」(研究代表者:幸長弘子)、同基盤研究(B)「妊娠期における神経回路の再編による母体機能の制御」(研究代表者:宮道和成)、科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「比較光遺伝学: 社会行動を司る神経回路の進化」(研究代表者:宮道和成)などによる支援を受けて行われました。
原論文情報
- Hiroko Yukinaga, Mitsue Hagihara, Kazuko Tsujimoto, Hsiao-Ling Chiang, Shigeki Kato, Kazuto Kobayashi, & Kazunari Miyamichi, "Recording and Manipulation of the Maternal Oxytocin Neural Activities in Mice", Current Biology, 10.1016/j.cub.2022.06.083.
発表者
理化学研究所
生命機能科学研究センター 比較コネクトミクス研究チーム
チームリーダー 宮道 和成(ミヤミチ・カズナリ)
研究員(研究当時) 幸長 弘子(ユキナガ・ヒロコ)
福島県立医科大学 生体情報伝達研究所 生体機能研究部門
教授 小林 和人(コバヤシ・カズト)
准教授 加藤 成樹(カトウ・シゲキ)
 宮道 和成
宮道 和成
 幸長 弘子
幸長 弘子
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
福島県立医科大学 医療研究推進課
Tel: 024-547-1794
Email: rs [at] fmu.ac.jp
※[at]は@に置き換えてください。
