理化学研究所(理研)生命医科学研究センター 免疫器官形成研究チームの古関 明彦 チームリーダー(千葉大学 大学院医学研究院 細胞分子医学 教授)、千葉大学 大学院医学薬学府の高野 淳一朗 大学院生(研究当時、現理研 免疫器官形成研究チーム特別研究員)、東京理科大学 生命医科学研究所免疫アレルギー部門の伊川 友活 教授らの国際共同研究グループは、エピジェネティクス[1]制御因子のポリコム抑制性複合体(PRC)[2]の一つであるPCGF1[3]-PRC1が、DNA複製フォーク[4]の近くで転写活性化因子[5]の接近を阻害することで、新生DNA鎖上のクロマチン[6]環境を整え、造血前駆細胞[7]の分化能を維持していることを発見しました。
本研究成果は、細胞増殖と細胞分化の関連についての理解を深め、細胞運命制御機構の解明、ならびに造血器腫瘍発症機序の理解につながると期待できます。
従来、クロマチンの状態が遺伝子の発現状態および細胞運命を決定するため、増殖中の細胞がその特性を維持するには、分裂時にクロマチン構造が的確に継承される必要があると考えられてきましたが、そのメカニズムは未解明でした。
今回、国際共同研究グループは、PCGF1-PRC1の構成要素であるPCGF1を欠損させた造血システムの動態、ならびに造血前駆細胞の新生DNA鎖上のクロマチン環境を解析し、PCGF1-PRC1がクロマチン継承を介した分化能維持に重要であることを示しました。
本研究は、オンライン科学雑誌『Nature Communications』(11月28日付)に掲載されました。
背景
およそ70年前、「分裂して生じる二つの娘細胞は同等ではなく、特定の遺伝子の活性化に違いがあり、この違いの要因は遺伝子を覆うクロマチンにある。すなわち、覆われていた遺伝子が露出したときのみ活性化が起こる」という概念が提唱されました。以来、細胞分裂時に娘細胞に継承されるクロマチンの状態が遺伝子の発現状態、ひいては細胞運命を決定すると広く考えられてきました。
初期造血において、造血前駆細胞は細胞分裂を続ける過程で次第に個性を獲得し、異なる系統へ分化していきます。その際、DNA複製時に複製フォーク(二本鎖DNAが解離した領域)が通過するとクロマチン構造は崩壊し、直ちに新生DNA鎖上に再構築されますが、造血前駆細胞の分化能を保持するには、新生DNA鎖上へのクロマチンが的確に継承される必要があります。しかし、その機構は不明でした。
ポリコム抑制性複合体(PRC)はヒストン修飾を介して遺伝子発現を規定し、細胞特性の維持に寄与するエピジェネティクス制御因子です。ヒストンH2Aの119番目のリジン残基(H2AK119)のモノユビキチン化(H2AK119ub1)を担うPRC1、ヒストンH3の27番目のリジン残基(H3K27)のメチル化(H3K27me3)を行うPRC2の二つの複合体が協調し、標的発生関連遺伝子の発現を抑制することで機能します。PRC1には六つの亜型があり、PCGF1を含む異性型PRC1(PCGF1-PRC1)は比較的新しく同定されたものです。
血球系細胞の細胞運命を維持するには、PRC1に形成される抑制状態が必須です。また、これまでにDNA複製期におけるPRC1の複製フォーク近くへの局在が報告されていましたが、複製フォーク上でのPRC1の機能は不明でした。
以上から、国際共同研究グループはPRC1が複製フォーク近くで、新生DNA鎖上への的確なクロマチン構造の継承ならびに細胞運命決定に重要な役割を担うのではないかと考えました。
研究手法と成果
国際共同研究グループは、まず新生DNA鎖上のタンパク質を抽出するiPOND法[8]とプロテオーム解析[9]を組み合わせた手法により、造血前駆細胞においてPCGF1-PRC1が複製フォーク近くに局在していることを見いだしました。
そして、PCGF1を欠損させると、BRG1をはじめとした転写活性化に関わるクロマチンリモデリング因子[10]が新生DNA上に過剰蓄積することを発見しました。この結果、新生DNA鎖上のクロマチン構造が不安定化し、PCGF1の結合したミエロイド系[11]遺伝子座におけるヌクレオソーム(ヒストン八量体をDNAが取り巻いたクロマチンの基本単位)の密度が低下することを、MNase-Seq法[12]とiPOND法を組み合わせた解析により示しました(図1の青線→黒線)。
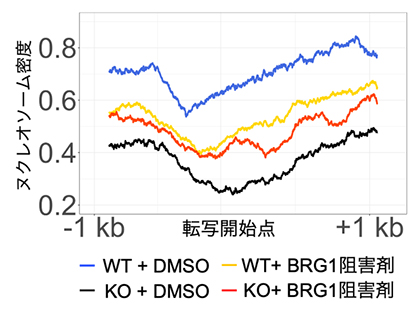
図1 PCGF1欠損によるヌクレオソーム密度の低下とBRG1阻害剤によるその回復
WTは野生型、KOはPCGF1欠損型、DMSOは溶媒。PCGF1欠損型のヌクレオソーム密度は、野生型に比べて大きく低下する(青線から黒線)。しかしこの低下は、BRG1(クロマチンリモデリング因子)阻害剤を作用させることで、部分的に回復する(黒線からオレンジ線)。この結果は、PCGF1によるBRG1の接近阻害作用が、ヌクレオソーム維持に重要であることを示している。
ヌクレオソーム密度は、PRC2によるH3K27me3修飾を介した遺伝子発現抑制に重要ですが、クロマチン免疫沈降法[13]を用いて解析したところ、ヌクレオソーム密度低下の結果、PCGF1欠損下ではH3K27me3を介したミエロイド系遺伝子の発現抑制が破綻していることが分かりました。
一方、PCGF1欠損に伴なうミエロイド系遺伝子の異常発現により、in vivo(生体内)でミエロイド系細胞の分化が亢進することを、一細胞RNAシーケンス法[14]を用いて、一細胞レベルで証明しました(図2)。
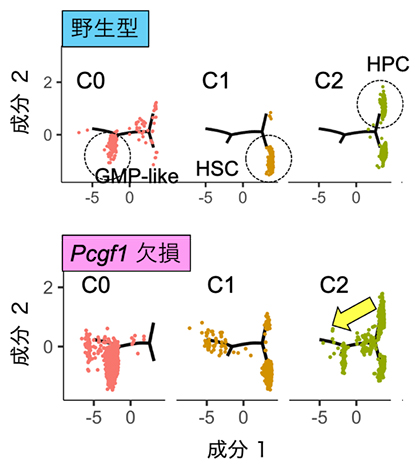
図2 PCGF1欠損によるミエロイド系細胞の分化亢進
GMPは顆粒球マクロファージ前駆細胞(ミエロイド系の前駆細胞)、HSCは造血幹細胞、HPCは造血前駆細胞。Pcgf1遺伝子を欠損させると、GMPの増多が見られ、HSC、特にHPCではミエロイド系細胞方向への分化の系譜がはっきりと出現している(黄矢印)。
さらに、PCGF1-PRC1標的遺伝子の一つで、上述したメカニズムで抑制されるミエロイド系遺伝子をノックダウン[15]したところ、造血前駆細胞の分化異常が部分的に回復しました。従って、PCGF1-PRC1はDNA複製期に、クロマチン環境を最適化することで、ミエロイド系遺伝子の発現およびミエロイド系分化の亢進を制御する可能性が示されました(図3)。
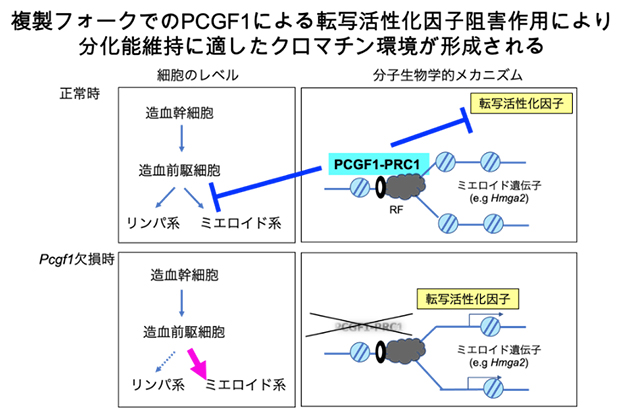
図3 本研究の概念
複製フォーク近くに局在したPCGF1-PRC1がBRG1をはじめとした転写活性化因子の接近を阻害することで、クロマチン継承を最適化し、造血前駆細胞の分化能を維持している。
今後の期待
本研究では、これまで未知であった複製フォーク近くでのPRC1の機能を明らかにするとともに、クロマチン継承が細胞運命決定において担う重要な役割の具体例を提唱しました。
DNA複製に関連したプロセスの異常が悪性疾患の発症につながることを考えると、DNA複製におけるPCGF1-PRC1の機能の理解は、エピジェネティクス研究の新しい視座を切り拓く可能性があるのみでなく、悪性腫瘍の成因の理解、治療戦略の開発にも貢献すると考えられます。実際、PCGF1-PRC1は造血器腫瘍の分野においても注目を集めており、例えば、骨髄異形成症候群においては、PCGF1-PRC1の構成要素の一つであるBcor遺伝子の機能喪失性の変異が一定頻度で見られます。したがって、フォーク上のPCGF1-PRC1の機能を明確にすることは、疾患の成因の解明および治療法の開発につながる可能性があリます。
補足説明
- 1.エピジェネティクス
先天的に遺伝されるDNA配列によるものではなく、後天的な遺伝子発現制御メカニズム(DNAのメチル化やヒストン修飾など)の総称。 - 2.ポリコム抑制性複合体(PRC)
複数のポリコムタンパク質が集合した複合体で、大きく分けてPRC1とPRC2の2種類に分けられる。PRC1はヒストンH2Aの119番目のアミノ酸残基であるリジンのモノユビキチン化(H2AK119ub1)、PRC2はヒストンH3の27番目のアミノ酸残基であるリジンのメチル化(H3K27me3)により、それぞれ抑制性のヒストン修飾を行う。PRCはpolycomb repressive complexの略。 - 3.PCGF1
PRC1のサブタイプを規定するPRC1構成因子の一つ。PCGF因子にはPCGF1からPCGF6まである。PCGF1を持つPRC1はPCGF1-PRC1、PCGF2を持つPRC1はPCGF2-PRC1と区分される。 - 4.複製フォーク
DNA複製を可能にするために二本鎖DNAが解離した領域。 - 5.転写活性化因子
DNAに結合するタンパク質の一群で、DNAの遺伝情報をRNAに転写する過程を促進する。 - 6.クロマチン
真核生物のDNAは、細胞内では主にヒストンに覆われた状態で存在し、この構造をクロマチンと呼ぶ。一般的なヒストンには、H2A、H2B、H3、H4の4種類があり、これらが円盤状の八量体を形成し、DNAは八量体の周囲に1.75回転巻きついた状態で結合している。ヒストンのアミノ末端には、ヒストンテールと呼ばれる不安定な領域があり、この領域のアミノ酸はユビキチン化やメチル化などの化学修飾を受けやすい。 - 7.造血前駆細胞
造血幹細胞が成熟血液細胞(赤血球、白血球など)へ分化する過程において、中間段階に存在する細胞。造血幹細胞とは異なり、自己複製能は持たないが多能性を示す。 - 8.iPOND法
チミジンの類縁体であるEdU(5-ethynil-2'-deoxyuridine; 5-エチニル-2'-デオキシウリジン)はDNAに取り込まれるため、新しく合成されたゲノムDNAを標識することができる。そのEdUでラベルされたDNA鎖に、クリック反応を用いてビオチンを結合させ沈降させることで、新生DNAと結合タンパクを抽出する方法。iPONDはisolation of proteins on nascent DNAの略。 - 9.プロテオーム解析
細胞内に存在する全タンパク質の集団を、質量分析法をはじめとした手法で解析する方法。 - 10.クロマチンリモデリング因子
ゲノムの狭い領域において、クロマチンの構造や位置を変化させる(リモデリングを行う)タンパク質複合体。その一例がSWI/SNFで、少なくとも10~12個のタンパク質からなる。サブユニットのうちBRG1が、ATPを利用したリモデリング作用を担う。 - 11.ミエロイド系
白血球は、大きくミエロイド系とリンパ球系に分けられる。ミエロイド系細胞は異物を貪食(どんしょく)する作用を持ち、マクロファージと顆粒球が含まれる。 - 12.MNase-Seq法
ヌクレオソームのDNA結合領域を明らかにする手法。ミクロコッカス・ヌクレアーゼを用いてモノヌクレオソームにまで断片化したDNAフラグメントを次世代シーケンサー(多量のDNA断片の配列を解読する装置)で解析する。 - 13.クロマチン免疫沈降法
目的とするタンパク質の特異的抗体を用いて、クロマチンを精製する方法。この手法により、目的とするタンパク質(本研究ではH3K27me3)が結合しているDNAを回収できる。 - 14.一細胞RNAシーケンス法
次世代シーケンサーを用いることで、個々の細胞が保持しているmRNA全体を質的、量的に網羅的に調べる方法。 - 15.ノックダウン
特定の遺伝子の転写量を減少させる操作。
国際共同研究グループ
理化学研究所 生命医科学研究センター
免疫器官形成研究チーム
チームリーダー 古関 明彦(コセキ・ハルヒコ)
(千葉大学 大学院医学研究院 細胞分子医学 教授)
研究員 伊藤 伸介(イトウ・シンスケ)
研究員 トウ・ギシン(Yixin Dong)
専任研究員 ジャファル・シャリフ(Jafar Sharif)
研究員 宮井 智浩(ミヤイ・トモヒロ)
上級研究員 近藤 隆(コンドウ・タカシ)
テクニカルスタッフⅡ 古関 庸子(コセキ・ヨウコ)
専門技術員 飯塚 裕介(イイヅカ・ユウスケ)
専門技術員(研究当時) 池谷 美香(イケガヤ・ミカ)
マイクロバイオーム研究チーム
研究員 梅山 大地(ウメヤマ・タイチ)
統合ゲノミクス研究チーム
研究員 韓 龍雲(ハン・ヨンウン)
ゲノム制御ネットワーク研究チーム(研究当時)
チームリーダー(研究当時)エリック・アーナー(Erik Arner)
(現 トランスクリプトーム研究チーム 客員主管研究員)
千葉大学 大学院医学薬学府 細胞分子医学
大学院生(研究当時)高野 淳一朗(タカノ・ジュンイチロウ)
(現 理研 生命医科学研究センター 免疫器官形成研究チーム 特別研究員)
東京理科大学 生命医科学研究所 免疫アレルギー部門
教授 伊川 友活(イカワ・トモカツ)
大学院生 崎原 瑞希(サキハラ・ミズキ)
東京大学 医科学研究所 幹細胞治療研究センター 幹細胞分子医学
教授 岩間 厚志(イワマ・アツシ)
助教 中島 やえ子(ナカジマ・ヤエコ)
和歌山県立医科大学 動物実験施設
准教授 磯野 協一(イソノ・キョウイチ)
大阪大学 タンパク質研究所
准教授 橋本 浩介(ハシモト・コウスケ)
かずさDNA研究所
オミックス医科学研究室
染色体工学ユニット長 中山 学(ナカヤマ・マナブ)
ゲノム事業推進部
部長 小原 収(オハラ・オサム)
遺伝子構造解析グループ
グループ長 長谷川 嘉則(ハセガワ・ヨシノリ)
オックスフォード大学
教授 ロバート・クローゼ(Robert J. Klose)
研究支援
本研究は、日本医療研究開発機構(AMED)革新的先端研究開発支援事業「エピジェネティクスによるエンハンサー動態制御メカニズムの解明と細胞機能制御への応用(研究開発代表者:古関明彦)」、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究(研究領域提案型)「ポリコム群による抑制ドメインの複製機構の解明(研究代表者:古関明彦)」、同基盤研究(A)「ポリコム群抑制クロマチン形成におけるCpG配列認識の意義の解明(研究代表者:古関明彦)」、同基盤研究(B)「ポリコームタンパクによるリンパ球分化運命制御機構(研究代表者:伊川友活)」による助成を受けて行われました。
原論文情報
- Junichiro Takano, Shinsuke Ito, Yixing Dong, Jafar Sharif, Yaeko Nakajima-Takagi, Taichi Umeyama, Yong-Woon Han, Kyoichi Isono, Takashi Kondo, Yusuke Iizuka, Tomohiro Miyai, Yoko Koseki, Mika Ikegaya, Mizuki Sakihara, Manabu Nakayama, Osamu Ohara, Yoshinori Hasegawa, Kosuke Hashimoto, Erik Arner, Robert J. Klose, Atsushi Iwama, Haruhiko Koseki, and Tomokatsu Ikawa, "PCGF1-PRC1 links chromatin repression with DNA replication during hematopoietic cell lineage commitment", Nature Communications, 10.1038/s41467-022-34856-8
発表者
理化学研究所
生命医科学研究センター 免疫器官形成研究チーム
チームリーダー 古関明彦(コセキ ハルヒコ)
(千葉大学 大学院医学研究院 細胞分子医学 教授)
千葉大学 大学院医学薬学府 細胞分子医学
大学院生(研究当時)高野淳一朗(タカノ ジュンイチロウ)
(理研 生命医科学研究センター 免疫器官形成研究チーム 特別研究員)
東京理科大学 生命医科学研究所 免疫アレルギー部門
教授 伊川友活(イカワ・トモカツ)
 古関 明彦
古関 明彦
 伊川 友活
伊川 友活
 高野 淳一朗
高野 淳一朗
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
国立大学法人千葉大学 広報室
Tel: 043-290-2018
Email: koho-press [at] chiba-u.jp
東京理科大学 広報課
Tel: 03-5228-8107
Email: koho [at] admin.tus.ac.jp
※上記の[at]は@に置き換えてください。
