理化学研究所(理研)生命医科学研究センター 粘膜システム研究チームの大野 博司 チームリーダー、竹内 直志 特別研究員(研究当時)らの共同研究チームは、「トランス脂肪酸[1]」など健康を害する脂質を産生する腸内細菌が肥満や高血糖などの代謝疾患を悪化させることを発見しました。
本研究成果は、特定の腸内細菌がその産生物質(代謝物[2])を介して私たちの代謝機能やその異常に深く関与していることを示しており、今後、腸内細菌やその産生物質をターゲットとした肥満に対する新しい治療の創出に貢献すると期待できます。
腸内細菌は、肥満・糖尿病といった代謝疾患に深く関与していることが知られています。一方、どの腸内細菌が、どのように肥満・糖尿病を悪化させるか、そのメカニズムは明らかになっていませんでした。
今回、共同研究チームはFusimonas intestini[3]という細菌に着目し、同細菌が肥満・糖尿病の患者から多く検出されること、高脂肪食[4]摂食マウスに投与すると肥満が悪化すること、そして、トランス脂肪酸など肥満・高血糖を悪化させる代謝物を多く産生することを発見しました。
本研究は、科学雑誌『Cell Metabolism』オンライン版(1月17日付:日本時間1月18日)に掲載されました。
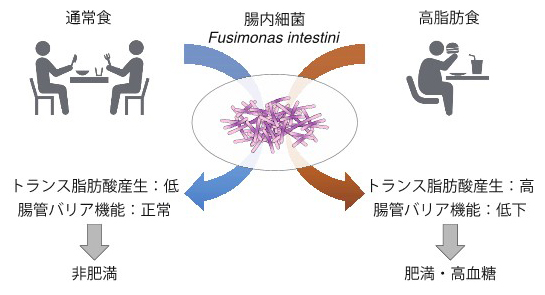
腸内細菌と高脂肪食による脂肪酸の過剰産生を通した肥満・高血糖の悪化
背景
ヒトの腸管には40兆個もの細菌が生息しており、それらは「腸内細菌」と呼ばれています。腸内細菌はヒトが合成できない物質を産生し、病原菌の定着を防ぐことなどにより、ヒトの健康に大きく寄与しています。一方、健全な腸内細菌バランスから逸脱している状態は「ディスバイオーシス(dysbiosis)」と呼ばれ、さまざまな病態に関与することが知られています。腸内細菌のディスバイオーシスが関与する代表的な病態の一つに肥満・高血糖といった代謝疾患が挙げられます。過去の研究から、肥満・高血糖と関連する腸内細菌の種類や、それらが宿主へ及ぼす影響が明らかになってきました。一方、これらの腸内細菌が肥満・高血糖を悪化させるメカニズムはほとんど分かっていませんでした。
腸内細菌は、食事由来成分の一部を代謝することで低分子化合物(代謝物)を産生し、結果として食事がもたらす健康・病態への影響に関与しています。例えば、肉などに含まれるリン脂質のホスファチジルコリンは腸内細菌によりトリメチルアミンに代謝された後、体内に吸収され、動脈硬化を悪化させる物質に変換されることが知られています注1)。共同研究チームは、このように、腸内細菌が食事由来成分に反応して産生する物質に着目することで、肥満などの代謝疾患と腸内細菌を結ぶ新しいメカニズムが見いだせるのではないかと考えました。
- 注1)Zeneng Wang et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature volume 472, pages57-63 (2011)
研究手法と成果
共同研究チームはFusimonas intestini(FI)という細菌に着目し、研究を始めました。FIは、肥満・高血糖マウスから単離された細菌株であり注2)、また、肥満や高血糖との関連性が示唆されているLachnospiraceae科という細菌種に属していることから、肥満・高血糖を悪化させる可能性が考えられました。肥満・糖尿病患者と健常人各34人ずつの糞便検体を調べたところ、肥満・糖尿病患者ではFIの保菌率が健常人よりもほぼ2倍高いことが分かりました(糖尿病患者:健常人=70.6%:38.2%)。さらに、保菌者のFIの菌数と空腹時血糖値や肥満度(BMI)は正の相関を示すことが分かりました。
そこで、無菌マウスにFIを投与し、FIの機能の解明を試みました。FI単独では無菌マウスに定着しなかったため、大腸菌のみを定着させたノトバイオートマウス[5]を作製し、同マウスにさらにFIを定着させることで比較実験を実施しました。その結果、大腸菌単独定着マウスと比較してFI+大腸菌定着マウスでは、高脂肪食の摂食時に体重と脂肪重量が増加し(図1)、血中コレステロールが悪化することが分かりました。また、血糖値も悪化する傾向が明らかになりました。
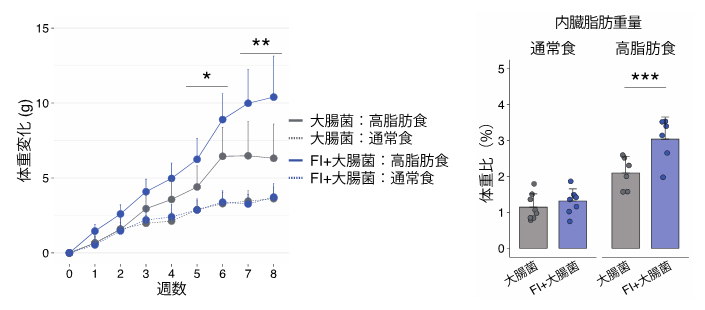
図1 FI定着マウスにおける高脂肪食による肥満の悪化
FIと大腸菌を共定着させたマウスでは、大腸菌単独定着マウスと比較して高脂肪食投与下での体重増加が悪化した(左)。また、内臓脂肪(精巣上体脂肪)重量も増加した(右)。これらの変化は通常食投与下では見られなかった。*P<0.05、**P<0.01、***P<0.001。
通常食では体重などに変化がないことから、FIは食事由来の脂肪に反応して代謝物を産生することで、高脂肪食による肥満の病態を悪化させる可能性が推測されました。そこで、大腸菌単独定着マウスとFI+大腸菌定着マウスの糞便中のメタボローム解析[6]を実施し、水溶性代謝物(アミノ酸、糖など)および脂質代謝物(脂肪酸)を比較しました。その結果、水溶性代謝物は食事内容によらず大腸菌単独定着マウスとFI+大腸菌定着マウスで同じような一定のパターンが観察されました。
一方、脂質代謝物は高脂肪食を与えたときのみ、FI+大腸菌定着マウスで大きくパターンが異なることが明らかになりました。具体的にどのような代謝物が変化しているかを詳しく調べたところ、トランス脂肪酸のエライジン酸[1]、飽和脂肪酸[7]のパルミチン酸[7]など、ヒトの健康を害することが知られている脂肪酸が増加していました(図2)。さらに、FIを脂肪酸含有培地で培養したところ、エライジン酸の増加が確認されました。以上から、FIが高脂質の環境下において健康を害する脂肪酸を産生することが明らかになりました。
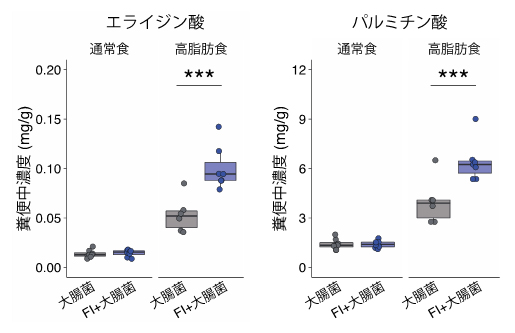
図2 FIによる糞便中の脂肪酸の増加
FI+大腸菌定着マウスでは高脂肪食を与えた場合、トランス脂肪酸の一種であるエライジン酸や、飽和脂肪酸の一種であるパルミチン酸の糞便中濃度が増加した。***P<0.001。
次に、このような腸内細菌による過剰な脂肪酸合成が肥満・高血糖につながるか、別の実験モデルで検証しました。細菌のfadR遺伝子は、脂肪酸合成のマスターレギュレーター遺伝子[8]として知られています。そこで、代表的なモデル細菌である大腸菌にfadR遺伝子を過剰発現[9]させることで、エライジン酸をはじめとする脂肪酸を多量に産生する細菌株を作製しました。この細菌株を無菌マウスに定着させ、高脂肪食を与えたところ、通常の大腸菌と比べて肥満や血糖値が悪化することが分かりました。以上の実験から、細菌由来の脂肪酸合成は直接的に肥満・高血糖を悪化させる原因になり得ることが明らかになりました。
最後に、これらの脂肪酸がどのように肥満・高血糖を悪化させるのか、そのメカニズムを調べました。FI+大腸菌定着マウスの血液中の脂肪酸を調べたところ、驚くべきことに脂肪酸はほとんど増加していませんでした。一方、腸内細菌が肥満・高血糖を悪化させるメカニズムの一つとして、腸管バリア機能[10]の破綻とそれに伴う細菌由来エンドトキシン[11]の体内移行という仮説が以前から知られていました。これらの実験結果と従来の仮説から、脂肪酸が腸管に影響を与えることで、間接的に肥満・高血糖を悪化させる可能性が考えられました。
そこで、腸管バリア機能に重要な細胞接着分子であるタイトジャンクション[12]の遺伝子発現を調べたところ、FI+大腸菌定着マウスでは大腸菌単独定着マウスと比較して低下していることが明らかになりました。また、腸管上皮細胞を培養し、FI+大腸菌定着マウス由来の糞便脂質抽出物やエライジン酸を添加したところ、タイトジャンクションの遺伝子発現が低下しました。さらに、エライジン酸を肥満マウスに投与したところ、腸管バリア機能が低下したばかりでなく、同マウスの肥満や血糖値も悪化しました。以上の結果から、FIが産生するエライジン酸は腸管バリア機能に影響を与え、肥満や高血糖を悪化させることが明らかになりました。
- 注2)Keishi Kameyama et al. Intestinal Colonization by a Lachnospiraceae Bacterium Contributes to the Development of Diabetes in Obese Mice. Microbes Environ. 2014 Dec; 29(4): 427-430.
今後の期待
本研究では、特定の腸内細菌がヒトの健康を害する脂肪酸を産生し、肥満・高血糖を悪化させることを明らかにしました。このことから、FIをはじめとするトランス脂肪酸を産生する細菌をターゲットとした除去療法などが肥満・糖尿病の改善につながる可能性があります。また、腸内細菌のfadR遺伝子が脂肪酸の産生に重要である点も明らかにしており、細菌そのものではなく、細菌の脂肪酸産生遺伝子をターゲットとした治療開発も考えられます。
さらに、食事と腸内細菌の関係性が肥満・高血糖の病態に重要であることを改めて明らかにしています。健全な食事は腸内細菌のディスバイオーシスを防ぐ意味でも重要であると考えられており、悪玉脂質やその産生細菌を抑えるという観点から食事の有効性を検証していくことで、治療のみならず疾患予防に資する可能性も期待できます。
補足説明
- 1.トランス脂肪酸、エライジン酸
トランス脂肪酸は不飽和脂肪酸のうち、トランス型の二重結合を持つ脂肪酸を指す。LDL-コレステロールを増加させ心血管疾患を引き起こすことが明らかになっており、国際的に使用・摂取が厳しく制限されている。エライジン酸は炭素数18のトランス脂肪酸であり、主要な食事由来トランス脂肪酸である。 - 2.代謝物
腸内細菌が産生する、脂肪酸、アミノ酸、糖、ビタミンなどの低分子化合物。多くはヒト体内では合成が不可能であり、食事由来成分から腸内細菌独自の機能で合成される。腸内細菌の種類によって合成される代謝物も異なる。 - 3.Fusimonas intestini
肥満マウスの腸内細菌から単離された細菌種。既報より肥満、高血糖との関連が示唆されるLachnospiraceae科に属する。 - 4.高脂肪食
代表的な肥満の実験モデル。一般的に脂肪由来のカロリー比が約40~60%の飼料を指す。同飼料の継続的な投与が肥満や高血糖を引き起こす。 - 5.ノトバイオートマウス
腸内細菌などの常在細菌が全く存在しない無菌マウスに、特定の細菌を定着させて作出するマウス。一般のマウスと異なり、存在する腸内細菌を厳密に制御できるため、特定の腸内細菌とマウスの表現型との因果関係を調べるのに適している。 - 6.メタボローム解析
低分子化合物を網羅的に探索する実験手法。ガスクロマトグラフィー質量分析計、液体クロマトグラフィー質量分析計、核磁気共鳴法などを用いて、試料中に含まれる物質の化学的・構造的特性を同定する。 - 7.飽和脂肪酸、パルミチン酸
飽和脂肪酸は炭素鎖に二重結合を持たない脂肪酸を指す。代表的な飽和脂肪酸であるパルミチン酸は炭素数16の脂肪酸であり、主に動物性脂肪に含まれる。インスリン抵抗性を悪化させることで、高血糖の要因になり得ることが知られている。 - 8.マスターレギュレーター遺伝子
ある特定の代謝・分化経路において、特に重要な役割を果たす遺伝子。転写因子としてその下流のさまざまな遺伝子発現を制御する。 - 9.過剰発現
ある遺伝子をプラスミドベクターに組み込み、細菌中で多量に発現させること。その遺伝子機能が増強された場合に起こる変化を観察できる。 - 10.腸管バリア機能
腸管には、細菌や食事由来抗原が多量に体内に移行しないためのさまざまな機能が備わっており、バリア機能と総称される。具体的には粘液層、上皮細胞の結合性(タイトジャンクションなど)、そして各種免疫機能が複合的に関与することでその役割を果たしている。 - 11.エンドトキシン
グラム陰性桿菌の細胞壁を構成するリポ多糖。リポポリサッカライドとも呼称される。多量に体内に移行した場合は敗血症など急激な症状を惹起するが、少量が持続的に体内移行する場合には脂肪組織などにおいて慢性炎症を引き起こし、肥満や高血糖の悪化要因になると考えられている。 - 12.タイトジャンクション
上皮細胞同士を密接に結合させる細胞接着分子の総称。具体的にはZO-1、Occludin、JAM-1などが挙げられる。腸管バリア機能の中で重要な役割を果たしており、細菌やエンドトキシンの体内移行を防いでいる。
共同研究チーム
理化学研究所 生命医科学研究センター 粘膜システム研究チーム
チームリーダー 大野 博司(オオノ・ヒロシ)
特別研究員(研究当時)竹内 直志(タケウチ・タダシ)
上級研究員(研究当時)宮内 栄治(ミヤウチ・エイジ)
研究員 中西 裕美子(ナカニシ・ユミコ)
副チームリーダー 金谷 高史(カナヤ・タカシ)
研究員 加藤 完(カトウ・タモツ)
基礎科学特別研究員(研究当時)佐々木 崇晴(ササキ・タカハル)
テクニカルスタッフⅡ 橘 直子(タチバナ・ナオコ)
研修生(研究当時)根岸 紘生(ネギシ・ヒロキ)
研修生(研究当時)松井 美聡(マツイ・ミサト)
味の素株式会社 食品研究所 健康価値開発センター ヘルスケア食品開発グループ
主席研究員 亀山 恵司(カメヤマ・ケイシ)
主任研究員 藤井 孝吉(フジイ・タカヨシ)
研究支援
本研究は、理化学研究所共生生物学プロジェクトおよび日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)の研究開発領域『疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出(研究開発総括:清水孝雄)』における研究開発課題「オミクス解析に基づくアレルギー発症機構の理解と制御基盤の構築(研究開発代表者:大野博司)」による助成を受けて行われました。
原論文情報
- Tadashi Takeuchi, Keishi Kameyama, Eiji Miyauchi, Yumiko Nakanishi, Takashi Kanaya, Takayoshi Fujii, Tamotsu Kato, Takaharu Sasaki, Naoko Tachibana, Hiroki Negishi, Misato Matsui, Hiroshi Ohno, "Fatty Acid Overproduction by Gut Commensal Microbiota Exacerbates Obesity", Cell Metabolism, 10.1016/j.cmet.2022.12.013
発表者
理化学研究所
生命医科学研究センター 粘膜システム研究チーム
チームリーダー 大野 博司(オオノ・ヒロシ)
特別研究員(研究当時)竹内 直志(タケウチ・タダシ)
 大野 博司
大野 博司
 竹内 直志
竹内 直志
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
