理化学研究所(理研)開拓研究本部 伊藤ナノ医工学研究室の森島 信裕 客員研究員、伊藤 嘉浩 主任研究員らの共同研究グループは、細胞内に生じる小さなダメージ[1]や弱いストレス[1]を感度よく検出し、それらが細胞の増殖や老化[2]に与える影響を調べる手法を開発しました。
本研究成果は、弱い放射線照射や低用量薬剤投与、細胞周囲の環境変化が細胞に与える影響を評価する道を開くと期待できます。
今回、共同研究グループは「プロテインアレイ法[3]」というタンパク質解析法を用いて、放射線照射により細胞内に生じるダメージやストレスの指標となるタンパク質の精密定量を行いました。まず、細胞抽出液試料を少量ずつ基板上に並べた試料群(アレイ)を半自動で作製する装置を開発しました。また、多重測定[4]や同一試料の繰り返し測定[4]で得られたタンパク質定量データを「メタ解析[5]」という統計学的手法により解析する手法を確立し、ダメージやストレスの指標となるタンパク質の量的変動(増減率10%以上)を高い確実性を持って検出できることを示しました。
本研究は、日本分子生物学会が出版する科学雑誌『Genes to Cells』(4月号)の掲載に先立ち、オンライン版(2月14日付)に掲載されました。
背景
生体には、体内の環境を一定に保つ仕組み(ホメオスタシス)があり、それによって体内や細胞内にある物質の構成や量、生体分子の働きなどが大きく変化することなく健康状態が保たれています。しかし、強い物理的・化学的刺激によって、細胞はダメージを受けストレスを生じます。これまで、さまざまな刺激が細胞に与えるダメージやその影響が詳しく調べられてきました。しかし、細胞内の変化は刺激の強さが弱くなるほど小さくなるため、「弱い刺激」が細胞に与える影響の解析は困難でした。
放射線による傷害[6]についても同様の課題があります。強い放射線は細胞や個体の生死に関わるほどの影響を及ぼしたり、がんなど重篤な疾病の原因になったりすることが知られていますが、「弱い放射線」が細胞にどのような傷害を与え、細胞の健康状態をどの程度変えるかは分かっていません。
放射線が細胞に与える影響は、細胞のダメージ応答やストレス応答[7]の大小を示す指標タンパク質の量によって推定できます。例えば、放射線によってDNAが傷ついたかどうかは、DNA傷害を修復するタンパク質の量的変化によって判定できます。また、DNA傷害が細胞の増殖や老化、細胞死、がん化などの現象を引き起こすかどうかも、これらの現象を制御するタンパク質の量から推定できます。
そこで本研究では比較的弱い放射線照射による細胞内のダメージ応答やストレス応答の指標タンパク質を精密定量し、細胞内の小さな変化を捉えることを試みました。
研究手法と成果
共同研究グループは、多数の試料を同時に扱えるプロテインアレイ法というタンパク質解析法の長所を利用し、一つの試料を繰り返し測定することで、放射線を照射した細胞内のタンパク質を精密定量することを目指しました。
プロテインアレイ法を適用するには、自動アレイ作製装置(アレイヤー)を使って細胞抽出液試料を少量ずつ基板上に並べた試料群(アレイ)を作製できると効率的ですが、研究用として入手できるアレイヤーの種類は限られており、かつ一つのアレイ上のスポット数は数百から千程度です。そこで株式会社柴崎製作所の協力の下、手のひらサイズの基板上にアレイを作るアレイヤーを新たに開発しました。
開発したアレイヤーは、384ウェルの試料プレートの半分に相当するサイズのスタンプヘッド(192ピン)を持ち、その動きを3次元自動制御できます(図1)。試料プレートに入れた細胞抽出液をスタンプヘッドのピン先につけて、基板となる7×8.5cmのニトロセルロース膜の上に塗布します。細胞抽出液が塗布されるスポット位置を少しずつずらしながら繰り返すなどの動作で、最大で約7,000スポットのアレイを作ることが可能です。

図1 本研究で開発したアレイヤーの外観
左側のスポット作製用のスタンプヘッドと右側の384ウェル試料プレートがそれぞれ装置の中央付近に移動し、ピンの先をウェル内の試料液に浸すことで50ナノリットル(nL、1nLは100万分の1mL)程度の細胞抽出液をピン先に付ける。試料プレートが右側に退いた後、スタンプヘッドがニトロセルロース膜上に移動し、試料液をスポットする。装置は同じ動作を繰り返し、スポット位置を少しずつ(縦横最大2mmまで設定可能)ずらしながら、試料液のアレイを作製する。
このアレイヤーを用いて、低い線量率[8]の放射線が細胞に与える影響を調べました。京都大学放射線生物研究センターの低線量[8]・低線量率照射装置を使って、ヒト由来線維芽細胞にγ線(ガンマ線)[9]を50時間照射し、ストレス応答の指標になる細胞内タンパク質の量を照射した細胞と照射しなかった細胞とで比較しました。照射したγ線の線量率は1分間当たり1mGy(ミリグレイ)で、長時間の照射により細胞に微小な影響が出るとされる中線量率域(1分間当たり0.1~99mGy)の下限近くに相当します。
この実験では、図2に示すように、タンパク質定量を精密化するため、1回の照射実験に4枚の培養シャーレを用いて同質の細胞試料を4個ずつ調製し(多重測定)、それぞれの細胞試料を基板上に8回スポット(繰り返し測定)しました。これにより、一つの実験条件につき32個のスポットを作製できます。また、日を変えて同じ照射実験をさらに2回繰り返し(計3回)、1実験条件当たり計96個のスポットから成るアレイを作製しました。同様にして、調べるタンパク質の種類の数だけプロテインアレイを作製しました。
こうして得られたプロテインアレイに特異抗体[10]を加え、スポット内に存在する特定のタンパク質と結合させます(図2)。結合した抗体を抗体検出用蛍光試薬により発光させ、蛍光の強弱から抗体結合量、すなわち解析対象タンパク質の量を測定しました。全ての細胞試料を同一の基板上に並べることで、均一な条件下でタンパク質を定量できました。
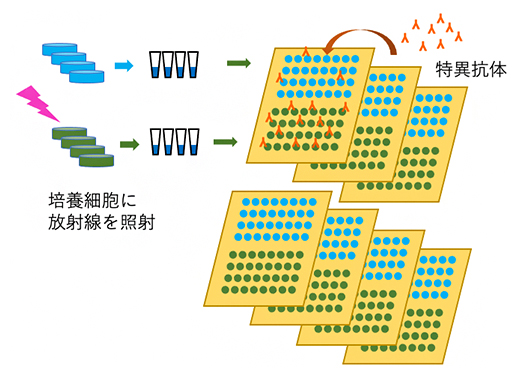
図2 プロテインアレイ法による多数回のタンパク質定量
1回の照射実験に4枚の培養シャーレを用いて同質の細胞試料を4個ずつ調製し、それぞれの細胞試料を基板上に8回スポットする(実際には計3回の実験で作られた試料を用いて一つの実験条件あたり96スポットから成るアレイを作製している)。得られたプロテインアレイに特異抗体を加え、スポット内に存在する特定のタンパク質に結合させる。
本研究では、解析対象として46種類のタンパク質を選びました。その内訳は、放射線によって作られる活性酸素種[11]に応答するタンパク質、放射線によって傷ついたDNAの修復に関わるタンパク質、細胞内のダメージを感知して対応するストレス応答タンパク質、ダメージやストレスに影響される細胞増殖制御タンパク質などです。
図3に、活性酸素種が生成されると増える一酸化窒素合成酵素のiNOSタンパク質とDNA傷害の修復に関わるリン酸化ATM1タンパク質の定量結果を示します。1回の実験で得られる32個のデータから箱ひげ図[12]を作成しました。3回の実験で、それぞれγ線照射によって再現的にそれぞれのタンパク質が増加することが分かります。興味深いことに、非照射時のタンパク質の量が実験ごとに少しずつ異なっていました。これは、性質がそろっているはずの培養細胞でも、細胞内のタンパク質の量が微妙に変動している可能性を示しています。一方、照射後のタンパク質の増減率(この場合は増加率)は各回で似通っていることが分かりました。
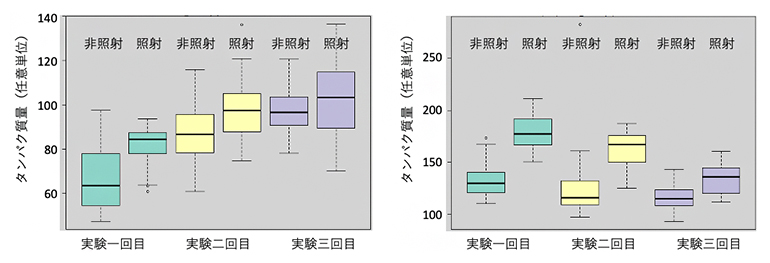
図3 繰り返し実験による細胞内タンパク質量の変化の箱ひげ図
- (左)どの実験でも、iNOSタンパク質の量は放射線照射によって増加した。一方、非照射試料中のiNOSタンパク質の量は3回目、2回目、1回目の順に多かった。
- (右)どの実験でも、リン酸化ATM1タンパク質の量は放射線照射によって増加した。iNOSタンパク質とは逆に、非照射試料中のリン酸化ATM1タンパク質量は1回目が一番多かった。
次に、3回分の測定値を単純に平均するのではなく、メタ解析の手法を用いて3回の実験で得られたタンパク質の増減率を一つの値に統合しました。その結果、46種類のタンパク質のうち20種類の増減率は10%以内、18種類が10~30%、残り8種類の中で最大の増加率は約130%、最大の減少率が約50%でした。10%以上の増減を示すタンパク質は、活性酸素種の発生に応答するストレスシグナルタンパク質(図4)と、放射線によるDNA傷害の修復、細胞増殖の抑制、細胞老化の前兆現象に関わるタンパク質でした。これらの結果は、放射線による直接的または活性酸素種の生成を介した間接的な作用でDNAがダメージを受け、その結果として細胞増殖が鈍化したり、老化が始まったりすることを示しています。
また、ストレス応答の面から、今回と同じ照射条件下で活性酸素種やDNA傷害が微増するという従来のデータを裏づけるとともに、ストレスが細胞の健康状態に与える影響が示されたともいえます。タンパク質量の解析に汎用されているウエスタンブロット法[13]やドットブロット法[13]を用いて、10%程度の増減率が観察されたとしても信頼性が高いとはあまり見なされませんが、今回開発した手法を用いると、小さな変化がしっかり捉えられる可能性が示されました。
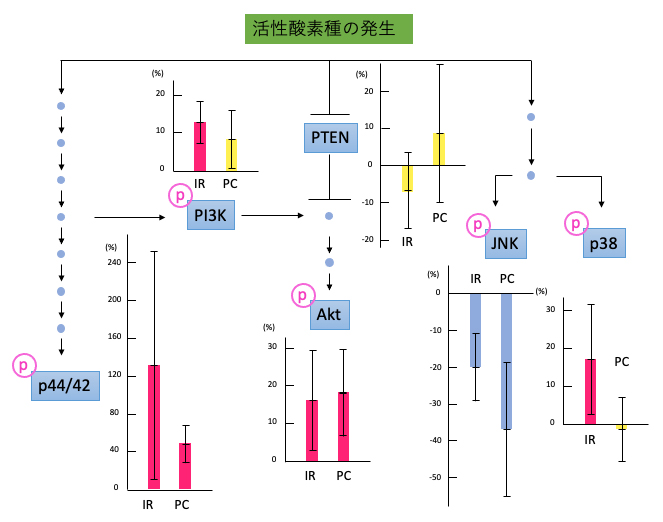
図4 活性酸素種の発生によって起動する細胞内ストレス応答系
青い四角や丸はタンパク質の種類を表す。活性酸素種が発生すると、それを感知するタンパク質から下方のタンパク質へ、リン酸化(ピンク色のpで表示)を介したシグナル伝達が起きる。図中の棒グラフは、放射線照射下(IR)と活性酸素発生下(PC:対照実験)でのタンパク質の増減率(メタ解析を適用後)を示す。棒グラフの赤は10%以上の増加、青は10%以上の減少、黄は10%未満の増減を示す。
今後の期待
本研究ではプロテインアレイ法を利用して、中線量率放射線が細胞に傷害を与えていることと、細胞増殖が抑制され、細胞老化の前兆が現れていることを示唆する結果を得ました。今後はさらに低い線量率の放射線照射について解析を行い、これまでほとんど解明されてこなかった低線量率域放射線(1分間当たり0.1mGy未満)による長時間照射の影響を調べる予定です。
本研究で開発した手法は、放射線による傷害のほかに、低用量薬剤や刺激物によって生じる可能性がある慢性的なストレス状態や傷害を検出したり、それらが細胞の生理状態、健康状態に与える影響の解析に適用できると期待できます。
補足説明
- 1.ダメージ、ストレス
細胞が外界からの物理的刺激(高低温、放射線、紫外線など)、化学的刺激(毒物、劇物、酸・アルカリ、ガスなど)を受けると、細胞を構成する分子(タンパク質、核酸、脂質など)に傷がつき、細胞にとってダメージとなる。このダメージによって、細胞はストレス状態になる。また、細胞内で生じる不具合(タンパク質の凝集、染色体のねじれ、活性酸素種の発生など)によっても、細胞はストレス状態となる。 - 2.増殖や老化
未分化細胞は分裂によって数を増やし、分化細胞のもとになる前駆細胞を供給する。細胞内の不具合によって未分化細胞や前駆細胞が増殖しなくなった状態を細胞の老化と呼び、老化が起こる仕組みの研究や防止法の開発が盛んに行われている。 - 3.プロテインアレイ法
純化された精製タンパク質や細胞から取り出したタンパク質混合物を、基板上に点状(スポット)に並べて固定化したものをプロテインアレイと呼ぶ。本研究では、プロテインアレイ上のタンパク質混合物試料を抗体と反応させ、特定のタンパク質を定量した。逆に、特定のタンパク質を固定化したアレイに抗体を含む生体試料を反応させて、試料中の抗体をタンパク質に結合させると抗体の検査ができる(抗原アレイ法)注1)。また、抗体を固定化して作ったアレイに生体試料を反応させ、試料中の特異的なタンパク質を抗体に捕捉させた抗原検査(抗体アレイ法)にもプロテインアレイが用いられる。- 注1)2021年9月3日プレスリリース「新型コロナウイルス抗体を「その場」で測定」
- 注2)2022年8月2日プレスリリース「新型コロナウイルス変異株の抗体量を8分で自動定量」
- 4.多重測定、繰り返し測定
多重測定は同等の試料を独立に複数準備して測定すること。多連測定とも呼ぶ。図2では、細胞培養シャーレを同時に4枚使って四つの独立した試料を作ったことを示している。繰り返し測定は一つの試料を何回か測定することを指す。図2では、一つの試料を8回繰り返し測定していることを示す。このような測定は、生物試料を対象とした測定の精度を上げる有効な手段である。 - 5.メタ解析
同一の研究テーマに関して行われた複数の研究結果を収集し、統計学的手法を用いてデータの統合・比較を行うこと、またはその手法を指す。データの数や数値のばらつきの大小や優劣を考慮し、より真実の値に近いと考えられる統合データを得ることを目的とする。例えば、各実験で得られた平均値それぞれに重み付けをして一つの値に統合する。本研究では、タンパク質量の変動率の再現性と実験回ごとの測定値のばらつき程度の違いから、メタ解析を適用するアイデアを得た。 - 6.放射線による傷害
細胞が強い放射線を浴びると、さまざまな生体分子に傷が付く。特にDNA(遺伝情報を保持する核酸分子)が激しく傷害されると、正常な遺伝子発現による細胞機能の維持が不可能になる。比較的弱い放射線を浴びた場合でも、DNAが傷付くことで遺伝情報が書き換えられ、細胞ががん化する場合がある。さらに放射線は、水分子から活性酸素種を作り出し、生体分子への二次的な傷害も与える。 - 7.細胞のダメージ応答やストレス応答
細胞には、細胞内で発生するダメージを修復したり、ストレスを解消したりするための仕組みが備わっている。ダメージやストレスの種類に応じて特異的なタンパク質が増加したり、活性化したりする。それぞれのダメージの応答系、ストレス応答系は多種類のタンパク質で構成されている。 - 8.線量率、線量
放射線によって被ばくする物質への影響と関連づけて放射線の量を表したものを線量と呼ぶ。単位はGy(グレイ)で、放射線が当たる物質が単位重量当たりどれくらいのエネルギーを吸収するかを表す。1Gyは物質1kg当たり1ジュール(J)のエネルギーを与える量。線量率は単位時間(1分間、1時間、1日など)当たりの線量。線量率に被ばく時間を掛けると線量の値となる。Gy単位の数値に対し、被ばくが人体に及ぼす影響を考慮して係数を掛けた値はSv(シーベルト)単位で表される。 - 9.γ線(ガンマ線)
放射線の一種で、エネルギーが過剰で不安定な原子核から放出される電磁波がその実体である。本研究では、放射性セシウムの原子核が崩壊してできるバリウム-137(137Ba)から放出されるγ線を利用した。 - 10.特異抗体
哺乳類の体内には、異物認識や感染防御に働く抗体群が常時多種類存在する。1種類の抗原を認識する抗体分子だけを取り出したり、または組換えDNA技術を用いてそのような抗体を作ったりすることで、特定の抗原に特異的な抗体が得られる。このような抗体を特異抗体と呼ぶ。実験室で研究用に用いられるほか、近年では抗原検査や抗体医薬の材料として利用される。 - 11.活性酸素種
酸素分子(O2)が酸化還元反応または電子の励起によって変化し、生成する酸素原子(O)を含む分子群。反応性が高い。非ラジカル性とフリーラジカル性の活性酸素種がある。放射線が水分子(H2O)に当たると、水素原子(H)や活性酸素の一つであるヒドロキシラジカル(・OH、小さな丸点は電子を表す)が生じる。これらがO2と反応すると、別の活性酸素であるスーパーオキシドアニオンラジカル(・O2-)が生成するほか、ヒドロキシラジカル同士の反応によって非ラジカル性の活性酸素、過酸化水素(H2O2)が作られる。生体内ではスーパーオキシドジスムターゼを代表とする酵素群が活性酸素種を別の分子に変える反応を触媒し、無毒化している。活性酸素種はミトコンドリアにある電子伝達系の働きによっても一種の副産物として作られる。 - 12.箱ひげ図
データの値がどれくらいばらついているか、代表的な値がどれくらいの大きさかを示す図で、複数のデータセット間でのばらつきや代表値を容易に比較できる。箱から飛び出た線(ひげ)の端は最大値と最小値に相当し、箱は大きさ順に並べた総データのうち4分の1から4分の3番目の値の範囲、箱中の横線は中央値を示す。 - 13.ウエスタンブロット法、ドットブロット法
どちらの方法も、タンパク質試料(精製したタンパク質や細胞を破砕して抽出したタンパク質の混合物など)を膜に固定化してブロットと呼ばれるものを作製し、試料に含まれる特定のタンパク質の量を測定する。タンパク質の検出、定量には特異抗体が用いられる。ウエスタンブロットは、あらかじめタンパク質をゲル内で電気泳動し、分離した後で作られる。ドットブロットは、タンパク質試料を直接膜に点状(ドット状)に塗布して作られる。
共同研究グループ
理化学研究所 開拓研究本部 伊藤ナノ医工学研究室
客員研究員 森島 信裕(モリシマ・ノブヒロ)
主任研究員 伊藤 嘉浩(イトウ・ヨシヒロ)
女子栄養大学 栄養学部
教授 緒方 裕光(オガタ・ヒロミツ)
馬替生物科学研究所
所長 馬替 純二(マガエ・ジュンジ)
国際医療福祉大学 成田保健医療学部
教授 小林 純也(コバヤシ・ジュンヤ)
研究支援
本研究は、科学技術振興機構(JST)・先端計測分析技術・機器開発プログラム・放射線計測領域の開発課題「微量放射線の生物影響評価システム(装置)の開発(チームリーダー:藤野亮、サブリーダー:森島信裕)」、国立研究開発法人核融合科学研究所(NIFS)・LHD計画共同研究「生命科学手法を活用した有機結合型トリチウムの生体影響解析(研究代表者:鈴木正敏)」の研究課題「タンパク質アレイ法を用いた低線量・低線量率放射線生物影響の精密解析(研究代表者:森島信裕)」、放射線災害・医科学研究拠点共同研究(拠点本部長:田代聡)の研究課題「低線量・低線量率放射線が細胞に与える影響を定量評価するための新たな指標づくり(研究代表者:森島信裕)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「細胞の慢性的ストレス応答を指標とした低線量率放射線生物影響の精密定量解析(研究代表者:森島信裕)」による助成を受けて行われました。
原論文情報
- Nobuhiro Morishima, Hiromitsu Ogata, Junji Magae, Yoshihiro Ito, and Junya Kobayashi, "Analysis method of cellular stress caused by intermediate dose-rate irradiation using a cell lysate array technique", Genes to Cells, 10.1111/gtc.13011
発表者
理化学研究所
開拓研究本部 伊藤ナノ医工学研究室
客員研究員 森島 信裕(モリシマ・ノブヒロ)
主任研究員 伊藤 嘉浩(イトウ・ヨシヒロ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
