理化学研究所(理研)生命機能科学研究センター 体軸動態研究チーム(研究当時)の加藤 壮一郎 研修生(研究当時、現 大阪大学大学院 理学研究科 招へい研究員)と猪股 秀彦 チームリーダー(研究当時)の研究チームは、アフリカツメガエル[1]胚がアクトミオシン[2]の収縮を利用して原口[3]の開閉を制御し、原腸[3]内の体液を適切なタイミングで排出することを発見しました。
本研究成果は、動物の初期発生期において、筋肉の未成熟な胚が体の形成に重要な体液動態を制御する新たな仕組みを提示するものです。
アフリカツメガエル胚は、将来消化管となる原腸の形成後(原腸胚期[4])に、原腸と胚外をつなぐスリット型のお尻の穴「原口」を閉じることで、原腸内に体液を蓄えたまま発生し、後期神経胚期[4]に原口を開くことで体液を胚外に排出します。原腸内の体液は体の左右軸決定に重要な役割を担っており、体液の維持は正常な発生に不可欠だと考えられています。この原口の開閉は半世紀以上前に報告されていますが、筋肉の未熟な胚が、あたかも尿道や肛門を括約筋で制御するように原口の開閉を時間制御する仕組みは不明でした。
今回、研究チームは原腸内の液圧と原口の耐圧上限値(閉鎖状態を保てる限界の圧力)を計測し、液圧の上昇ではなく、耐圧上限値の低下が開口を引き起こすことを突き止めました。さらに、原口の耐圧上限値はスリット両側の組織からかかる押し合う力によって制御されていることや、この力は原口スリット背腹両端の細胞に存在するアクトミオシンの収縮によって生み出され、排出時には腹側端の収縮が解消することで開口することを明らかにしました。
本研究は、オンライン科学雑誌『iScience』(4月24日付)に掲載されました。
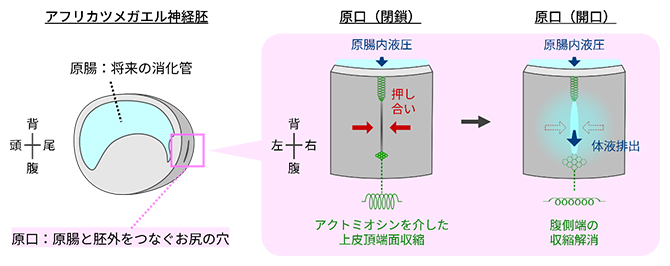
アフリカツメガエル胚の原口の開閉を制御するアクトミオシンを介した収縮機構
背景
体内の水(体液)は、細胞の中の水と外の水(細胞外体液)に大きく分けられます。多細胞生物にとって、細胞外体液は体を構成する重要な要素であり、体液動態の制御は体内環境の維持などに不可欠です。また、体のさまざまな構造が作られる動物の初期発生期においては、体内に生じた空間を埋める体液の存在が正常な発生に必須であると考えられています。
体液の移動には、細胞膜の孔や、細胞と細胞の間の隙間を利用したミクロな経路と、複数の細胞から構成される管や孔など組織レベルのマクロな経路が使われています。このうち組織レベルの体液移動には、尿道や肛門の括約筋のように筋収縮に伴う経路の開閉が重要な役割を果たしています。従って、筋肉組織が発達していない初期胚では、主に細胞レベルのミクロな経路を活用して体液が移動していると考えられてきました。
一方、初期発生研究のモデル動物であるアフリカツメガエル胚は、将来消化管となる原腸の形成後(原腸胚期)に、原腸と胚外をつなぐスリット型のお尻の穴「原口」を閉じることで、原腸内に体液を蓄えたまま発生し、後期神経胚期に開くことで体液を胚外へと排出することが半世紀以上前に報告されています注1)(図1)。原口は組織レベルのマクロな孔ですが、興味深いことにこの時期の胚は機能的な筋肉を持っておらず、どのように開閉を制御しているか明らかにされていませんでした。そこで本研究では、原口にかかる圧力などの物理量の計測とイメージング技術を組み合わせてこの問いに挑みました。
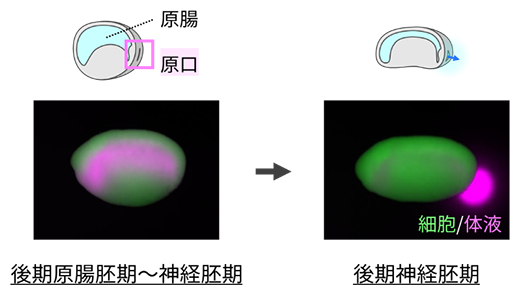
図1 アフリカツメガエル胚の原腸内体液排出現象
将来の消化管に対応する原腸は細胞外体液(原腸内体液)で満たされているが、発生の進行とともに原口が開くと、体外に体液が排出される。観察しやすいように、胚の細胞を緑色蛍光で標識し、体液にマゼンタの蛍光色素を注入している。
- 注1)TUFT PH. The uptake and distribution of water in the embryo of Xenopus laevis (Daudin). J Exp Biol. 1962;39:1-19. doi:10.1242/jeb.39.1.1
研究手法と成果
研究チームはまず、細胞外体液(原腸内体液)を蛍光色素で標識した胚の経時観察を行い、原口からの体液排出時期がステージ20(受精後約21時間)以降に制御されていることを明らかにしました。そこで、この排出時期にどのような生物学的意義があるのか明らかにするために、原腸にガラス針で穴を開け、原腸内液を早期に除去する実験を行いました(図2a、b)。
先行研究により、アフリカツメガエル胚では原腸の背側内壁面に回転する繊毛が形成され、回転に伴う原腸内液の左向きの流れが胚の左右軸の決定(心臓や腸の左右非対称性の確立)に重要であることが明らかになっています注2)。早期に原腸内体液を除去した胚をオタマジャクシまで育てたところ、排出直前(ステージ20)に原腸内液を除去した胚は左右性に異常が見られなかったのに対し、早い時期(ステージ14、受精後約16時間)に除去した場合、一部の胚で心臓と腸の形が左右反転することが分かりました(図2c、d)。この結果は、体液排出時期の制御が正常発生に重要であることを示しています。
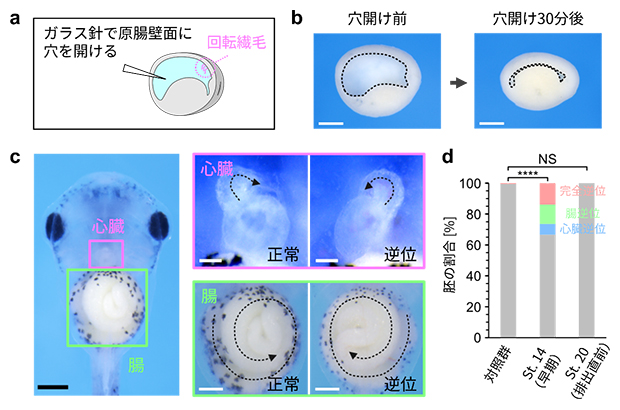
図2 原腸内体液の早期除去に伴う左右軸形成異常
- a)体液早期除去実験の模式図。左が将来の頭側となる。原腸の背側内壁面に存在する回転繊毛は、体の左右軸の決定に関わる。
- b)操作した胚の正中切断面。原腸壁面に穴を開けると原腸内体液が排出され、胚がしぼむ。スケールバーは500μm。
- c)原腸内体液除去の影響を、オタマジャクシの段階で検証した。腹側から観察すると、心臓と腸の左右非対称性が正常か逆位かが判別できる。黒のスケールバーは500μm。心臓のスケールバーは100μm。腸のスケールバーは300μm。
次に、原口の開閉がどのように制御されているかを調べました。前述の体液除去実験では、原腸に穴を開けると、原腸内体液が原腸から出ていくのみで胚外からの流入は観察されなかったことから、原腸内は外界と比べて圧力が高いことが示唆されました。そこで圧力と原口開閉の関係を明らかにするために、微小電極式の圧力計を用いて原腸内の液圧を測定しました。もし原腸内圧が発生とともに上昇していれば、原口の耐圧上限値(閉鎖状態を保てる限界の圧力)を超えたところで、原口が開くと考えられます。しかし、実際に圧力計のプローブを原腸内に挿し込み内圧を測定した結果、興味深いことに原腸内圧は排出前から排出時にかけてほとんど一定でした。
そこで第二の仮説として、原口の耐圧上限値が発生とともに低下することで、原口が開く可能性を考えました。この可能性を検証するため、原腸内圧を測定しながら同時にもう1本ガラス針を原腸に挿し込み、色素溶液を持続的に注入し加圧することで、原口が開いて色素が排出された瞬間の圧力(=耐圧上限値)を測定しました(図3a、b)。その結果、耐圧上限値は発生の進行に伴い低下し、排出時には原腸内圧と一致することが分かりました(図3c)。
この結果から、胚は原腸内圧ではなく原口の耐圧上限値をコントロールすることで体液排出時期を制御することが分かりました。
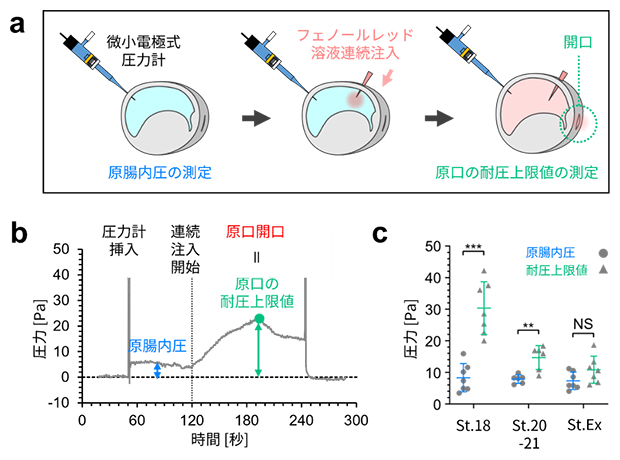
図3 原腸内圧と原口の耐圧上限値の測定
- a)実験の模式図。微小電極式の圧力計を原腸に挿し込むことで、原腸内圧を測る。さらに、もう1本のガラス針で色素(フェノールレッド)溶液を持続的に注入することで、原腸内圧を人為的に上昇させ、原口が開いた瞬間の圧力を測定することで、原口の耐圧上限値を測定する。
- b)実験結果の例。フェノールレッド溶液を持続的に注入すると原腸内圧が上昇し続けるが、原口が開口した瞬間に内圧が下がる。このときのグラフのピークが耐圧上限値となる。
- c)ステージ18(St. 18)とステージ20~21(St. 20-21)、体液排出期(St. Ex)の胚の実験結果をまとめたグラフ。原腸内圧は統計的に一定と見なせるが、耐圧上限値は体液排出直前(St. 20-21)に低下していた。
それでは、原口の耐圧上限値はどのように調節されているのでしょうか。もし原口スリットの内壁面の細胞同士が何らかの分子を介して接着し、原腸内圧に耐えて閉鎖しているのであれば、接着の解除により体液が排出されるはずです。しかし、原口にアルミホイル片を挿し込み、両側の組織を物理的に分断しても、原口は閉鎖状態を保ち、後期神経胚期には正常胚と同様に原腸内体液を排出しました(図4a)。さらに先端を丸めたガラス針を原口に押し込んで、早期に無理やり開いても、原口はすぐに閉鎖状態に戻りました(図4b)。
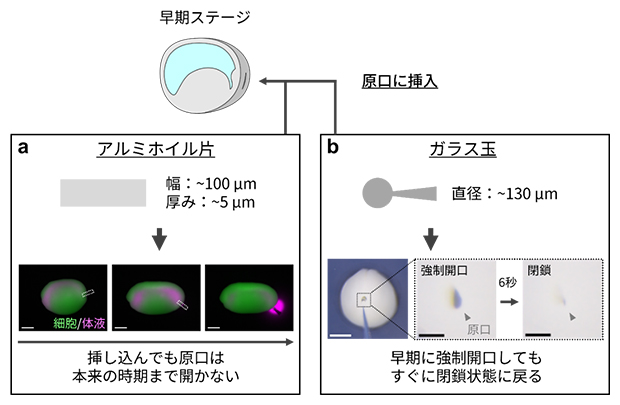
図4 原口の物理的分断と強制開口実験
- a)早期ステージ胚の原口にアルミホイル片を挿入し、原口のスリットを強制的に分断しても原口は開口せず、正常胚と同じ時期に体液は排出された。スケールバーは500μm。
- b)早期ステージ胚の原口にガラス玉を挿入し、強制的に開口すると、その後短時間(6秒程度)で元の閉鎖状態に戻った。白のスケールバーは500μm。黒のスケールバーは100μm。
いずれの結果からも、スリット両側の細胞の接着により原口が閉鎖している可能性は否定された。
そこで、原口スリットに両側から押し合う力がかかって密着した結果、機械的に閉鎖されている可能性を考えました。この仮説を検証するために、原口の周囲の組織を切り出し、原口腹側端を切断し密着を解消したところ、原口のスリット接面は平面または凹凸の組み合わせ状態から、両側が丸みを帯びた凸形状へと変化しました(図5a、c)。この結果は、もともと丸みを帯びた両側組織が、押し合わされることによって形状が変化していたことを示唆しています。一方、正常な状態のスリット両側の組織の厚みを詳しく調べると、ステージ18(受精後約20時間)からステージ20~21(受精後約22時間)にかけて薄くなっていることが分かりました(図5b)。これは、原口スリット間の押し合う力が発生に伴い低下する可能性を示しています。
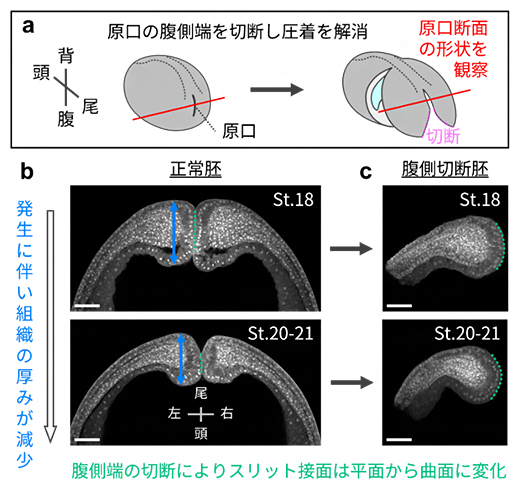
図5 原口スリットの形状と両側から押し合う力の関係
- a)原口腹側端切断によるスリット密着解消実験の模式図。正常胚(左)と腹側端切断胚(右:マゼンタ点線を切断)についてスリット断面(赤線)の形状を観察した。
- b,c)体液排出前(St.18)と排出直前(St.20-21)の正常胚(b)と腹側切断胚(c)のスリット断面形状。切断に伴い平面的な接面は丸みを帯びた曲面へと変化した(b, c:緑点線)。正常胚の原口を形成する組織は、St.18で厚くSt.20-21で薄い(b)。これらの観察結果は、原口に両側から押し合う力がかかっていること、および押し合う力が発生に伴い低下することを示唆する。スケールバーは100μm。
これらの可能性を検証するために、タングステンの細い針金を使って、原口を開くのに必要な力を排出前(ステージ18)と排出直前(ステージ20~21)で調べました。タングステンの針金は、先端にかかる力に比例してたわみが大きくなります。この性質を利用して、原口の両側に細い針金を浅く刺し、一方を動かして原口を開いたときにもう一方がどの程度たわむか調べることで、力を計測しました(図6a)。すると、原口を開くために必要な力は体液排出直前に低下することが分かりました(図6b)。これらの結果から、原口の耐圧上限値はスリット間の押し合う力によって制御されていることが示唆されました。
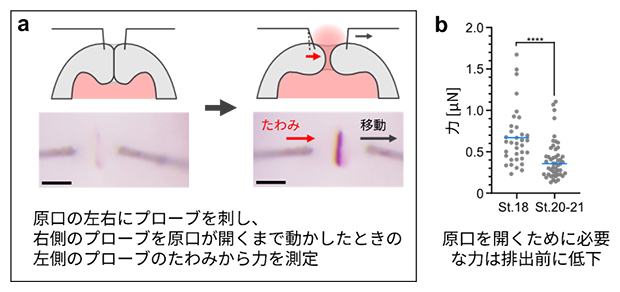
図6 発生に伴って変化する、原口を両側から押し合う力
- a)タングステンの針金を力測定のプローブとして用いた実験の模式図。スリットの片側を動かして原口を開くと、もう一方にかかっている力が全てプローブに伝わり、そのたわみ方から力を測定する。
- b)実験の結果のグラフ。原口を開くために必要な力(=原口の耐圧上限)は、体液排出期で低下した。スケールバーは100μm。
それでは原口を両側から押し合う力は、どのように生み出されているのでしょうか。研究チームは、形態形成の駆動力としても知られるアクトミオシンの収縮に着目しました。細胞内のアクチン繊維[2]とミオシン繊維[2]からなるアクトミオシンは、ATP[5]依存的に収縮力を生み出します。上皮細胞[6]内の頂端面(体の外側に向いている面)でのアクトミオシンの収縮が、隣り合う細胞同士で協調すると、細胞レベルの変形が組織レベルのマクロな変形も引き起こすことができます。
アクトミオシンの収縮が原口の近くで生じているか調べるために、収縮の指標となるリン酸化ミオシン[2]の局在を免疫染色法[7]で調べました。すると体液排出前のステージでは、リン酸化ミオシンのシグナルは原口スリット背腹両側の上皮頂端面に局在している様子が観察されました。一方、特に腹側のシグナルは排出直前に減弱し、排出時には消失していました(図7a)。さらに、細胞の形状の解析から、排出時にかけて実際に上皮頂端面の収縮が解消されることが明らかになりました(図7b)。
このスリット腹側端の上皮頂端面の収縮が押し合う力を制御しているのではないかと考え、仮説を検証するためにアクトミオシンの収縮を阻害する薬剤を早期ステージの原口スリット腹側端近くの組織内に微量注入しました。すると、原口は短時間で開口し体液が排出されました(図7c)。
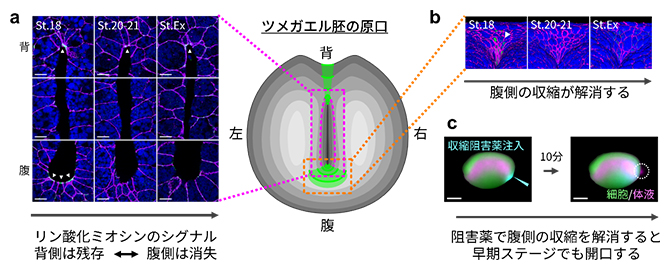
図7 原口スリットの開口の鍵となる腹側のアクトミオシンの収縮解消
- a,b)原口側から見た胚の模式図(上が背側、下が腹側)と、原口スリット近くの細胞の変形の様子。収縮の指標となるリン酸化ミオシンのシグナルは、原口スリット背腹両側の上皮頂端面に局在し、発生が進むと腹側のシグナルが消失する(aおよびbの蛍光像の矢尻が指す緑色蛍光。細胞全体を青、細胞接着分子をマゼンタで示す。スケールバーは10μm)。
- c)阻害薬(Y27632)の注入により腹側でのアクトミオシンの収縮を発生早期に阻害すると、スリットが早期に開口し体液排出が観察された(右下、スケールバーは500μm)。
一連の結果から、原口背腹両端のアクトミオシン依存的な上皮頂端面収縮が原口スリットに押し合う力を与えた結果、原腸内圧にあらがいスリットの閉鎖を維持できること、排出期には腹側端の収縮が解消することで押し合う力が減弱し、耐圧性が低下することでスリットが開口することが明らかになりました(図8)。
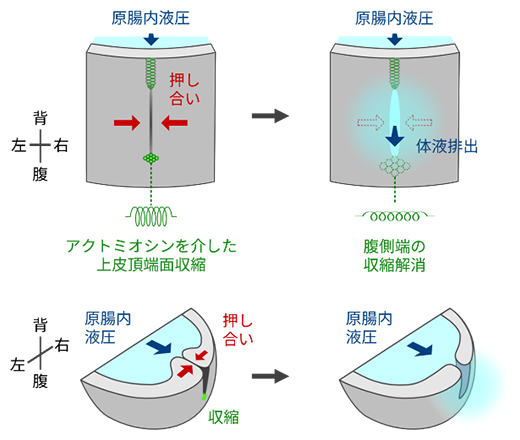
図8 アクトミオシン収縮を介した原口開閉制御機構
原口スリットの背腹両端の細胞では、アクトミオシン依存的な上皮頂端面収縮が生じ、原口スリットに押し合う力を与えた結果、原腸内液圧にあらがい、スリットの閉鎖が維持される。その後、腹側端の収縮が解消することで、押し合う力が減弱してスリット耐圧性が低下し、スリットが開口することで、原腸内の体液が排出される。
- 注2)Schweickert A, Weber T, Beyer T, et al. Cilia-driven leftward flow determines laterality in Xenopus. Curr Biol. 2007;17(1):60-66. doi:10.1016/j.cub.2006.10.067
今後の期待
本研究は、機能的な筋肉を持たない初期胚でも、上皮細胞頂端面の収縮を活用することで、マクロスケールの孔「原口」の開閉を制御できることを明らかにしました。
初期胚の細胞外体液は、ほとんど無色透明で標識しない限り見えないこともあり、初期胚の体液動態制御機構については未解明な点が多く残されています。原口の開閉制御の鍵であるアクトミオシン収縮はさまざまな動物種の発生過程において広く観察されるため、本研究が明らかにしたアクトミオシン収縮を介したマクロスケールの体液の通路を開閉する仕組みは、アフリカツメガエル以外の動物胚の体液動態制御でも活用されている可能性があります。
補足説明
- 1.アフリカツメガエル
卵が大きく(直径約1.1mm)、一度に大量に産卵するため、昔から発生学のモデル動物として使用されている。イギリスの生物学者ジョン・ガードンはアフリカツメガエルを用いてクローン技術を開発し、2012年にノーベル生理学・医学賞を受賞した。 - 2.アクトミオシン、アクチン繊維、ミオシン繊維、リン酸化ミオシン
アクトミオシンは、タンパク質のミオシンとアクチンの複合体。活性化されたモーター分子ミオシンは、ミオシン同士で複合体を形成しミオシン繊維となり、さらに細胞骨格であるアクチン繊維と結合する。ミオシン繊維にATPが結合すると、ATPが加水分解されてリン酸が解離し、リン酸化ミオシンができる。ATPの加水分解で生じたエネルギーを使ってミオシンがアクチン繊維上を滑るように動くことで、収縮力が発生する。 - 3.原口、原腸
原腸は胚の表面が陥入することによって形成される、将来消化管となる腔。陥入点は原腸形成後、原腸と胚外をつなぐ孔(原口)となり、原腸が原口の反対側にも開口すると、1本の管が体内を貫くことになる。このような発生様式を経る動物は、原口が将来口となるグループ(旧口動物:節足動物や軟体動物など)と、肛門となるグループ(新口動物:棘皮動物や脊椎動物など)に分けられる。 - 4.原腸胚期、神経胚期
受精卵の発生段階のうち、胚の表面が陥入して原腸(将来消化管になる)ができる時期を原腸胚期という。さらに発生が進み、背側に神経管(将来脳および脊髄になる)が作られる時期を神経胚期という。 - 5.ATP
生物全般に存在するリン酸化合物の一つで、塩基と糖が結合した化合物(ヌクレオシド)に三つのリン酸が結合していることから、アデノシン三リン酸と呼ばれている。加水分解により一つのリン酸が解離するとアデノシン二リン酸(ADP)となる。この加水分解で得られたエネルギーはさまざまな生体機能に利用されることから、エネルギー通貨とも呼ばれる。 - 6.上皮細胞
多くの臓器(大腸、胃、食道、肺、肝臓、膵臓、乳腺など)における機能的な主成分が上皮組織で、これを構成する細胞を上皮細胞と呼ぶ。隣り合う細胞同士が強固に接着して、単層または多層のシート状、管腔状の構造を形成する。上皮細胞は、体腔側に面している頂端部と、基質側に面している基底部という極性を持つ。 - 7.免疫染色法
組織学で汎用される、組織中の特定の分子に対して特異的に結合する抗体を用い、分子や細胞を可視化する方法。可視化には酵素反応で色を付ける方法や、蛍光物質を抗体に結合させる方法などがある。本研究では、後者の方法で蛍光イメージングにより観察を行った。
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)により実施し、日本学術振興会(JSPS)科学研究費助成事業挑戦的研究(開拓)「分泌蛋白質の拡散速度の時空間制御(研究代表者:猪股秀彦)」、同新学術領域研究(研究領域提案型)「多細胞システムにおける細胞運動と運命決定の情報処理特性の解析(研究分担者:猪股秀彦)」、科学技術振興機構(JST)さきがけ「流体による1細胞解析から1個体解析への応用(研究代表者:猪股秀彦)」、同次世代研究者挑戦的研究プログラム「初期胚の体液動態を制御する原口の「圧力弁」としての機能の解析と応用(研究代表者:加藤壮一郎)」による助成を受けて行われました。
原論文情報
- Soichiro Kato* and Hidehiko Inomata* (*Co-corresponding author), "Blastopore gating mechanism to regulate extracellular fluid excretion", iScience, 10.1016/j.isci.2023.106585
発表者
理化学研究所
生命機能科学研究センター 体軸動態研究チーム(研究当時)
チームリーダー(研究当時)猪股 秀彦(イノマタ・ヒデヒコ)
研修生(研究当時)加藤 壮一郎(カトウ・ソウイチロウ)
(現 大阪大学 大学院理学研究科 招へい研究員、現 発生幾何研究チーム 研究パートタイマーⅠ)
 猪股 秀彦
猪股 秀彦
 加藤 壮一郎
加藤 壮一郎
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
大阪大学 理学研究科 庶務係
Tel: 06-6850-5280
Email: ri-syomu [at] office.osaka-u.ac.jp
※[at]は@に置き換えてください。
