2023年6月27日
理化学研究所
東京工業大学
わずか窒素3原子でがんを見つけてα線治療
-体内カスケード反応でがん組織にα核種を閉じ込める新戦略-
理化学研究所(理研)開拓研究本部 田中生体機能合成化学研究室の田中 克典 主任研究員(東京工業大学 物質理工学院 応用化学系 教授)、アンバラ・プラディプタ 客員研究員(同大学 物質理工学院 応用化学系 助教)、大出 雄大 研修生(同大学 物質理工学院 応用化学系 博士後期課程1年)、仁科加速器科学研究センター 核化学研究開発室の羽場 宏光 室長らの共同研究チームは、がん細胞で特異的かつ大量に産生されるアクロレインという分子との化学反応を利用して、放射線源となるアスタチン-211(211At)[1]で標識した治療分子を体内のがん組織のみに効率的に結合させ、生体内部からの放射線照射でがんを治療する技術を開発しました。
本研究成果は、副作用のない放射線治療の開発に貢献すると期待できます。
がんの放射性治療薬[2]は、体内で選択的にがんに送達されないと正常細胞にも放射線を照射するため、さまざまな副作用につながるという問題があります。
今回、共同研究チームは、がん細胞内でアジド基(-N3)を持つフェニルアジドという化合物とアクロレイン(CH2=CHCHO)が選択的に起こす環化付加から始まるカスケード反応[3]を利用した治療分子(ADIPA)を設計しました。治療核種として用いた211Atは、治療効果の高いα線[4]を放出する放射性核種であり、理研仁科加速器科学研究センターの放射性同位体(RI)[5]製造技術を用いて製造しました。ADIPAをヒト肺がん細胞移植マウスに注射投与したところ、ADIPAはがん組織のみに結合し、がんを放射線治療することに成功しました。体重減少や炎症などの副作用は全く見られず、生存率も高いことが明らかになりました。
本研究は、科学雑誌『Chemical Science』のオンライン版(6月27日付:日本時間6月27日)に掲載されました。
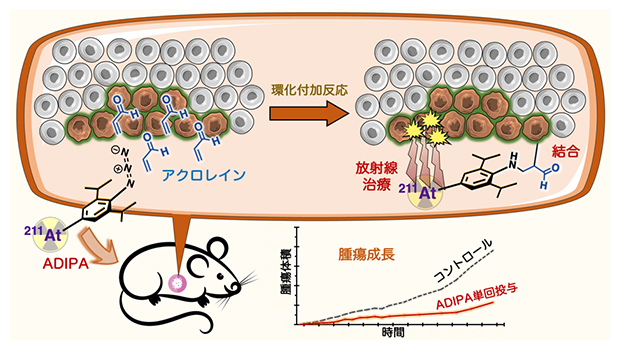
本研究で開発した放射性治療分子(ADIPA)の作用機序の概念図
背景
放射線療法はがんの一般的な治療法の一つです。近年では、α線を放出するα核種[4]を生体内に取り込み、生体内部からの放射線照射によってがんを治療する標的α線治療[6]が注目されています。α線は他の放射線に比べてエネルギーが高く飛距離が短いため、がん細胞の近くにα核種をうまく送達できれば、強いα線でがん細胞を死滅でき、離れた場所の正常細胞へのダメージを抑えることができます。しかし、がん細胞以外に送達されたり、がん細胞へ行き着くまでの時間が長くなったりすると、正常組織が放射線のダメージを受け、さまざまな副作用が引き起こされます。高い治療効果と少ない副作用を目指すため、標的α線治療ではα核種を高精度かつ迅速にがん細胞に送達するシステムが求められています。
さまざまなα核種の中でも、アスタチン-211(211At)は治療向きの物理的・化学的性質を持つため、標的α線治療において最も一般的に使われています。理研仁科加速器科学研究センター核化学研究開発室の羽場室長らは、この211Atを大量かつ高純度に製造できる方法を開発しています。
また、これまでに田中主任研究員らは、がん細胞において「アクロレイン」という分子(CH2=CHCHO)が特異的かつ大量に産生されていることを発見し、アクロレインと蛍光基を結合させたアジド基(-N3)を持つフェニルアジドとの環化付加から始まるカスケード反応により、がん細胞だけを高精度に標識できることを報告しています注1、2)。最近ではこの反応を応用し、抗がん剤をリンカーでつないだフェニルアジドを用いることで、マウス体内のがんに対して選択的に抗がん剤を放出する「プロドラッグ[7]」によるがん治療も達成しています注3)。
そこで本研究では、蛍光基を結合させたフェニルアジドの研究注1、2)と同じ標的システムを利用し、211Atを効率的にがん細胞に結合させ、α線でがんを死滅させる、新しい標的α線治療の実現を目指しました。
- 注1)2018年11月28日プレスリリース「有機合成反応で乳がん手術を改革」
- 注2)2022年1月17日プレスリリース「乳がん術中迅速診断多施設臨床研究を行う共同研究を開始」
- 注3)2021年3月31日プレスリリース「体内での環化付加反応によるがん化学療法」
研究手法と成果
共同研究チームは、低濃度でフェニルアジドとアクロレインの反応が進行するように、アクロレインに対する反応性が高い2,6-ジイソプロピルフェニルアジドを用いました。このフェニルアジドのアジド基のパラ位に211Atを導入した標的α線治療分子を設計し、これを「211At-radiolabeled 2,6-diisopropylphenylazide:ADIPA」と名付けました(図1)。
ADIPAはがん細胞に取り込まれると、がん細胞が産生するアクロレインと環化付加から始まるカスケード反応を起こし、ジアゾ基(=N2)を持つジアゾ化合物へと変化します。ジアゾ基は速やかに反応し、細胞小器官(オルガネラ)と共有結合を形成します。こうしてがん細胞に選択的に結合したADIPAは211Atからα線を放出し、周辺のがん細胞を死滅させますが、一方でα線は飛距離が短いため、少し離れた場所に存在する正常細胞には影響を及ぼさないと考えられます。
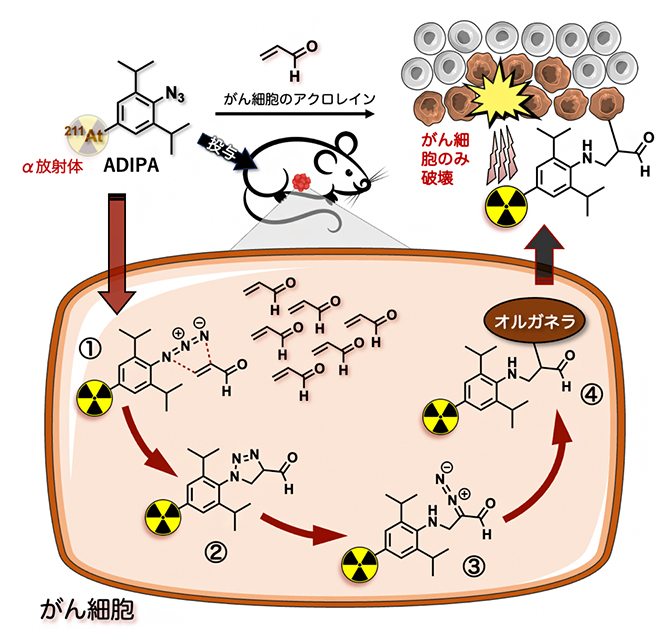
図1 アジド基とアクロレインの環化付加から始まるカスケード反応によるADIPAの作用
ADIPAは、2,6-ジイソプロピルフェニルアジドにα核種である211Atが結合した構造をしている(左上)。ADIPAががん細胞(茶色)に取り込まれると、アジド基(-N=N=N)とがん細胞が産生するアクロレイン(CH2=CHCHO)が環化付加反応を起こし(①)、中間体を経て(②)、ジアゾ化合物(=N2を持つ)となる(③)。ジアゾ化合物は速やかに細胞小器官(オルガネラ)と反応し、共有結合を形成する(④)。こうして、がん細胞に選択的に結合したADIPAは、211Atから高エネルギーのα線を放出し、周辺のがん細胞を死滅させる(右上)。一方で、α線は飛距離が短いため、少し離れた正常細胞(右上灰色)には影響を及ぼさない。
ヒト肺がん細胞(A549)を移植したゼノグラフトモデルマウス[8]を、ビークル(溶媒のみ)の腫瘍内投与、Na[211At]の腫瘍内投与、ADIPAの静脈内投与、ADIPAの腫瘍内投与の4群に分け、治療効果を調査しました(図2)。ここで、腫瘍内投与は腫瘍内への直接注射、静脈内投与は静脈への注射を指します。その結果、211Atをそのまま腫瘍内投与(Na[211At])した群の治療効果は、溶媒のみ(ビークル)を投与した群と比べて腫瘍の成長速度にあまり差がなく、投与後35日目の生存率は15%近くまで低下しました。一方で、ADIPAを投与した群は、Na[211At]群の約3分の1の投与量(放射線量)にもかかわらず、腫瘍内投与・静脈内投与のいずれにおいても、腫瘍の成長が抑制され、長く生存することができました。
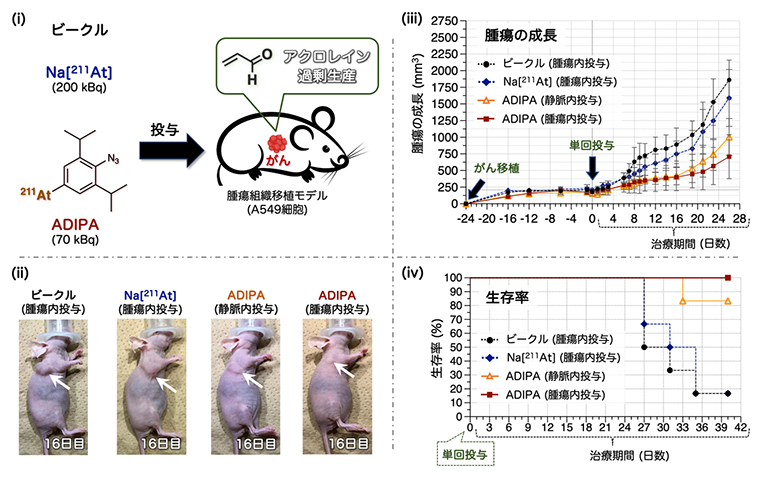
図2 ヒト肺がん移植マウスへの薬剤投与によるがん治療試験
- (i)試験に用いた薬剤。ビークルは溶媒のみ、Na[211At]はナトリウムと211Atの化合物、ADIPAは今回設計した治療分子。
- (ii)ヒト肺がん細胞を移植したゼノグラフトモデルマウス4群の投与後16日目の写真。矢印は腫瘍を指す。
- (iii)マウス4群における腫瘍の成長を表すグラフ。ADIPAを投与した群では、良好な腫瘍抑制効果が見られた。一方で、Na[211At]投与と溶媒のみ投与(ビークル)群では腫瘍の成長を抑制できなかった。
- (iv)マウス4群における生存率を表すグラフ。ADIPAを投与した群の生存率は、投与後33日目まで100%だった。ビークルとNa[211At]を投与した群の生存率は、投与後35日目で15%近くまで低下した。
さらに、ADIPAを投与した二つの群について、投与18時間後にマウスを解剖しADIPAの生体内分布を確認したところ、投与したADIPAのうち多くががんに蓄積していることが分かりました。また、投与放射線量が70キロベクレル(kBq)と少量であったことから、治療期間中は全てのマウス群において体重が維持され、炎症などの副作用も全く生じませんでした。
このようにして、体内のがん細胞が生成するアクロレインとADIPAが反応することで、がん組織のみにα核種を結合させ、α線でがんを死滅させる、効果的な標的α線治療を実現しました。
今後の期待
本研究では、がん細胞で大量に産生されるアクロレインという生体内分子に着目し、がん細胞内でα核種を結合させたフェニルアジドとアクロレインの有機化学反応を起こし、α核種をがん細胞に選択的に結合させるという画期的な視点で研究を進め、副作用のない新しい標的α線治療法の開発に成功しました。
通常の標的α線治療では、標的のがん細胞と結合するために抗体などの大きな分子を用いますが、本研究ではわずか窒素3原子のアジド基がその機能を果たすことから、副作用を抑えながら高い放射線治療効果が得られたと考えられます。
アクロレインはほとんどの種類のがん細胞において産生されているため、この治療分子はさまざまな種類のがんの治療への適用が期待できます。
補足説明
- 1.アスタチン-211(211At)
アスタチンの放射性同位体の一つ。アスタチンは周期表でヨウ素(I)の下に位置するハロゲン元素であり、有機化合物に共有結合で組み込むことができる。治療において適度な半減期(7.2時間)を持つα核種である。 - 2.放射性治療薬
放射性同位体を用いた治療薬。特定の細胞や臓器に集まる化合物にRIを結合させ、生体内部からの放射線照射によって腫瘍などを破壊し、治療する。 - 3.カスケード反応
一つの反応によって別の部分に活性な官能基が生成し、さらにそれがドミノ倒しのように次へ次へと反応を起こしていく反応形式の総称。ドミノ反応、タンデム反応とも呼ばれる。本研究では、アクロレインとフェニルアジドが5員環を形成する環化付加反応からスタートする。 - 4.α線、α核種
α線は、陽子2個と中性子2個(ヘリウム原子核)からなる粒子線。α核種はα線を放出する放射性核種の総称。α核種は、α線放出後、原子番号が2、質量数が4減少する。 - 5.放射性同位体(RI)
物質を構成する原子核には、構造が不安定なために時間とともに放射線を放出しながら崩壊していくものがある。このような原子核を持つ同位体を放射性同位体と呼ぶ。同位体とは同じ元素であっても中性子の数が異なるもので、安定なものと不安定なものに分類される。RIはradioisotopeの略。 - 6.標的α線治療
細胞障害能力を持つ放射性同位体を体内に注射し、がん細胞だけを標的として体内から放射線を照射し殺傷する治療法を標的アイソトープ治療と呼ぶ。中でも、特に細胞障害能力の高いα線を放つα核種を用いる場合には標的α線治療と呼ぶ。 - 7.プロドラッグ
生体内の薬剤標的部位での化学反応によって、薬効を示す分子に変換されるようにデザインされた薬剤。標的部位選択的に活性を示すため、副作用の軽減が期待できる。標的部位での化学反応には、生体内の酵素による触媒反応や生体内の低分子化合物との反応が主に用いられる。また、近年は生体内に導入した遷移金属触媒によって分子を変換する研究も進められている。 - 8.ゼノグラフトモデルマウス
ヒト由来のがん細胞を免疫不全マウス(免疫に欠陥があるマウス)へ移植したモデル。
共同研究チーム
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(タナカ・カツノリ)
(東京工業大学 物質理工学院 応用化学系 教授)
客員研究員 アンバラ・プラディプタ(Ambara Pradipta)
(東京工業大学 物質理工学院 応用化学系 助教)
研修生 大出 雄大(オオデ・ユウダイ)
(東京工業大学 物質理工学院 応用化学系 博士後期課程1年)
専任研究員 石渡 明弘(イシワタ・アキヒロ)
基礎科学特別研究員 六車 共平(ムグルマ・キョウヘイ)
特別研究員(研究当時)ペニー・アーマディ(Peni Ahmadi)
テクニカルスタッフⅡ 中村 亜希子(ナカムラ・アキコ)
研究パートタイマーⅡ 江河 泰子(エガワ・ヤスコ)
研究パートタイマーⅡ 草苅 百合子(クサカリ・ユリコ)
仁科加速器科学研究センター 核化学研究開発室
室長 羽場 宏光(ハバ・ヒロミツ)
協力研究員 イン・シャオジェ(YIN Xiaojie)
協力研究員(研究当時)ワン・ヤン(WANG Yang)
研究パートタイマーⅠ 佐藤 望(サトウ・ノゾミ)
原論文情報
- Yudai Ode, Ambara R. Pradipta, Peni Ahmadi, Akihiro Ishiwata, Akiko Nakamura, Yasuko Egawa, Yuriko Kusakari, Kyohei Muguruma, Yang Wang, Xiaojie Yin, Nozomi Sato, Hiromitsu Haba, and Katsunori Tanaka, "Therapeutic efficacy of 211At-radiolabeled 2,6-diisopropylphenyl azide in mouse models of human lung cancer", Chemical Science, 10.1039/d3sc02513f
発表者
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(タナカ・カツノリ)
(東京工業大学 物質理工学院 応用化学系 教授)
客員研究員 アンバラ・プラディプタ(Ambara Pradipta)
(東京工業大学 物質理工学院 応用化学系 助教)
研修生 大出 雄大(オオデ・ユウダイ)
(東京工業大学 物質理工学院 応用化学系 博士後期課程1年)
仁科加速器科学研究センター 核化学研究開発室
室長 羽場 宏光(ハバ・ヒロミツ)
 左からアンバラ・プラディプタ、大出雄大、田中克典
左からアンバラ・プラディプタ、大出雄大、田中克典
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
東京工業大学 総務部 広報課
Tel: 03-5734-2975 / Fax: 03-5734-3661
Email: media [at] jim.titech.ac.jp
※[at]は@に置き換えてください。
