理化学研究所(理研)生命機能科学研究センター 転写制御構造生物学研究チームの関根 俊一 チームリーダー、大澤 拓生 研究員らの研究チームは、RNAウイルスの一種であるデングウイルス[1]のゲノム複製を担う「RNAレプリカーゼ[2](RNA複製酵素)」の立体構造を解明し、感染細胞内でウイルスが増殖する仕組みの一端を明らかにしました。
本研究成果は、有効な治療法のないデング熱[1]やデング出血熱[1]など、デングウイルス感染症に対する抗ウイルス薬の開発に貢献すると期待できます。
デングウイルスのゲノムは一本鎖RNAであり、その合成に必要な酵素活性は、「RNA依存性RNAポリメラーゼ[2]であるNS5[3]」と「ヘリカーゼ[4]であるNS3[3]」の二つの多機能ウイルスタンパク質に全て集約されています。NS5とNS3は複合体を形成してRNAレプリカーゼとして機能し、ゲノムRNAとNS5の相互作用により、RNA合成の開始と伸長が進みます。しかし、これらの相互作用の仕組みやRNA合成に対する役割はこれまで分かっていませんでした。
今回、研究チームはクライオ電子顕微鏡[5]を用いて、RNA合成の開始およびRNAを伸長中の複合体の立体構造を解析し、NS5、NS3、RNAがどのように相互作用してそれぞれが働いているのかを明らかにしました。この結果、NS5に存在する塩基性ポケット[6](Thumbポケット)とRNAの相互作用が、今後の抗ウイルス薬開発の有力な標的となる可能性が示されました。
本研究は、科学雑誌『Molecular Cell』オンライン版(7月20日付:日本時間7月21日)に掲載されました。
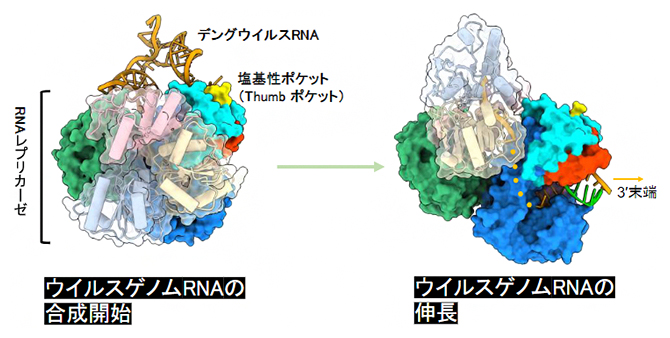
デングウイルスRNAの合成開始複合体と伸長複合体の構造
背景
デングウイルスは蚊によって媒介され、デング熱やデング出血熱などのデングウイルス感染症を引き起こします。感染しても多くの場合は無症状か軽症で済みますが、熱帯・亜熱帯地方での流行では多数の死者が出た地域もあります。世界人口の約半数にデングウイルス感染症のリスクがあると推定されていますが、現在のところ有効な治療薬は実用化されていません注1)。
デングウイルスは、ジカウイルス[7]、黄熱病ウイルス、日本脳炎ウイルスを含むフラビウイルス属に分類されるRNAウイルスです。デングウイルスゲノムは、5'末端[8]にキャップ構造[9]を持つ一本鎖(+)RNA[10]であり、非翻訳領域にある相補的配列により部分的に二本鎖RNAが形成されることで、環状化することが知られています(図1)。
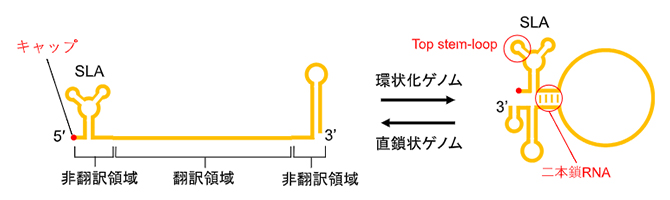
図1 デングウイルスのゲノム構造
- 左:デングウイルスゲノムは、5'末端にキャップ構造を持つ一本鎖(+)RNAであり、翻訳領域にコードされるアミノ酸配列から1本のタンパク質が翻訳される。翻訳されたタンパク質は切断され、ウイルスの増殖に必要な複数の成熟タンパク質が生成される。RNA両端の非翻訳領域はループやヘアピンなどの高次構造を形成し、特に5'末端領域にある構造はステムループA(SLA)と呼ばれる。
- 右:非翻訳領域には相補的なRNA配列が存在し、分子内で部分的に塩基対を形成して二本鎖RNAを形成することで環状化する。
感染細胞内でデングウイルスが増殖するためのRNA合成に必要な酵素活性は、多機能ウイルスタンパク質「RNA依存性RNAポリメラーゼであるNS5」と「ヘリカーゼであるNS3」に全て集約されています。NS5はRNAを鋳型として、それと相補的なRNAを合成する酵素、NS3は絡み合ったRNAをほどく酵素です。それらが相互作用し、その機能を協調的に働かせることで、ゲノムRNAを合成するための「RNAレプリカーゼ(RNA複製酵素)」として機能していると考えられています。
また、ゲノムRNA合成には、ゲノムRNAの5'末端の領域にある「ステムループ[11]A(SLA)」とNS5との相互作用が不可欠であることが知られており、図2に示す4ステップでウイルスゲノムが複製されます。
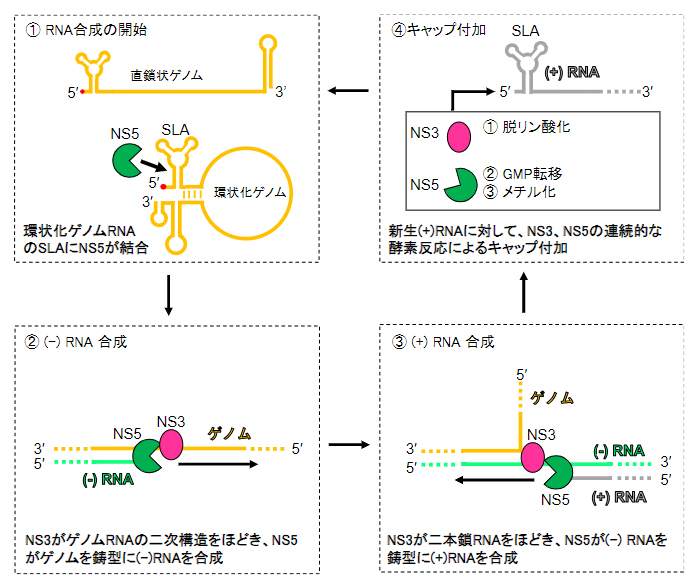
図2 デングウイルスのゲノム複製の概略図
- ①NS5が環状化ゲノムRNA((+)RNA)のステムループA(SLA)に結合する。
- ②NS3がRNAの二次構造をほどきながら、NS5が(+)RNAを鋳型として相補鎖((-)RNA)を合成し、一時的に二本鎖RNAが形成される。
- ③NS3が二本鎖RNAをほどきながら、NS5が(-)RNAを鋳型として、(+)RNAを合成する。
- ④NS3とNS5により、新たに合成された(+)RNAにキャップが付加される。
NS5やNS3の機能を阻害する分子を設計できれば、抗ウイルス薬の開発につながると期待できますが、一連のステップにおける相互作用の仕組みやウイルス複製における意義はよく理解されていませんでした。そこで今回、クライオ電子顕微鏡を用いた構造生物学的解析により、RNA合成開始時およびRNA伸長中に、NS5とNS3がどのような複合体を形成しているのかを明らかにすることにしました。
研究手法と成果
研究チームはまず、SLA配列を持つウイルスゲノムを模倣した小さなRNA(ミニゲノム)とNS5タンパク質、NS3タンパク質を試験管内で混ぜ合わせ、感染細胞内でウイルスRNAの合成が開始する状況を再現しました。こうして再構成したRNA合成開始複合体をクライオ電子顕微鏡により解析した結果、NS5とミニゲノムの複合体(NS5-SLA複合体)と、NS5とNS3およびミニゲノムの複合体(NS5-NS3-SLA複合体)の構造を得ることに成功しました(図3)。
NS5-SLA複合体の構造を詳しく見ると、V字型をしたSLAがNS5の二つのドメイン(MTドメインとRNA合成活性ドメイン)を橋渡ししていました(図3A)。このうち、MTはキャップ付加に関わる酵素活性を持つドメインであり、これと相互作用するSLAもキャップ構造を含む領域でした。また、RNA合成活性ドメインと相互作用しているのは、SLAに存在する三つのステムループ構造のうちTop stem-loopと呼ばれる部分であり(図1右)、これがRNA合成活性ドメインに形成された塩基性のポケット(Thumbポケット)に入り込んでいました(図3B、C)。
Thumbポケットを構成する塩基性アミノ酸をアラニンに置換すると、NS5のSLAに対する親和性が低下したことから、NS5とSLAの結合においてThumbポケットが重要な役割を果たしていることが示されました。これらの結合の仕方は、環状化ゲノムの3'末端[8]をNS5のRNA合成活性部位の近くに配置するのに適したものになっています(図3E)。NS5によるRNA合成は、鋳型となるRNA((+)RNA)の3'末端から開始します。従って、この空間配置の確立が、SLAとNS5の相互作用がRNA合成の開始に必要である一つの理由であると考えられます。
一方、NS5-NS3-SLA複合体では、NS3はNS5のRNA合成活性ドメイン側面に位置し、NS5のMTドメインとともにSLAの5'末端近くに配置されていることが分かりました(図3D)。この結合様式は、キャップ付加時に起こるNS3とNS5の連続的な酵素反応にも役立っている可能性があります(図3F)。
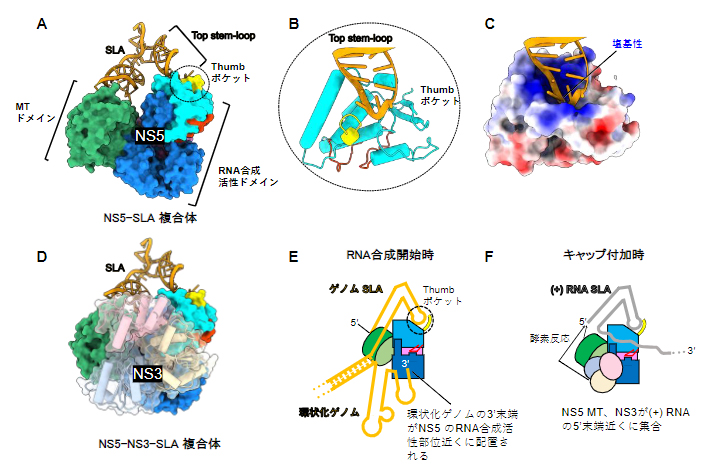
図3 RNA合成開始複合体の構造
- A)NS5-SLA複合体の構造。NS5は、キャップ付加に必要な酵素活性を持つMTドメインと、RNA依存性RNAポリメラーゼ活性を持つRNA合成活性ドメインで構成される。ゲノムRNAのSLAは、この二つのドメインを橋渡しするように結合する。
- B)SLAのTop stem-loopが結合したThumbポケットの拡大図。円柱はαヘリックス構造を示す。
- C)Thumbポケットの表面電荷図。正電荷を持つ塩基性アミノ残基(青)がポケットに集中しており、負電荷を持つRNAのリン酸骨格と相互作用していると考えられる。
- D)NS5-NS3-SLA複合体の構造。NS3はNS5のRNA合成活性ドメイン側面に位置する。
- E)RNA合成開始時における複合体の機能モデル。環状化ゲノムの3'末端がNS5のRNA合成活性部位近くに配置されることで、ウイルスゲノムの複製が開始される。
- F)キャップ付加時における複合体の機能モデル。NS5のMTドメインとNS3が(+)RNAの5'末端近くに集合し、NS3とNS5の連続的な酵素反応に有利な配置となる。
次に、RNA複製が伸長中の状態となるようにデザインした二本鎖RNAを用いて、ウイルスRNA伸長複合体の立体構造を決定しました(図4)。驚くべきことに、NS3は、NS5のMTドメインとThumbポケットの両方と相互作用しており、RNA合成開始時にNS5に結合していたSLA(図3A)と置き換わるような位置を占めていました。また、RNA伸長複合体では、RNA合成開始複合体とは異なり、NS3の一本鎖RNA結合部位からNS5のRNA合成活性部位へ通じる道が新たに形成されていました(図4A、B)。この道は、NS3によってほどかれた二本鎖RNAのうち、鋳型となる一本鎖RNAをNS5にスムーズに受け渡すことを可能にし、効率的なRNA合成に役立っているのではないかと考えられます。
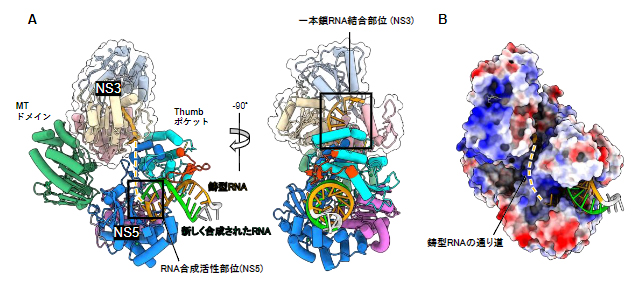
図4 RNA伸長複合体の構造
- A)RNA伸長複合体の構造を2方向から見た図。NS3がNS5のMTドメインとThumbポケットの両方と相互作用し、RNA合成開始複合体におけるSLA(図3A)と置き換わるような位置を占めていた。また、NS3の一本鎖RNA結合部位(右図の黒枠)からNS5のRNA合成活性部位(左図の黒枠)へ通じる道(黄破線)が新たに形成されていた。
- B)RNA伸長複合体の表面電荷図。RNAの通り道に正電荷を持つ塩基性アミノ酸残基(青)が集中している。
以上の結果から、多機能ウイルスタンパク質NS5とNS3は、RNA合成開始時およびRNA伸長中に異なる配置で複合体を形成することで、RNA合成の促進に寄与していることが示唆されました(図5)。
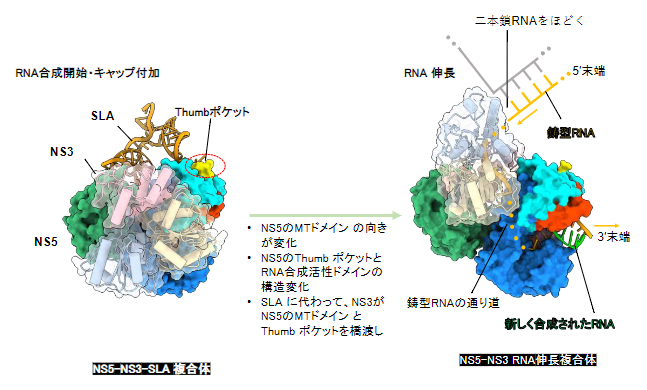
図5 RNA合成開始複合体からRNA伸長複合体への構造変化
本研究で明らかとなった、RNA合成開始複合体(NS5-NS3-SLA複合体)とRNA伸長複合体(NS5-NS3-RNA複合体)の立体構造。RNA合成の開始時と伸長時で、タンパク質同士の相互作用やタンパク質とRNAの相互作用の様式が大きく変化することで、ウイルスRNAが効率よく合成されると考えられる。
今後の期待
デングウイルスは世界的な公衆衛生上の脅威であり、その感染症に対する効果的な治療薬の登場が待たれています。本研究は、NS5、NS3、SLAといったデングウイルスのゲノム複製において中心的な働きをするタンパク質やRNAのさまざまな相互作用を明らかにすることに成功しました。特に、NS5とSLAの相互作用情報から、NS5のThumbポケットにおけるタンパク質-RNA間の結合を阻害することで、ウイルスRNAの複製を阻止できる可能性が示されました。
これにより、例えばSLAのTop stem-loopのような立体構造を持つ人工RNAを設計し、感染細胞に投与すれば、ウイルスRNAがNS5に結合できなくなると考えられることから、今後このようなコンセプトによるRNA医薬開発への貢献が期待できます。
またSLAは、ジカウイルスや日本脳炎ウイルスなど他のフラビウイルスにおいても共通するゲノム複製の重要因子であるため、本研究で得られた知見は、フラビウイルス全般を標的とする抗ウイルス薬の開発にも応用できる可能性があります。
補足説明
- 1.デングウイルス、デング熱、デング出血熱
熱帯・亜熱帯地域に生息する蚊に媒介される病原性ウイルス。感染すると急激な発熱を引き起こし(デング熱)、まれに重症化する場合がある(デング出血熱)。日本国内では、2016年に発生地域から帰国した患者がデング出血熱で死亡した例や、2019年に海外渡航歴のない患者がデング熱を発症した例などがある。 - 2.RNAレプリカーゼ、RNA依存性RNAポリメラーゼ
RNAウイルスのゲノム複製に関わる酵素をRNAレプリカーゼと呼ぶ。その主体はRNAを鋳型として、それと相補的なRNAを合成する酵素のRNA依存性RNAポリメラーゼである。 - 3.NS5、NS3
デングウイルスのゲノムは1本の長いタンパク質をコードし、そのタンパク質が切断された断片が機能する。NSは、それらの断片のうち非構造タンパク質(nonstructural protein)に通し番号を配したもの。ウイルスタンパク質の切断やRNA複製などに関わる酵素を含む。 - 4.ヘリカーゼ
絡み合った核酸(二本鎖核酸、二次構造を形成した核酸)をATPのエネルギーを利用してほどく酵素。 - 5.クライオ電子顕微鏡
タンパク質などの生体試料を、水溶液中の生理的な環境に近い状態で観察するために開発された電子顕微鏡。 - 6.ポケット
原子レベルで見たタンパク質の表面にはでこぼこがあり、その中で低分子が結合しやすいポケット状のくぼんだ空間をポケット(結合ポケット)と呼ぶ。 - 7.ジカウイルス
デングウイルスと同じフラビウイルス属に分類されるRNAウイルスの一種。デングウイルスと同様に、蚊によってヒトへの感染が媒介される。デング熱より症状は軽いことが多いが、妊婦への感染により胎児が小頭症になる例が報告されている。 - 8.5'末端、3'末端
RNAは、ヌクレオシドのリボースの5'位のヒドロキシ基と3'位のヒドロキシ基がリン酸ジエステル結合によって連結されてできている。RNAの5'位のヒドロキシ基側の末端を5'末端、3'位のヒドロキシ基側の末端を3'末端と呼ぶ。RNA依存性RNAポリメラーゼによる伸長反応では、新生RNAは5'→3'の方向に伸びていくが、これは鋳型RNAから見ると3'側から合成が開始することを意味する。 - 9.キャップ構造
真核生物mRNAの5'末端に7-メチルグアノシンが結合した構造。mRNAの翻訳開始などに関与している。デングウイルスゲノムも似たような構造を持っている。 - 10.(+)RNA
デングウイルスのようなRNAウイルスは、一本鎖RNAをゲノムとしても、ゲノムの鋳型としても、mRNAとしても用いるため、その表記には注意を要する。(+)RNAは、ウイルスタンパク質の翻訳の際にmRNAとして働く一本鎖RNAを指す。フラビウイルスでは、(+)RNAがゲノムRNAであり、5'末端にキャップ構造が付加されている。一方、(-)RNAは(+)RNAと相補的なRNAであり、(+)RNA合成時には鋳型として働く。 - 11.ステムループ
RNAの二次構造の一種。一本鎖RNAは、分子内で塩基同士(AとU、CとG)が水素結合することで局所的に二本鎖を形成する。この二本鎖の部分をステムと呼び、ステムを構成するRNAが折れ曲がって環状の一本鎖となっている構造をステムループと呼ぶ。
研究チーム
理化学研究所 生命機能科学研究センター 転写制御構造生物学研究チーム
チームリーダー 関根 俊一(セキネ・シュンイチ)
研究員 大澤 拓生(オオサワ・タクオ)
上級研究員 江原 晴彦(エハラ・ハルヒコ)
テクニカルスタッフⅠ 青木 真理(アオキ・マリ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業基盤研究(S)「転写と中核的な生命機能を結びつける高次複合体の構造基盤(研究代表者:関根俊一)」、同基盤研究(C)「デングウイルスゲノム複製機構の構造基盤(研究代表者:大澤拓生)」による助成を受けて行われました。
原論文情報
- Takuo Osawa, Mari Aoki, Haruhiko Ehara, Shun-ichi Sekine, "Structures of dengue virus RNA replicase complexes", Molecular Cell, 10.1016/j.molcel.2023.06.023
発表者
理化学研究所
生命機能科学研究センター 転写制御構造生物学研究チーム
チームリーダー 関根 俊一(セキネ・シュンイチ)
研究員 大澤 拓生(オオサワ・タクオ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
