2023年7月31日
理化学研究所
次世代天然物化学技術研究組合
新型コロナウイルスパパイン様プロテアーゼの構造柔軟性
-COVID-19の新しい治療薬開発に期待-
理化学研究所(理研)生命機能科学研究センター 生体分子動的構造研究チームの嶋田 一夫チームリーダー(次世代天然物化学技術研究組合技術顧問)と白石 勇太郎 研究員の研究チームは、新型コロナウイルス感染症(COVID-19)の原因ウイルスであるSARS-CoV-2のパパイン様プロテアーゼ[1]の薬剤結合ポケット[2]に構造柔軟性が存在し、これがプロテアーゼ阻害剤との結合を制御していることを解明しました。
本研究成果は、COVID-19の新しい治療薬候補分子のスクリーニングや、既存の抗ウイルス薬の構造最適化に貢献すると期待できます。
タンパク質分解酵素のパパイン様プロテアーゼはSARS-CoV-2の増殖に必須のウイルスタンパク質であり、COVID-19の治療薬開発の主要な標的分子の一つです。しかし、既存のパパイン様プロテアーゼの阻害剤の活性は、治療薬として実用化を目指すには不十分であり、活性を向上させるための構造情報が求められていました。
今回、研究チームは、SARS-CoV-2由来パパイン様プロテアーゼと、既存の阻害剤の一つであるGRL0617[3]の相互作用を、溶液核磁気共鳴(NMR)法[4]を用いて解析しました。日本医療研究開発機構(AMED)の支援により導入された、Bruker社製4K 1GHz NMR装置[5]を用いた解析により、GRL0617と接触するパパイン様プロテアーゼのアミノ酸残基に構造柔軟性が存在し、結合ポケットに一過的な空隙が生じることが明らかとなりました。この空隙は、SARS-CoV-2の新たな創薬標的となる可能性があります。
本研究は、科学雑誌『Journal of the American Chemical Society』オンライン版(7月21日付)に掲載されました。
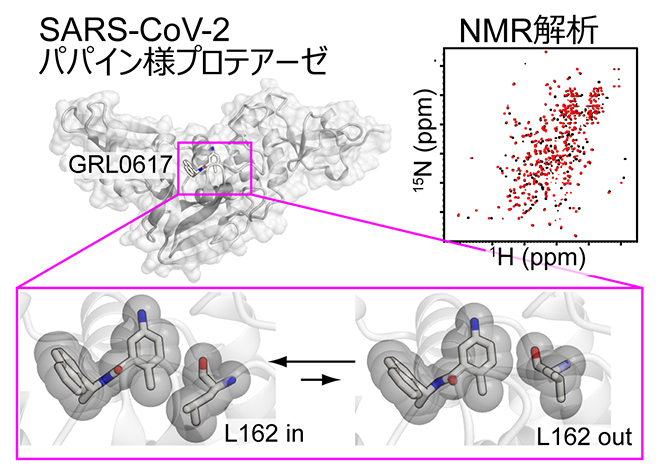
NMR法により明らかにした阻害剤結合ポケットの構造的柔軟性
背景
2019年12月に発生した、新型コロナウイルス感染症(COVID-19)は世界中に広がり、公衆衛生に脅威をもたらしています。COVID-19に対して、現在は効果的なワクチンや抗ウイルス薬が実用化されています。しかし、既存の抗ウイルス薬に耐性を持つ変異株が新たに出現すれば、再度の感染拡大時には予防・治療が困難になる恐れがあります。そのため、既存の抗ウイルス薬とは作用機序が異なる、新しい抗ウイルス薬の開発が依然として求められています。
COVID-19の原因ウイルスであるSARS-CoV-2は、1本鎖RNAをゲノムとして持ち、宿主細胞に感染すると、このRNAゲノムから巨大なポリタンパク質[6]が合成されます。このポリタンタンパク質が切断されて生成する断片が、SARS-CoV-2の増殖に必須のタンパク質として機能します。タンパク質分解酵素のメインプロテアーゼ[1]およびパパイン様プロテアーゼは、この切断反応を担う分子であり、抗ウイルス薬開発の重要標的です。
メインプロテアーゼを標的とした抗ウイルス薬として、ニルマトレルビル[7]が米国食品医薬品局(FDA)により承認されて実用化されています。一方で、パパイン様プロテアーゼに対しては、高い阻害活性を示すリード化合物[8]が少なく、実用化に至った阻害剤はありません。このため、パパイン様プロテアーゼを効率よく阻害する化合物の設計が求められていました。
研究手法と成果
研究チームは、パパイン様プロテアーゼとその代表的な阻害剤であるGRL0617の結合様式を溶液核磁気共鳴(NMR)法により解析しました。まず、共鳴周波数600メガヘルツ(MHz、1MHzは100万ヘルツ)のNMR装置を用いて、GRL0617結合状態および非結合状態のパパイン様プロテアーゼを測定しました。結合前後のNMRスペクトルを比較することにより、プロテアーゼ活性部位へのくぼみ(阻害剤結合ポケット)の周辺にGRL0617が結合していることが確認できました。
さらに、GRL0617の結合に伴うパパイン様プロテアーゼの構造状態の変化を解析するために、各アミノ酸残基の運動性の指標となる横緩和速度[9]を測定しました。その結果、GRL0617が結合したパパイン様プロテアーゼは、阻害剤結合ポケットの周辺の横緩和速度が増加しており、複数の状態をとることが示唆されました(図1)。また、同様の測定を、運動性をより鋭敏に検出できる共鳴周波数1ギガヘルツ(GHz、1GHzは10億ヘルツ)のNMR装置を用いて行ったところ、600MHzのNMR装置を用いた場合と比べてさらに横緩和速度が増大していました。以上の結果は、GRL0617結合状態において、阻害剤結合ポケットの周辺が複数の構造間を交換していることを示しています。
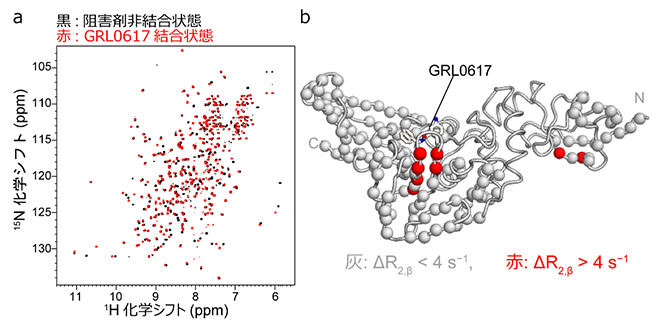
図1 NMR法によるパパイン様プロテアーゼとGRL0617の結合の検出
- (a)600MHzのNMR装置で測定した、パパイン様プロテアーゼのNMRスペクトル。横軸は水素原子、縦軸は窒素原子の化学シフトを示す。各シグナルが主鎖のアミド基(-CO-NH-)に対応する。阻害剤非結合状態(黒)と、GRL0617結合状態(赤)のスペクトルを重ねて示す。
- (b)GRL0617の結合に伴い横緩和速度が増大したアミノ酸残基の分布。タンパク質立体構造データベースで公開されているパパイン様プロテアーゼとGRL0617の複合体結晶構造上で、GRL0617の結合に伴う横緩和速度変化ΔR2,βが4s-1より大きいアミノ酸残基を赤で示した。GRL0617の結合ポケットに赤いアミノ酸残基が集中している。
パパイン様プロテアーゼとGRL0617は、これまでに複数の複合体構造が報告されており、これらは結合ポケットを形成する162番目のロイシン残基(L162)とGRL0617の空間的な配置関係に基づき、「L162 in」構造と「L162 out」構造に大別されます(図2a)。そこでL162の構造に着目して、さらにNMR解析を進めました。
L162側鎖メチル基(-CH3)のNMRシグナルの炭素原子化学シフト[10]から、その立体配座[11]を解析したところ、主にgauche+配座[11]をとっていることが示されました(図2b)。また、NMRで水素原子間の距離を測定する解析法であるNOE[12]から、L162のメチル基の水素とGRL0617の4位の水素原子(H4)が近接していることが示されました(図2c)。以上の結果は、溶液中のパパイン様プロテアーゼが、主に「L162 in」構造を形成していることを示しています。
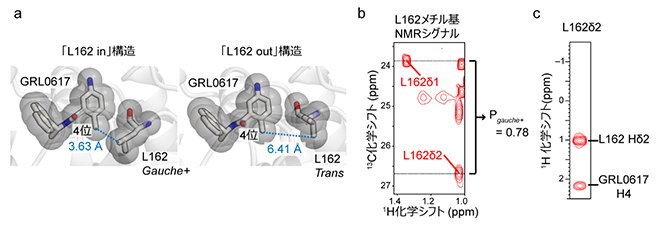
図2 パパイン様プロテアーゼの阻害剤結合ポケットの構造
- (a)パパイン様プロテアーゼのGRL0617結合部位の構造。L162がgauche+配座をとり、GRL0617の4位と接触する「L162 in」構造と、L162がtrans配座をとり、GRL0617から離れた「L162 out」構造が報告されている。
- (b)GRL0617が結合した構造での、L162メチル基(-CH3)のNMRシグナル。炭素原子の化学シフト値から、gauche+配座の形成割合は0.78と算出され、約8割がgauche+配座をとっていることが分かった。
- (c)L162メチル基とGRL0617の4位の近接した相互作用を検出したNOEを示すNMRスペクトル。
次に、タンパク質と相互作用する低分子の結合部位を検出するNMR法であるDIRECTION法[13]により、GRL0617の各水素原子とパパイン様プロテアーゼとの近接度を解析し、その結果を「L162 in」の結晶構造から計算される近接度と比較しました。その結果、結晶構造からの計算では最も大きな近接度を示すはずのGRL0617のH4は、DIRECTION法では他の水素原子と同程度の近接度を示していました(図3a~c)。
結晶構造中でGRL0617のH4と最も近接するアミノ酸残基はL162であることから、結晶構造からの計算とNMR実験の結果の違いは、結晶構造解析では捉えられていないL162の構造柔軟性にあると考えられました。これを緩和分散実験[14]により検証した結果、パパイン様プロテアーゼのL162メチル基は、GRL0617結合状態において、炭素原子の化学シフトが異なる複数の状態を交換していることが示されました(図3d)。
以上の結果から、GRL0617が結合したパパイン様プロテアーゼは、L162がGRL0617と近接した「L162 in」構造を主にとる一方で、GRL0617から離れてtrans配座[11]をとった「L162 out」構造も一過的に形成すると結論しました。このような構造柔軟性がSARS-CoV-2パパイン様プロテアーゼの阻害剤結合ポケットに存在し、GRL0617の4位の周りに一過的に空隙が生じることが初めて明らかになりました(図3e)。
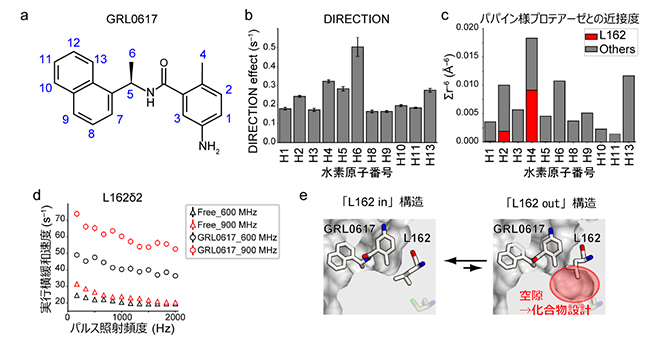
図3 阻害剤結合ポケットの構造柔軟性
- (a)GRL0617の化学構造。水素原子の番号を青色で示した。
- (b)DIRECTION法の解析結果。横軸にGRL0617の水素原子番号、縦軸にパパイン様プロテアーゼとの近接度を示すDIRECTION効果を示す。6位の水素原子(H6)が最も高い近接度を示し、4位の水素原子(H4)の近接度は他の水素原子と同程度である。
- (c)「L162 in」の結晶構造から逆計算した、GRL0617の各水素原子のパパイン様プロテアーゼとの近接度。L162との近接度の寄与を赤色で示した。H4の近接度に最も寄与している。
- (d)緩和分散実験によるL162の運動性の検出。三角で遊離状態、四角でGRL0617結合状態の結果をプロットした。黒色は600MHz、赤色は900MHzのNMR装置での実験結果。GRL0617結合状態の実行横緩和速度が大きく、またその大きさが磁場の強さに依存している(900MHzの方が600MHzよりも大きい)ことから、L162は複数の状態をとることが示された。
- (e)阻害剤結合ポケットの構造柔軟性。「L162 in」構造を主にとる一方で、「L162 out」構造が一過的に形成される。「L162 out」構造には、化合物設計の指針となりうる空隙が存在する。
今後の期待
従来の構造解析では、パパイン様プロテアーゼは「L162 in」構造でGRL0617に結合しており、GRL0617の4位の周りには構造展開の余地はないと考えられていました。本研究により、阻害剤結合ポケットに構造柔軟性が存在し、GRL0617の4位の周りに一過的に空隙が生じることが示されました。結晶構造解析で見られる最安定構造では存在しなかった、この空隙に着目して化合物を設計することにより、従来よりも活性の高い阻害剤が得られると期待できます。
パパイン様プロテアーゼの動的構造の検出には、4K 1GHz NMR装置を用いました。NMR法により得られる動的構造情報は、リード化合物探索の効率化や薬剤結合ポケットの探索に有効であることが示されています。4K 1GHz NMR装置は巨大分子の動的構造解析や、存在割合がより低いマイナー構造の高感度検出に有効であり、今後、創薬に資する生体分子の機能・構造解析への応用が期待できます。
補足説明
- 1.パパイン様プロテアーゼ、メインプロテアーゼ
プロテアーゼは、タンパク質を分解する酵素の総称。コロナウイルスはパパイン様プロテアーゼ、メインプロテアーゼの2種類のプロテアーゼを持ち、その両方がコロナウイルスの増殖に必要である。 - 2.結合ポケット
原子レベルで見たタンパク質の表面には凹凸があり、その中でも低分子が結合しやすいポケット状のくぼんだ空間を結合ポケットと呼ぶ。 - 3.GRL0617
パパイン様プロテアーゼの既知低分子阻害剤。2003年に流行したSARS-CoV由来のパパイン様プロテアーゼに対する阻害剤として開発され、新型コロナウイルス感染症のSARS-CoV-2由来のパパイン様プロテアーゼに対しても阻害活性を示すことが確認された。パパイン様プロテアーゼを標的とした治療薬開発のリード化合物として用いられている。 - 4.溶液核磁気共鳴(NMR)法
溶液中の生体分子などを、強い磁場中に置くことで生じる原子核の共鳴現象を観測することで、生体分子の構造や運動性を原子レベルで調べることができる分光法。NMRはNuclear Magnetic Resonanceの略。 - 5.4K 1GHz NMR装置
水素原子核の共鳴周波数が1GHz(10億ヘルツ)である最新型の超高磁場NMR装置。NMR装置の感度や分解能は、磁場が高いほど向上する。従来の超高磁場NMR装置ではマグネットを2K(ケルビン)まで冷却する必要があったが、この装置では冷却温度4K(-269°C)で1GHzを達成している。このため、装置の総重量は前世代機の3分の1(2300kg)まで小型化され、漏洩磁場の指標となる5ガウスライン半径は2分の1(1.9m)に、冷却に用いるヘリウムの消費量は3分の1(80mL/hr)に抑えられている。 - 6.ポリタンパク質
SARS-CoV-2のRNAゲノムから翻訳される巨大なタンパク質。パパイン様プロテアーゼとメインプロテアーゼにより切断されることで、その断片が機能を持つタンパク質となる。 - 7.ニルマトレルビル
SARS-CoV-2由来メインプロテアーゼの阻害剤。COVID-19の治療薬として米国食品医薬品局(FDA)により承認を受け、実用化されている。 - 8.リード化合物
創薬過程の出発点となる新薬候補化合物のこと。 - 9.横緩和速度
NMRシグナルとして観測する磁化が減衰していく速度のこと。分子運動と関わるパラメータであり、横緩和速度を解析することで、分子の運動性の情報を原子分解能で得ることができる。 - 10.化学シフト
核磁気共鳴の共鳴周波数は、同じ核種であっても周辺の化学環境によって異なるため、化学シフトと呼ばれる。化合物結合などの刺激に応じた化学シフトの変化を解析することにより、その刺激に伴う構造変化部位を同定できる。 - 11.立体配座、gauche+配座、trans配座
立体配座とは、生体分子が原子間の結合の回転により構成する、原子の空間的な配置のこと。gauche+配座とtrans配座はどちらも立体配座の一種であり、ロイシン残基の側鎖は、通常trans配座が安定だが、周囲の環境によってはgauche+配座をとる。 - 12.NOE
通常5オングストローム(A、1Aは100億分の1メートル)以内の空間的に近接した水素原子のペアで観測されるNMR現象。NOEのシグナル強度は水素原子間の距離に依存することから、分子間の相互作用を検出するための重要なパラメータとなる。NOEはNuclear Overhauser Effectの略。 - 13.DIRECTION法
低分子リガンドの構造中で、タンパク質との相互作用に用いられる部位を定量的に検出するNMR解析法。標的タンパク質存在下で、低分子リガンドの各水素原子の縦緩和速度を、標的タンパク質をラジオ波照射した条件としていない条件で測定し、その差を算出することで、標的タンパク質との近接度を定量的に抽出する。DIRECTIONはDifference of Inversion RECoverly rate with and without Target IrradiaONの略。 - 14.緩和分散実験
生体分子のミリ秒~マイクロ秒(100万分の1秒)の速さの運動性を解析するNMR解析法。この時間領域にはタンパク質とリガンドの相互作用や酵素反応など、生体分子の機能と関連した重要な過程が含まれる。
研究チーム
理化学研究所 生命機能科学研究センター 生体分子動的構造研究チーム
チームリーダー 嶋田 一夫 (シマダ・イチオ)
(次世代天然物化学技術研究組合 技術顧問、広島大学 副学長)
研究員 白石 勇太郎(シライシ・ユウタロウ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)および理事長裁量経費で実施しました。本研究で用いた4K 1GHz NMR装置は、日本医療研究開発機構(AMED)「次世代治療・診断実現のための創薬基盤技術開発事業」(RNA標的創薬技術開発)による助成を受けて導入されました。
原論文情報
- Yutaro Shiraishi, Ichio Shimada, "NMR characterization of the papain-like protease from SARS-CoV-2 identifies the conformational heterogeneity in its inhibitor-binding site", Journal of the American Chemical Society, 10.1021/jacs.3c04115
発表者
理化学研究所
生命機能科学研究センター 生体分子動的構造研究チーム
チームリーダー 嶋田 一夫(シマダ・イチオ)
研究員 白石 勇太郎(シライシ・ユウタロウ)
 嶋田 一夫
嶋田 一夫
 白石 勇太郎
白石 勇太郎
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
次世代天然物化学技術研究組合問い合わせ窓口
Email: info [at] natprodchem.jp
※上記の[at]は@に置き換えてください。
