理化学研究所(理研)生命機能科学研究センター 冬眠生物学研究チームの吹田 晃享 研修生(岡山大学大学院 医歯薬学総合研究科 麻酔・蘇生学教室 博士課程4年)、砂川 玄志郎 チームリーダーらの共同研究グループは、休眠[1]時の体温が特に低くなるマウス系統を見いだし、その細胞は培養下でも寒さに強いことを発見しました。
本研究成果は、冬眠[1]動物に特有の低温耐性の解明を進め、ヒトを含めた非冬眠動物を冬眠させる人工冬眠の実現や、その応用による救急医療、臓器保存の技術開発に貢献すると期待できます。
マウスは冬眠しませんが、飢餓状態に置かれると日内休眠[1]と呼ばれる一過性の低代謝状態[2]に陥り飢餓を乗り越えようとします。その際に低代謝により体温が低下します。
今回、共同研究グループは、休眠時の低体温が系統によって異なることを発見し、STM2という近交系[3]マウスで休眠中の体温が特に低く保たれていること(最低体温22℃)を見つけました。冬眠動物の組織は、冬眠していなくても低温に強いことが知られています。STM2系統から樹立したES細胞[4]を通常よりも低い温度で培養したところ、他の系統由来のES細胞と比べて、低温になってもミトコンドリア[5]を使った代謝を維持していることが分かりました。さらに、STM2マウスから摘出した肝臓を組織培養した場合も、同様の低温耐性が確認できました。
本研究は、科学雑誌『Cell Reports』オンライン版(8月17日付:日本時間8月18日)に掲載されました。
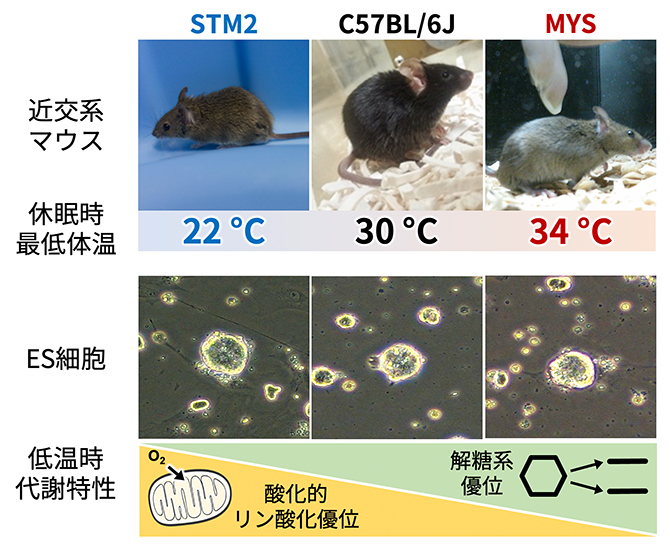
3系統のマウスの休眠時の低体温と、ES細胞の低温培養時の代謝特性の比較
背景
一部の哺乳類は、自ら代謝を低下させてエネルギー消費量を減らすことで、食料不足や寒冷な環境を生き延びようとする能力を持っています。このような能動的な低代謝状態を「休眠」と呼び、数カ月にわたる季節性の休眠を「冬眠」、数時間の休眠を「日内休眠」として区別します。
冬眠中の動物は、代謝の低下に伴い低体温の状態となりますが、組織・臓器や個体に障害(低温傷害)が起きることはありません。このような冬眠動物が示す低代謝状態の特徴は、臨床医学への応用において大きな可能性を秘めています。虚血性疾患[6]の治療や重症患者の輸送では、傷害により末梢組織への酸素や栄養の供給が絶たれることが患者の状態を悪化させる原因となっています。また、体内から取り出した組織・臓器をそのまま長期保存できない理由の一つは、組織の維持に必要な細胞の代謝を体外で確立する手立てがないからです。もし組織・個体を人工的に低代謝状態にし、少ないエネルギー消費量で細胞の活動を維持することができれば、これらの課題を解決できる可能性があります。
砂川チームリーダーらは、冬眠しないマウスを冬眠に近い状態に誘導できることを2020年に発表し、非冬眠動物であるヒトにも冬眠様状態を誘導できる可能性に道を開きました注1)。ヒトを安全に冬眠させるには、克服しなければならないさまざまな課題がありますが、その一つが低温傷害への対応です。冬眠動物には低体温による傷害が見られませんが、ヒトを含めた哺乳類は一般的に低温に弱いことが知られており、たとえヒトを人工的に冬眠状態にできても、低温による傷害が避けられないと考えられます。このため、ヒトの「人工冬眠」を実現するには、冬眠動物が持つ低温耐性を深く理解する必要があります。
興味深いことに、冬眠動物の組織は、冬眠状態ではなくても低温耐性があることが知られています。これは、冬眠を個体レベルで再現しなくても、試験管内の環境で細胞の低温耐性を研究できることを意味しています。しかし、リスなどの冬眠動物は研究対象として一般的ではないため、遺伝子改変技術が確立されておらず、個体の入手も困難です。低温耐性の研究を組織レベルで進めるために、低温耐性を持ち、実験に使用しやすい冬眠モデル動物が求められていました。
- 注1)2020年6月12日プレスリリース「冬眠様状態を誘導する新規神経回路の発見」
研究手法と成果
共同研究グループは、哺乳類のモデル動物として確立されているマウスが、日内休眠の一種である「飢餓性休眠」を呈することに注目しました。飢餓性休眠は、マウスを24時間の飢餓環境に置くと休眠状態になる現象です。マウスでは現在、100種類以上の近交系(ゲノム情報が同一の系統)が樹立されています。異なる近交系で異なる表現型が観察されれば、その表現型の違いは近交系ごとの遺伝子型の違いが原因である可能性があります。
そこで、複数の近交系マウスの飢餓性休眠を調べたところ、標準的な近交系であるC57BL/6J(以下B6Jマウス)系統と比べて、休眠時に代謝・体温がより低くなるSTM2マウスと、反対に体温が高くなるMYS/Mz(以下MYSマウス)を見つけました(図1)。飢餓性休眠に入ったSTM2マウスは体温がほぼ室温(20℃)と同程度になるまで下がるため、低体温に強い個体であると考えられます。
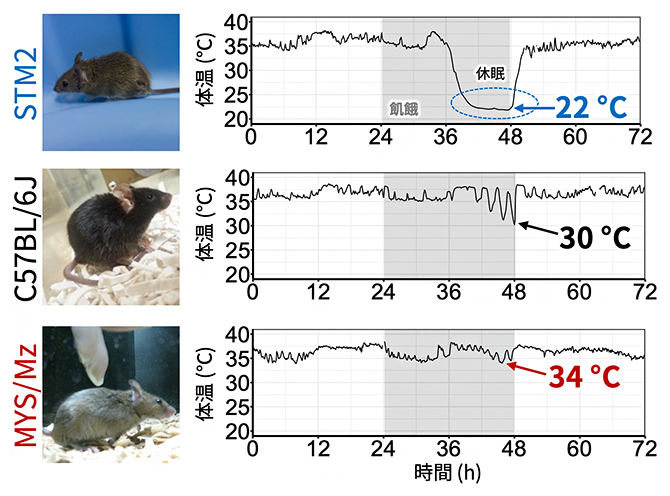
図1 近交系マウス間で異なる飢餓性休眠の表現型
3種類の近交系マウスに飢餓性休眠を誘導したときの体温変化。室温は20℃に設定している。いずれのマウスも、飢餓状態にしてから24時間以内に休眠が誘導されたが、STM2マウスのみがほぼ室温近く(22℃)まで体温を下げていた。
STM2マウスを他の近交系マウスと交配させ、低体温耐性に関連するゲノム領域を推定する手法を検討しましたが、STM2マウスは交配成功率や産仔数がB6Jマウスと比べて著しく低いため断念しました。そして、マウス個体ではなく、細胞を用いて系統間の低温耐性の違いを調べる実験を立案しました。まず、STM2、B6J、MYSの3系統のマウスからES細胞を樹立し、低温培養したときの代謝様式を調べました。
動物の細胞は、酸素を消費しながらミトコンドリアで行われる酸化的リン酸化[5]によりエネルギー(アデノシン三リン酸:ATP)を作り出します。しかし、酸素不足やミトコンドリアが機能しないときは、酸素を消費しない解糖系[7]という代謝経路を用いて、エネルギーを作り出します。ミトコンドリアでの酸化的リン酸化と解糖系のどちらを優位に活用しているかは、グルコース消費量に対する乳酸産生量を比較することで推定できます。
3系統由来のES細胞を37℃、34℃、31℃で培養して調べた結果、STM2マウス由来のES細胞では、31℃の低温培養においても、他の2系統と比べてグルコース消費量よりも乳酸産生量の方が少なくミトコンドリアで酸素を使いながらエネルギーを作り出していることが分かりました(図2)。
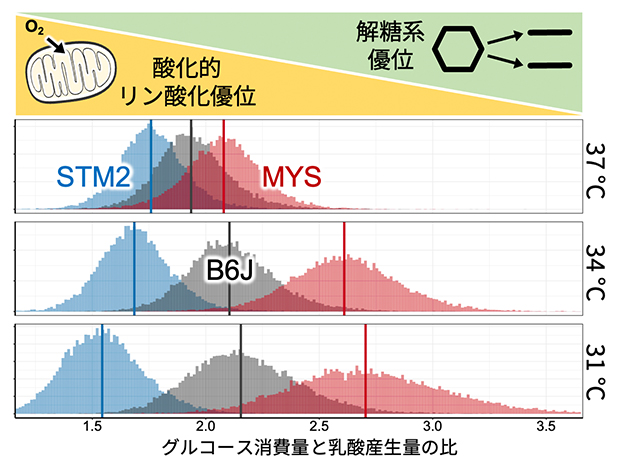
図2 グルコース消費量と乳酸産生量の比
3種類の近交系マウス由来のES細胞を、通常の培養温度である37℃、および低温培養の34℃と31℃で培養したときのグルコース消費量に対する乳酸産生量の比。横軸の数値が大きいほど、グルコース消費量よりも乳酸産生量の方が多く、解糖系が優位であることを示す。STM2マウス由来のES細胞(青)は、低温で培養しても酸化的リン酸化が優位な代謝を示すことから、低温においてもミトコンドリアの機能が維持されていると予想される。一方で、MYSマウス由来のES細胞(赤)は、低温時は解糖系が優位となる。灰色は標準的なB6Jマウス由来のES細胞。
次に、STM2マウス由来のES細胞のミトコンドリアがどのような代謝経路を用いているのかを詳細に調べました。その結果、STM2は他の2系統と比較して、31℃の培養温度において、電子伝達系複合体I(ETC-CI)[5]に依存しない酸素消費が多いことが確認されました(図3)。トランスクリプトーム解析[8]を行うと、STM2のES細胞は他の系統と比べて低温時にETC-CI関連の遺伝子発現が抑制されていることも分かり、STM2が低温時にミトコンドリアを使用し続ける理由として、ETC-CIを介さないエネルギー産生経路が働いていることが予想されました。
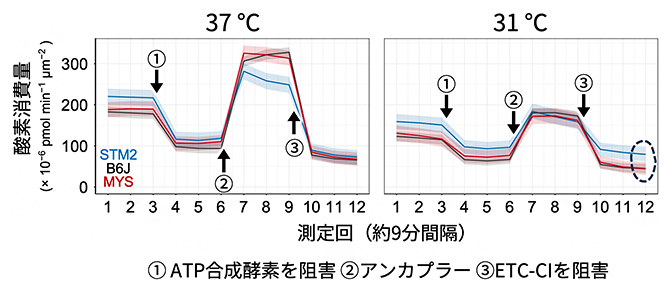
図3 ES細胞の代謝様式の培養温度による変化を検証
3種類の近交系マウス由来のES細胞に対して、37℃および31℃でのミトコンドリア機能の測定(ミトストレステスト)を行った結果。ミトコンドリアに負荷をかける三つの操作(①、②、③)をそれぞれ行った際の単位量・時間当たりの酸素消費量の変化を測定することで、その操作で阻害された代謝経路がミトコンドリア機能にどの程度寄与していたかを推定できる。31℃において③電子伝達系複合体I(ETC-CI)を阻害すると、STM2由来のES細胞の酸素消費量(青線)の落ち込みは、他の2系統(黒線・赤線)に比べて低いことが確認できた(右図破線で囲んだ部分)。これは、STM2ではETC-CI以外の代謝経路が低温培養で機能していることを示唆する。
最後に、ES細胞で観察された低温耐性が、個体を形作る分化した体細胞でも再現できるかを検証しました。具体的には、STM2、B6J、MYSの3系統のマウスから肝臓を採取し、切片にした肝臓を組織培養したときの代謝特性を評価しました。37℃で培養した切片においては、3系統ともグルコースを添加すると相対的に酸素消費量が低下しました(図4上段)。これは、グルコース添加により解糖系が優位となり、ミトコンドリアでの酸素呼吸が低下したことを示します。ところが、31℃においては、STM2マウスから採取した肝臓切片は、他の2系統と比べて、グルコースを添加しても酸素消費量は少ししか低下しませんでした(図4下段)。この結果から、STM2マウスの肝臓組織が、低温時は解糖系よりもミトコンドリアに依存した代謝を行っていることが示唆されました。
以上の結果から、STM2マウスの細胞は、低温でもミトコンドリアの酸素呼吸を維持できる特殊な代謝特性を獲得しており、これが細胞の低温耐性と、飢餓性休眠時の体温を低く保てる理由の一つであると考えられます。
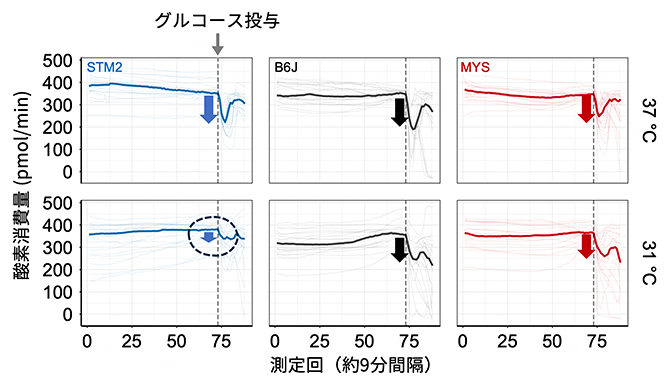
図4 培養温度で変化する肝臓切片の代謝様式
3種類の近交系マウスから肝臓を採取し、切片にして組織を培養した。通常の培養温度である37℃では、グルコース添加による酸素消費量の低下は似た傾向を示した(上段)。一方、31℃の低温培養では、STM2マウスの肝臓組織は、グルコース添加による酸素消費量の落ち込みは少なかった(下段左)。
今後の期待
マウス個体が示す低温耐性が細胞レベルでも確認されたことにより、個体レベルでの検証が困難であった冬眠動物の低温耐性のメカニズムを、さまざまな実験ツールが利用可能なマウスの培養細胞を用いて調べることが可能になりました。今後は、STM2マウスがなぜ低温時もミトコンドリアを利用することができるかを明らかにし、ヒトを含めた非冬眠動物に低温耐性を獲得させる手法の研究開発を進めていきます。
補足説明
- 1.休眠、冬眠、日内休眠
哺乳類は、37℃前後の体温を保つように代謝が制御される恒常性維持の仕組みを持つ。しかし一部の種は、冬季・飢餓などの危機的状況において自らの代謝を下げ、代謝が正常な状態では組織・臓器に障害が生じるはずの低温にまで、体温を低下させることができる。この制御された低代謝を休眠(torpor)と呼び、季節性の休眠を冬眠(hibernation)、24時間以内の休眠を日内休眠(daily torpor)と呼ぶ。休眠は多くの哺乳類に見られる現象であるが、休眠の低温耐性・低代謝耐性の原理は全く分かっていない。 - 2.低代謝状態
動物は安静状態(静止していて運動をしていない状態、睡眠時など)でも、体温維持、呼吸、心臓の動きなどのさまざまな生命活動を続けている。このような、生きていくために必要な最小のエネルギー消費(基礎代謝)が低下している状態を、本研究では低代謝状態と呼んでいる。 - 3.近交系
兄妹交配を20世代以上継続して維持している系統。理論上、系統内の全ての個体は同じ遺伝子組成を持つ。 - 4.ES細胞
胚性幹細胞。哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞。全ての種類の体細胞へ分化する能力と、試験管内での培養で無限に増える能力を併せ持つ。ESはembryonic stemの略。 - 5.ミトコンドリア、酸化的リン酸化、電子伝達系複合体I(ETC-CI)
ミトコンドリアは、真核細胞において酸素呼吸を担う細胞小器官。酸素分子の還元によるエネルギーを利用したATP(アデノシン三リン酸)生産過程である、酸化的リン酸化の場となる。酸素分子の還元は、ミトコンドリア内膜に埋め込まれた複数の酸化還元酵素(電子伝達系複合体)により、膜内外の水素イオン濃度勾配を作り出す連続反応の結果であり、電子伝達系複合体I(ETC-CI)がこの最初の反応を担う。ETC-CIはelectron transport chain complex Iの略。 - 6.虚血性疾患
血栓や出血などにより血液の循環が滞り、臓器への血液供給が途絶えることが原因で生じる疾患。 - 7.解糖系
生物の体内にある糖の代謝経路。グルコースをピルビン酸や乳酸などに分解し、細胞のエネルギー源となるATPを産生する多段階の化学反応で、細胞質で進行する。 - 8.トランスクリプトーム解析
生体分子や細胞の挙動などの生体活動に関わる網羅的な情報をオミックスと呼ぶ。オミックス研究の一つの手法であるトランスクリプトーム解析は、一つのゲノム、または特定の細胞・組織・器官で発現する全ての遺伝子の転写産物(RNA)を網羅的に調べる方法。
共同研究グループ
理化学研究所 生命機能科学研究センター
冬眠生物学研究チーム
研修生 吹田 晃享(スイタ・コウキョウ)
(岡山大学大学院 医歯薬学総合研究科 麻酔・蘇生学教室 博士課程4年)
テクニカルスタッフⅡ 石川 清美(イシカワ・キヨミ)
テクニカルスタッフⅡ 綿木 彩賀(ワタキ・アヤカ)
チームリーダー 砂川 玄志郎(スナガワ・ゲンシロウ)
生体モデル開発チーム
テクニカルスタッフⅠ 金子 麻里(カネコ・マリ)
チームリーダー 清成 寛(キヨナリ・ヒロシ)
網膜再生医療研究開発プロジェクト(研究当時)
プロジェクトリーダー(研究当時)髙橋 政代(タカハシ・マサヨ)
(現 科技ハブ産連本部 バトンゾーン研究推進プログラム 眼科領域遺伝子細胞治療研究チーム 客員研究員)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究センタープロジェクト「休眠プロジェクト(研究代表者:砂川玄志郎)」)、日本学術振興会(JSPS)新学術領域研究『温度生物学』公募研究「近交系マウスを用いた低体温メカニズムの解明」(18H04706、研究代表者:砂川玄志郎)、同基盤研究(A)「哺乳類の低代謝機構を応用した革新的組織保存法の開発」(19H01066、研究代表者:髙橋政代、研究分担者:砂川玄志郎)、同学術変革領域研究(B)冬眠生物学~哺乳類の低代謝・低体温による生存戦略「能動的低代謝の分子機構:冬眠様低代謝の誘導による休眠省エネ機構の解明」(20H05767、研究代表者:砂川玄志郎)による助成を受けて行われました。
原論文情報
- Koukyou Suita, Kiyomi Ishikawa, Mari Kaneko, Ayaka Wataki, Masayo Takahashi, Hiroshi Kiyonari, Genshiro A. Sunagawa, "Mouse embryonic stem cells embody organismal level cold resistance", Cell Reports, 10.1016/j.celrep.2023.112954
発表者
理化学研究所
生命機能科学研究センター 冬眠生物学研究チーム
チームリーダー 砂川 玄志郎(スナガワ・ゲンシロウ)
研修生 吹田 晃享(スイタ・コウキョウ)
(岡山大学大学院 医歯薬学総合研究科 麻酔・蘇生学教室 博士課程4年)
 吹田 晃享
吹田 晃享
 砂川 玄志郎
砂川 玄志郎
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
岡山大学 総務・企画部 広報課
Tel: 086-251-7292
Email: www-adm [at] adm.okayama-u.ac.jp
※[at]は@に置き換えてください。
