2023年11月1日
理化学研究所
京都大学
慶應義塾大学先端生命科学研究所
科学技術振興機構(JST)
新規ミトコンドリア膜貫通ペプチドによる遺伝子送達
-ミトコンドリア内部で効率的な多重遺伝子発現を達成-
理化学研究所(理研)環境資源科学研究センター バイオ高分子研究チームの沼田 圭司 チームリーダー(京都大学大学院 工学系研究科 教授、慶應義塾大学 先端生命科学研究所 特任教授)、吉永 直人 基礎科学特別研究員(慶應義塾大学先端生命科学研究所 特任助教)らの共同研究グループは、ミトコンドリア[1]膜タンパク質から着想を得た機能性ペプチド[2]とプラスミドDNA(pDNA)[3]からなる複合体が、細胞内のミトコンドリアに選択的に集積し、その内部で遺伝子発現が高効率に行われることを発見しました。
本研究成果は、ミトコンドリアにおけるあらゆるタンパク質発現を可能にし、ミトコンドリア病[4]の治療やメカニズム解明に貢献するとともに、ミトコンドリアDNA(mtDNA)編集技術への応用が期待されます。
今回、共同研究グループは、ミトコンドリア膜貫通タンパク質(mitoNEET)の一部の配列を含む機能性ペプチド(mitoNEET-(RH)9)と外来遺伝子を含むプラスミドDNA(pDNA)またはミトコンドリアDNA(mtDNA)からなるミトコンドリア標的複合体を細胞に投与すると、ミトコンドリアに選択的に集積することを見いだしました。複合体として送達されたmtDNAは、mtDNA欠損細胞のミトコンドリア機能回復に十分な遺伝子発現を行うことが明らかとなりました。
本研究は、科学雑誌『Advanced Functional Materials』オンライン版(11月1日付:日本時間11月1日)に掲載されました。
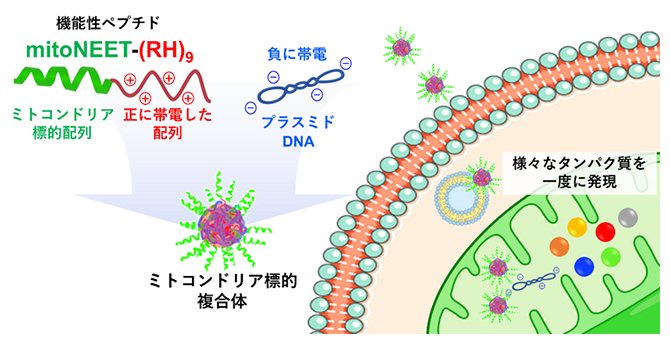
機能性ペプチドとプラスミドDNAからなる複合体によるミトコンドリアへの遺伝子輸送
背景
ミトコンドリアは、細胞のエネルギー産生を担う重要な細胞小器官[5]です。最も特異的な点として独自の遺伝子(mtDNA)を持つことが挙げられます。mtDNAは、13の遺伝子をコードしており、ミトコンドリア機能を支えています。しかし、mtDNAは核に含まれるゲノムDNAと比較して変異(遺伝子変異)[6]が生じやすく、変異が蓄積していくとともにミトコンドリア機能も低下していき、最終的にはミトコンドリア病を発症します。低下したミトコンドリア機能を改善するためには、正常なタンパク質をコードしているmtDNAを外部から供給し、ミトコンドリア内でmtDNAにコードされている13のタンパク質の全てを同時に発現する必要があります。
従来、ミトコンドリア機能を改善させるために、ウイルスベクター[7]にミトコンドリア標的ペプチドを導入したシステムなどが開発されてきました。しかし、これらの手法では送達するDNAの長さに制限があり、一つまたは少数のタンパク質しか発現できませんでした。一方、ペプチドなどの正に帯電した高分子と負に帯電したpDNAまたはmtDNAとの間に働く静電相互作用を駆動力として形成される複合体では、送達するDNAの長さに制限はありません。この静電相互作用を利用した複合体を用いれば、mtDNAそのものをミトコンドリア内部に供給することが期待できます。
これまで、沼田チームリーダーらは機能性ペプチドを利用したミトコンドリア標的遺伝子送達手法を開発してきました。しかしながら、ミトコンドリアにおける蛍光タンパク質の発現は達成されていたものの、ミトコンドリア機能を改善させるほど効率的に遺伝子を発現させることはできませんでした。
研究手法と成果
共同研究グループは、ミトコンドリア膜貫通タンパク質であるmitoNEETのミトコンドリア移行シグナル[8]と、細胞膜を透過する性質とDNAを濃縮する能力とを併せ持つ(RH)9を融合した機能性ペプチドmitoNEET-(RH)9を新たに開発しました。開発したmitoNEET-(RH)9はpDNAと複合体を形成することを確認しました。次にこの複合体を培養細胞に投与し、ミトコンドリアへの遺伝子送達を試みました。共焦点顕微鏡[9]による蛍光観察を行った結果、この複合体はミトコンドリアに選択的に集積することが明らかとなりました(図1A)。ミトコンドリアへ輸送されたpDNAの一部は、ミトコンドリアマトリックス[10]に存在するタンパク質と共に偏在していることが分かり、ミトコンドリア内部まで到達していることも確認できました(図1B)。さらに、輸送したpDNAからタンパク質が発現されるかどうか評価しました。共焦点顕微鏡による蛍光観察を行った結果、発現した緑色蛍光タンパク質(GFP)の蛍光もミトコンドリアにおいて確認することができました(図1C)。
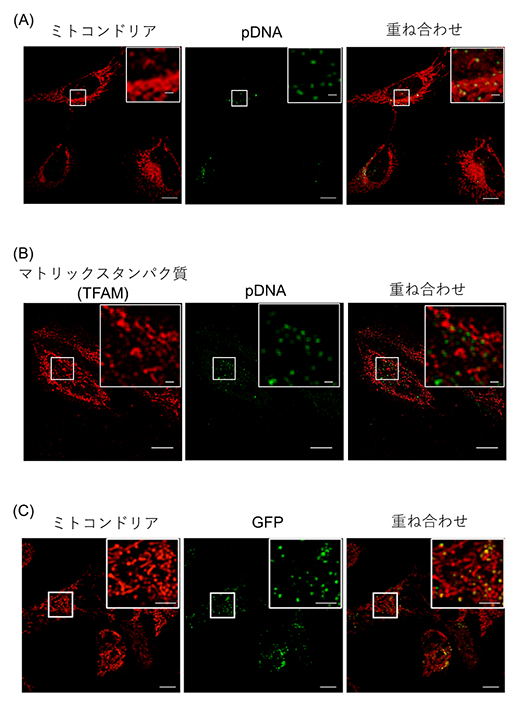
図1 mitoNEET-(RH)9/pDNA複合体によるミトコンドリアへの遺伝子導入
- A:複合体を形成している蛍光色素が結合したpDNA(緑色)とミトコンドリア(赤色)を染色する色素からの蛍光が同じ場所から検出され、複合体がミトコンドリアへ輸送されたことを確認した。
- B:複合体を形成している蛍光色素が結合したpDNA(緑色)と蛍光色素で染色したミトコンドリアマトリックスに存在するタンパク質(TFAM)(赤色)が同じ場所から検出され、複合体がミトコンドリア内部まで輸送されたことを確認した。
- C:ミトコンドリアへ輸送したpDNAから発現した緑色蛍光タンパク質(GFP)に由来する蛍光(緑色) がミトコンドリア(赤色)を染色する色素からの蛍光と同じ場所から検出された。
ミトコンドリア機能回復のモデル実験として、mitoNEET-(RH)9とmtDNAとの複合体を形成し、mtDNA欠損細胞に外部からmtDNAを供給することを試みました。この複合体は、共焦点顕微鏡による観察からmtDNA欠損細胞においてもミトコンドリアに集積することが分かりました。また、mtDNAにコードされているタンパク質の一つであるND1を緑色蛍光タンパク質で染色したところ、複合体を投与した細胞においてのみ緑色が観察され、mtDNAからのタンパク質(ND1)の発現が確認されました(図2A)。さらに、mtDNAの供給により、mtDNA欠損細胞におけるミトコンドリア機能の回復を達成しました。特に、ミトコンドリアでのエネルギー産生に必要な最初の反応を担うミトコンドリア呼吸鎖複合体Ⅰ[11]の機能が大幅に改善されていることを確認しました(図2B)。
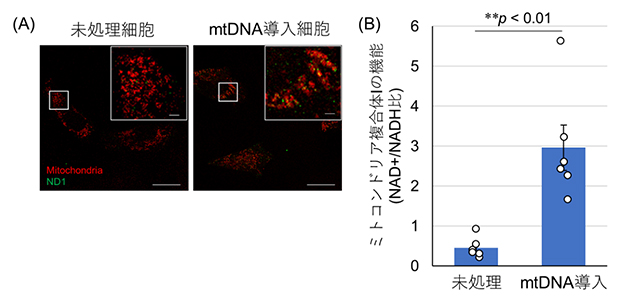
図2 mtDNA欠損細胞への細胞外部からのmtDNA導入
- A:mitoNEET-(RH)9/mtDNA複合体により導入されたmtDNAから発現したタンパク質(ND1)を緑色蛍光タンパク質(GFP)で染色した。複合体未処理の細胞ではGFP蛍光(緑色)が観察されないが、複合体を投与した細胞では緑色が観察され、mtDNAからのタンパク質発現が確認された。
- B:mitoNEET-(RH)9/mtDNA複合体を投与した細胞のミトコンドリア機能は未処理の細胞と比較して有意に改善された。
今後の期待
本研究では、新規ミトコンドリア膜貫通配列を含む機能性ペプチドを設計し、高効率なミトコンドリア標的遺伝子送達システムの開発に成功しました。今後、ペプチド配列の最適化など、ミトコンドリア集積効率が向上するように材料設計を最適化する必要がありますが、本送達システムを利用することで、さまざまなタンパク質を発現する遺伝子をミトコンドリアへ特異的に導入することが可能となり、ミトコンドリア機能回復、ミトコンドリア病を含む機能低下の原因究明への貢献が期待されます。また、機能性タンパク質を発現させることで、新たな機能を持ったミトコンドリアの作製も期待できます。
今回の結果は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)[12]」のうち、「3.すべての人に健康と福祉を」に貢献するものです。
本研究で開発した機能性ペプチドmitoNEET-(RH)9は、株式会社ペプチド研究所(大阪府)から販売される予定です。
補足説明
- 1.ミトコンドリア
ほとんどの真核生物の細胞中に存在する細胞小器官のこと。脂質からできている外膜・内膜で形成されており、生物が呼吸するのに必要となるエネルギーを生産する役割を持つ。独自のDNAであるミトコンドリアDNA(mtDNA)から発現するタンパク質がエネルギー産生に必須である。 - 2.機能性ペプチド
アミノ酸の配列を適切に設計することで、細胞内への物質輸送に必要なさまざまな機能を持たせたペプチド。例えば、細胞膜を透過して細胞取り込み効率を向上させる細胞膜透過性ペプチドや、ミトコンドリアに選択的に移行するミトコンドリア標的ペプチドなどがある。 - 3.プラスミドDNA(pDNA)
小さな環状の二本鎖DNA分子であり、人工的に作製されたプラスミドDNAは必要遺伝子を細胞に供給する運び屋として利用される。 - 4.ミトコンドリア病
ミトコンドリア機能の低下により発症する病気の総称。mtDNAやゲノムDNA(またはその両方)における遺伝子変異が原因とされる。ミトコンドリア病の根本的な治療法はなく、難病に指定されている。 - 5.細胞小器官
真核細胞内で特化した機能や形態を持つ、膜で区切られた器官の総称。本研究で標的としているミトコンドリアのほか、核やゴルジ体などが含まれる。 - 6.変異(遺伝子変異)
遺伝子変異とは、遺伝子を構成するDNAの塩基配列の変換・欠損などの変化を意味する。遺伝子変異により、正常なタンパク質が発現せず、疾患原因となることがある。mtDNAでは核に含まれる遺伝子よりも変異が生じやすいことが知られている。 - 7.ウイルスベクター
天然に存在するウイルスから病原性をなくしたものであり、DNAなどの核酸送達に使用される。一般的に高い細胞導入効率を示すが、送達できるDNAの長さに上限が存在する。 - 8.ミトコンドリア移行シグナル
細胞内でミトコンドリアへの移行をつかさどるシグナル。ミトコンドリアで働くため、細胞質内で作られたタンパク質がミトコンドリアに移行するために持つアミノ酸配列のこと。 - 9.共焦点顕微鏡
細胞のように厚みのある試料を観察する際に、特定の場所に焦点を絞って観察できる顕微鏡のこと。細胞内からの蛍光を広範囲にイメージングすることで、細胞の中で起こるさまざまな現象を観察できる。 - 10.ミトコンドリアマトリックス
ミトコンドリア内膜の内側に存在する空間の総称。ミトコンドリアマトリックスにおいてDNAからタンパク質の発現が行われる。 - 11.ミトコンドリア呼吸鎖複合体Ⅰ
ミトコンドリア呼吸鎖複合体とは、ミトコンドリア内膜上に存在し、エネルギー産生に係るタンパク質複合体。ミトコンドリア呼吸鎖複合体ⅠからⅣで連鎖的な反応を行い、エネルギー産生に寄与する。 - 12.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組む普遍的なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。SDGsはSustainable Development Goalsの略。
共同研究グループ
理化学研究所 環境資源科学研究センター
バイオ高分子研究チーム
チームリーダー 沼田 圭司(ヌマタ・ケイジ)
(京都大学 大学院工学系研究科 教授、慶應義塾大学先端生命科学研究所 特任教授)
基礎科学特別研究員 吉永 直人(ヨシナガ・ナオト)
(慶應義塾大学先端生命科学研究所 特任助教)
研究員 宮本 昂明(ミヤモト・タカアキ)
研究員 小田原 真樹(オダハラ・マサキ)
質量分析・顕微鏡解析ユニット
上級技師 豊岡 公徳(トヨオカ・キミノリ)
テクニカルスタッフⅡ 武田 紀子(タケダ・ノリコ)
ケミカルゲノミクス研究グループ
グループディレクター 吉田 稔(ヨシダ・ミノル)
(東京大学 大学院農学系研究科 教授)
専任研究員 凌 楓(リン・フォン)
テクニカルスタッフⅠ 西村 はる菜(ニシムラ・ハルナ)
立教大学 大学院理学系研究科
教授 末次 正幸(スエツグ・マサユキ)
大学院生(研究当時)奈良 聖亜(ナラ・セイア)
研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業個人型研究(さきがけ)「ミトコンドリアDNA変異から生じる老化プロセスの解明(研究代表者:吉永直人、JPMJPR228A)」、同戦略的創造研究推進事業チーム型研究(CREST)「人工ゲノムのセルフリーOn chip合成とその起動(研究代表者:末次正幸、JPMJCR18S6)」、同戦略的創造研究推進事業総括実施型研究ERATO「沼田オルガネラ反応クラスタープロジェクト(研究総括:沼田圭司、JPMJER1602)」、文部科学省データ創出・活用型マテリアル研究開発プロジェクト事業「バイオ・高分子ビッグデータ駆動による完全循環型バイオアダプティブ材料の創出(研究総括:沼田圭司)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(S)「化学遺伝学と情報科学による内在性代謝物の隠された機能の解明(研究代表者:吉田稔)」「いつ、どこで、どのように、核酸の高次構造は形成し機能するのかを予測する(研究代表者:杉本直己)」、同若手研究「ゲノム編集ツールフリーのミトコンドリアDNA編集技術の開発(研究代表者:吉永直人)」、同研究活動スタート支援「iPS細胞のミトコンドリアゲノムを初期化するミトコンドリア標的ナノ粒子の開発(研究代表者:吉永直人)」による助成、および理化学研究所脳神経科学研究センター生体物質分析支援ユニットの支援を受けて行われました。
本研究には理研バイオリソース研究センターから提供されたバイオリソースが使用されました。(リソースNo.RBRC10451、RBRC10858、RBRC10919、RBRC10921、RBRC09807、RBRC01345、RBRC10606、RBRC10170、RBRC04738、RBRC05798)
原論文情報
- Naoto Yoshinaga, Takaaki Miyamoto, Masaki Odahara, Noriko Takeda-Kamiya, Kiminori Toyooka, Seia Nara, Haruna Nishimura, Feng Ling, Masayuki Su'etsugu, Minoru Yoshida, and Keiji Numata, "Design of an artificial peptide inspired by transmembrane mitochondrial protein for escorting exogenous DNA into the mitochondria to restore their functions by simultaneous multiple gene expression", Advanced Functional Materials, 10.1002/adfm.202306070
発表者
理化学研究所
環境資源科学研究センター バイオ高分子研究チーム
チームリーダー 沼田 圭司(ヌマタ・ケイジ)
(京都大学 大学院工学系研究科 教授、慶應義塾大学先端生命科学研究所 特任教授)
基礎科学特別研究員 吉永 直人(ヨシナガ・ナオト)
(慶應義塾大学先端生命科学研究所 特任助教)
 吉永 直人
吉永 直人
JST事業に関すること
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
保田 睦子(ヤスダ・ムツコ)
Tel: 03-3512-3524 / Fax: 03-3222-2064
Email: prest [at] jst.go.jp
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
京都大学 渉外部広報課国際広報室
Tel: 075-753-5729 / Fax: 075-753-2094
Email: comms [at] mail2.adm.kyoto-u.ac.jp
慶應義塾大学先端生命科学研究所 渉外担当 塩澤
Tel: 0235-29-0802
Email: pr [at] iab.keio.ac.jp
科学技術振興機構 広報課
Tel: 03-5214-8404 / Fax: 03-5214-8432
Email: jstkoho [at] jst.go.jp
※上記の[at]は@に置き換えてください。
