理化学研究所(理研)生命医科学研究センター がんゲノム研究チームの大川 裕紀 研修生(研究当時)、笹川 翔太 研究員、中川 英刀 チームリーダー、近畿大学医学部 外科学教室 上部消化管部門の安田 卓司 主任教授らの共同研究グループは、女性で非喫煙者の食道がん(SCC)の全ゲノムおよび単細胞RNA解析を行い、免疫細胞[1]の一種である好酸球がSCCの発症と関連していることを発見しました。
本研究成果は女性食道がんの予防や治療法の開発に貢献すると期待されます。
今回、共同研究グループは、まれではあるが最近増加傾向にある女性非喫煙者の食道扁平上皮がんを対象とし、20例のがん組織の全ゲノムRNAシークエンス解析[2]を行い、その変異シグニチャー[3]を一般的な男性喫煙者の食道がんのデータ(74例)と比較しました。その結果、原因変異遺伝子については差異がないものの、加齢と関連する変異シグニチャーが多い傾向にありました。腫瘍内の免疫細胞の活動性を調べると、女性食道がん組織内には、活動性の高い免疫細胞が観察され、特に好酸球[1]が多く検出されました。男女計4例の食道がん組織から免疫細胞を抽出し、その内約31,000個の単細胞(シングルセル)RNA解析[4]を行うと、女性食道がんにおいては好酸球が活性化していました。
好酸球を多く含む食道がんの予後は、一般的な男性喫煙者の食道がんに比べて良好であり、好酸球などの免疫細胞の作用が関係していると考えられます。
本研究は、医学系雑誌『Cancer Letters』オンライン版(11月30日付)に掲載されました。
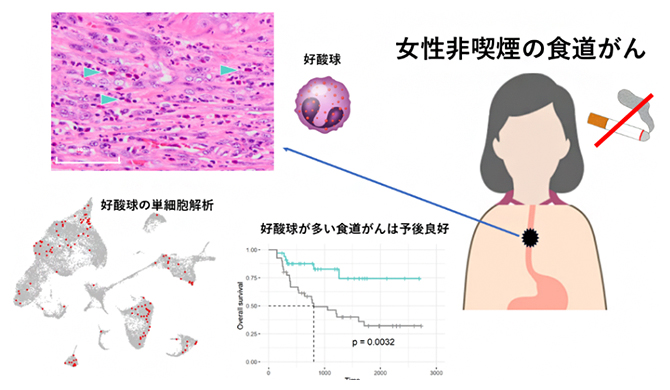
女性非喫煙者の食道がんの特徴
背景
食道がんは、日本では年間に約26,000人が発症し、約11,000人が死亡、5年相対生存率は30~40%の難治性がんです注1)。病理学的には、扁平上皮がん(SCC)と腺がんに分類されます。日本を含むアジアでは、ほとんどが食道SCCであり、発生の最大のリスク要因は、喫煙や飲酒です。食道SCCの男女別の発症の割合は6対1で多くが男性であり、非喫煙の女性の割合は5~10%とわずかです。しかしながら、最近、非喫煙、非飲酒の女性SCCの罹患者数が増えている傾向があり、臨床的特徴や発がん要因の解明が求められています。
日本における食道SCCの標準治療は、化学療法の後に切除手術を行う「術前化学療法+手術」です。しかし、最近、食道がんにおける腫瘍免疫[5]の重要性や免疫チェックポイント阻害剤[5]といった免疫療法の効果も報告されており、肺がんと同様に免疫療法が主たる治療法になる可能性があります。
免疫反応や免疫に関連する疾患発症に関しては、以前より性ホルモンの影響やX染色体が関連して男女差があることが分かっており、多くの自己免疫疾患の発症は女性が多いことが知られています。がんについても、食道がんを含むいくつかのがん腫の発症で大きな男女差があり、それらの予後や治療反応性も異なることが多いと分かっています。
これまでの共同研究グループが行った食道がんのゲノム解析や免疫解析でも、好中球やT細胞の重要性を報告しており注2)、腫瘍免疫の役割が注目されています。本研究では、リスク要因が不明ですが、まれな女性非喫煙者の食道SCCのゲノム解析、免疫解析を行い、その分子学的、免疫学的特徴を明らかにすることを試みました。
- 注1)国立がん研究センターがん情報サービス 食道
- 注2)2022年8月9日プレスリリース「ゲノムとAIにより食道がんの術前化学療法の効果を予測」
研究手法と成果
今回、共同研究グループは、主に近畿大学病院にて治療をした20例の女性非喫煙者の食道扁平上皮がん(NSF-EC)腫瘍組織のDNA/RNAについて、全ゲノムシークエンス解析[2]、またはRNAシークエンス解析を行い、一般的な男性喫煙者の食道扁平上皮がん症例(S-EC)のデータ(74例)と比較しました。臨床的背景について、NSF-ECは、S-ECと比べて発症年齢は高く(NSF-EC平均年齢71歳、S-EC 63歳)、飲酒習慣は少なく(NSF-ECの飲酒習慣率18%、S-EC 95%)、がんのステージに差はないものの、予後良好の傾向がありました(図1A)。
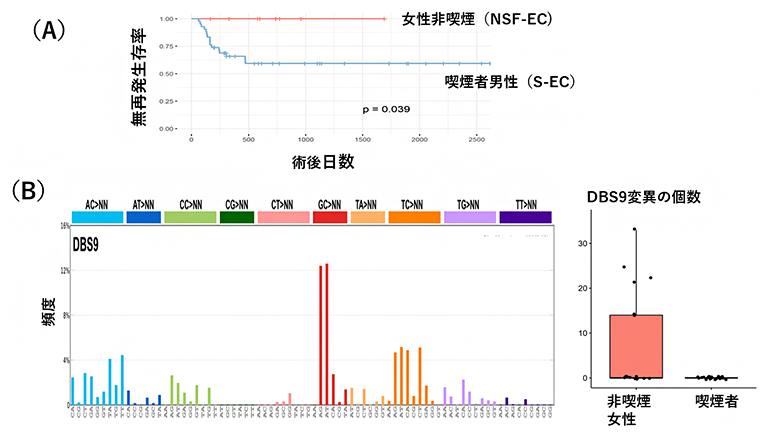
図1 女性非喫煙者の食道がん(NSF-EC)の特徴
- (A)術後の無再発生存率を見ると、女性非喫煙者の食道がんは予後良好であることが分かる。
- (B)女性非喫煙者食道がんの全ゲノム解析の結果、変異シグニチャーと考えられるDBS9が多く見つかった。2塩基置換のDBS9はGC>NN(GCの置換)やTC>NNが多い特徴がある。
全ゲノム解析の結果、原因変異遺伝子について、79.5%でTP53に変異が見られたのを筆頭に、CDKN2A(51.3%)、FGF3(41%)、CCND1(35.9%)、NFE2L2(15.4%)などの遺伝子に変異およびコピー数異常が観察されましたが、男女の両群に差異はありませんでした。しかし、ゲノム全体での変異パターン・シグニチャーについては、DBS[3]9が女性非喫煙者に特異的に検出されました(図1B)。DBS9の意義はまだ不明です。ただ、加齢と関連する他の変異シグニチャーと相関するため、DBS9は加齢と関連する変異シグニチャーと見られ、女性非喫煙者の食道がんの発生には加齢が強く関与していると考えられます。
次に、腫瘍組織のRNA発現データから腫瘍内の免疫細胞の活動性を調べると、女性非喫煙者の食道がん組織内には、活動性の高い免疫細胞が観察されました(図2A)。さまざまな免疫細胞が腫瘍内には存在していますが、女性非喫煙者の食道がんでは、特に好酸球が多く観察されました。この現象は、病理解析でも確認され、NSF-ECは好酸球細胞の浸潤が多く認められます(図2B)。女性で非喫煙者の食道がんまたは好酸球を多く含む食道SCCの予後は、一般的な男性喫煙者の食道SCCに比べて良好であり(図2C)、好酸球などの免疫細胞の作用が関係していると考えられます。
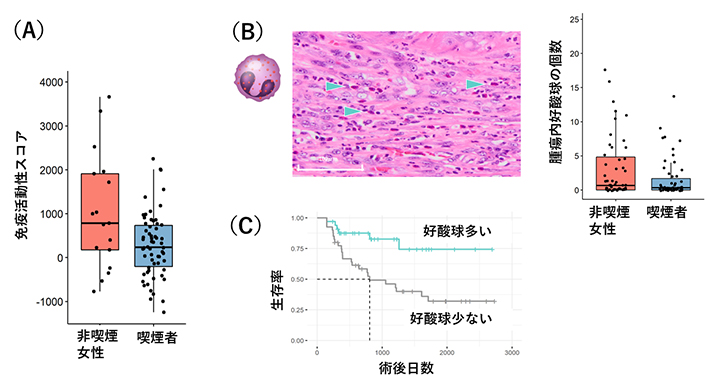
図2 食道SCC内の免疫細胞の活動性
- (A)RNA発現データからの免疫活動性スコア。女性非喫煙者の腫瘍内の免疫活動が男性喫煙者と比べ高いことが分かる。
- (B)
- 左)病理標本で好酸球(青の矢印)を検出。
- 右)男性喫煙者と比べ、女性非喫煙者の食道がんには多くの好酸球が同定された。
- (C)好酸球が多い食道がん患者は術後の予後が良好である。
好酸球と腫瘍との関連や好酸球の発がん意義についての報告はほとんどなく、本研究成果は食道がんと好酸球との関連についての初めての報告です。最後に、4例の食道SCC組織(女性1例、男性3例)より免疫細胞を抽出し、約31,000個の免疫細胞の単細胞RNA解析を行い、腫瘍内の好酸球細胞の発現プロファイルを作成しました。1例の女性食道がんでは126個、3例の男性食道がんでは464個の好酸球細胞の遺伝子発現データの取得に成功し、男女間で好酸球の活動性を比較検討しました。その結果、女性食道がんの好酸球は免疫的に活性化しており、性ホルモン経路[6]の反応性が低く、PI3K(ホスファチジルイノシトール3-キナーゼ)経路[7]が活性化しており、女性と男性の腫瘍内好酸球の働きや活動性が異なることを示しています(図3)。
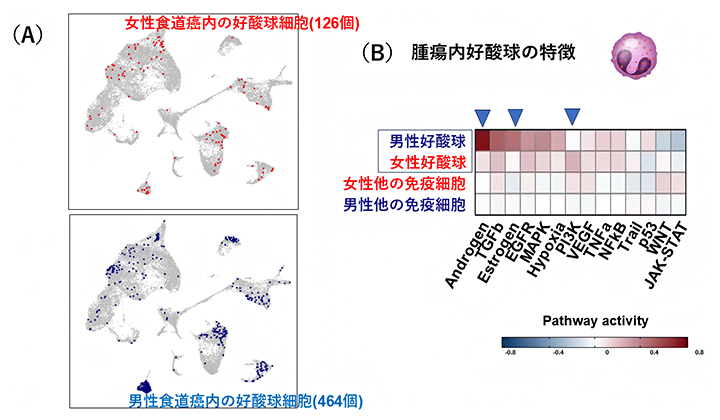
図3 食道がん組織内の免疫細胞の単細胞RNA解析
- (A)食道がん組織内の好酸球を同定した(女性126個=赤い点、男性464個=青い点)。
- (B)女性食道がんにおいては、性ホルモンの反応性が低いが、PI3Kが活性化している。
今後の期待
日本の食道扁平上皮がんは、男性喫煙者が圧倒的に多いがん腫です。しかしながら、最近、女性非喫煙者の食道扁平上皮がんが増える傾向にあり、その発がん要因や分子学的機序は不明でした。
本研究成果により女性食道がんは免疫学的に活動性の高いがんであることが分かり、予後を規定している可能性を示唆しています。このことから、PD-1阻害薬などの免疫チェックポイント阻害薬の効果が期待できます。また、腫瘍内で好酸球という特定の免疫細胞の活性化が確認されたため、好酸球を標的とした新たな免疫療法の開発につながると期待できます。
補足説明
- 1.免疫細胞、好酸球
免疫に関わる白血球は、B細胞、T細胞、マクロファージ、好中球、好酸球、好塩基球などの免疫細胞に分類される。B細胞は、異物に対する抗体を産出する。T細胞のうち、CD8+T細胞は腫瘍や感染細胞に直接的に作用する(細胞障害性T細胞)。CD4+T細胞はマクロファージなどから抗原提示を受けると増殖、活性化して、炎症を促すサイトカインを産出し、他の免疫細胞を活性化させる(ヘルパーT細胞)。好酸球は、白血球の約1%を占める顆粒(かりゅう)球であり、寄生虫感染や好酸球性胃腸炎、副鼻腔炎などのアレルギー性疾患との関連が報告されており、強い貪食(どんしょく)能力を持ち、病原体を捕食する。 - 2.RNAシークエンス解析、全ゲノムシークエンス解析
個人やがん細胞の全ゲノム情報を解読し、塩基配列の違いや変化を同定することを全ゲノムシークエンス解析という。がん細胞の場合は、がんのDNAと同一患者由来の正常DNAの全ゲノムシーケンス解析を行い、その差分を調べる。RNAも、cDNA(相補的DNA)に変換した後に、RNAのほぼ全長にわたってシークエンス解析ができる。RNAシークエンス解析によって、遺伝子の発現の有無などを調べることができる。 - 3.変異シグニチャー、DBS
がん細胞に発生するさまざまな変異は、その要因によって異なるパターンを示す。そのパターンを変異シグニチャーと呼ぶ。がん細胞の変異の一種である塩基置換は、DNAを構成する核酸塩基(A、T、C、G)の化学反応によって起こる。塩基置換のパターンや数は、DNAと反応する遺伝子毒性を持つ発がん物質の暴露と、変異を修復するための細胞内機構の適切な働きの有無によって決定される。喫煙が原因で発症した肺がんや紫外線が原因で発症した悪性黒色腫における塩基置換は、他のがんに比べて10倍以上多く、CがTに置き換わる(その相補としてGがAに置き換わる)パターンが非常に多くなる。現在、国際的には、100個以上のシグニチャーが定義されており、SBS(single base substitution:1塩基置換のパターン)、DBS(double base substitution:2塩基置換のパターン、ID(indel:短い欠失挿入)のパターン)とさらに細分化されている。 - 4.単細胞(シングルセル)RNA解析
1細胞ごとのRNA発現を網羅的に検出する解析方法。各細胞に特徴的な遺伝子発現プロファイルをもとに細胞集団を分類し、亜集団に特徴的な発現情報を取得することが可能である。通常のがん組織の(集団の平均値を計測する)RNAシークエンス解析では、大多数のがん細胞の発現情報に埋もれて検出が困難な免疫細胞や希少細胞の発現変化も検出可能である。 - 5.腫瘍免疫、免疫チェックポイント阻害剤
腫瘍が生体内で異物として認識され、それを排除するように免疫細胞が反応することを腫瘍免疫という。この仕組みを生かし、がんを攻撃する免疫細胞を活性化させることによってがんの治療を試みる治療法を免疫療法という。免疫チェックポイント阻害剤は、免疫のチェックポイントであるPD-1/PD-L1分子を抗体で抑制することで、腫瘍細胞への免疫抑制を解除し、免疫細胞が腫瘍細胞を排除できるように導く薬剤。 - 6.性ホルモン経路
女性ホルモン(エストロゲン)や男性ホルモン(アンドロゲン)は、細胞の細胞質内受容体に結合すると、その複合体は核内移行し、ホルモン応答領域を有する遺伝子の転写制御を行い、特定の遺伝子の発現を増加・減少させる。これによって、男性や女性特異的な細胞の活動が制御されている。 - 7.PI3K(ホスファチジルイノシトール3-キナーゼ)経路
PI3K/AKT/mTOR経路は細胞内シグナル伝達経路で、細胞の増殖やアポトーシス、分化、血管新生、糖代謝など数多くの生物学的プロセスに関与している。この経路の調節不全が、自己免疫疾患、がん、代謝性疾患などの発症と関連付けられている。
共同研究グループ
理化学研究所 生命医科学研究センター がんゲノム研究チーム
研修生(研究当時)大川 裕紀(オオカワ・ユウキ)
研究員 笹川 翔太(ササガワ・ショウタ)
研究員 ジョンソン・トッド(Johnson Todd)
チームリーダー 中川 英刀(ナカガワ・ヒデワキ)
近畿大学医学部 外科学教室 上部消化管部門
主任教授 安田 卓司(ヤスダ・タクシ)
講師 加藤 寛章(カトウ・ヒロアキ)
東京大学医学部附属病院 免疫細胞治療学講座
特任教授 垣見 和宏(カキミ・カズヒロ)
特任准教授 長岡 孝治(ナガオカ・コウジ)
特任助教 小林 由香利(コバヤシ・ユカリ)
杏林大学医学部 病理学教室
准教授 林 玲匡(ハヤシ・アキマサ)
岩手医科大学付属病院 臨床腫瘍科
特任教授 岩谷 岳(イワヤ・タケシ)
研究支援
本研究は、日本医療研究開発機構(AMED)次世代がん医療創生研究事業「がんゲノム解析による新規免疫療法および複合免疫療法開発のためのシーズ探索(研究代表者:中川英刀)」による支援を受けて行われました。
原論文情報
- Yuki Okawa†, Shota Sasagawa†(equally contributing), Hiroaki Kato, Todd A. Johnson, Koji Nagaoka, Yukari Kobayashi, Akimasa Hayashi, Takahiro Shibayama, Kazuhiro Maejima, Hiroko Tanaka, Satoru Miyano, Junji Shibahara, Satoshi Nishizuka, Satoshi Hirano, Yasuyuki Seto, Takeshi Iwaya, Kazuhiro Kakimi, Takushi Yasuda, and Hidewaki Nakagawa*, "Immuno-genomic Analysis Reveals Eosinophilic Feature and Favorable Prognosis of Female Non-Smoking Esophageal Squamous Cell Carcinomas", Cancer Letters, 10.1016/j.canlet.2023.216499
発表者
理化学研究所
生命医科学研究センター がんゲノム研究チーム
理化学研究所 生命医科学研究センター がんゲノム研究チーム
研修生(研究当時)大川 裕紀(オオカワ・ユウキ)
研究員 笹川 翔太(ササガワ・ショウタ)
チームリーダー 中川 英刀(ナカガワ・ヒデワキ)
近畿大学医学部 外科学教室 上部消化管部門
主任教授 安田 卓司(ヤスダ・タクシ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
学校法人近畿大学 医学部・病院運営本部総務広報課 担当:南川・真鍋
Tel: 072-366-0221 (内線3873) / Fax: 072-365-8300
Email: med.koho [at] itp.kindai.ac.jp
※[at]は@に置き換えてください。
