理化学研究所(理研)開拓研究本部 鈴木糖鎖代謝生化学研究室の黄 澄澄 協力研究員、鈴木 匡 主任研究員らの共同研究グループは、血液中に存在する多様な"細胞外遊離糖鎖[1]"が肝臓から分泌されていることを発見しました。
本研究成果は、細胞外遊離糖鎖の生成の分子機構を明らかにするとともに、本糖鎖が肝機能を示す疾患マーカーとして有用であることを改めて示し、応用研究を加速させることが期待されます。
鈴木主任研究員らはこれまで、糖鎖の新しい代謝機構の解明を目指し、特に細胞中での遊離糖鎖の生成、分解機構の詳細を明らかにしてきました。その過程で、血液のような細胞外の体液にも新規な遊離糖鎖が豊富に存在することを突き止めました。血液中の遊離糖鎖は、肝がん患者の血清中で増加することが示唆されていましたが、体内でどのように生成されているのか、そのメカニズムは全く不明でした。
今回、共同研究グループは、ラットの肝臓の初代培養を用いてその培地中に遊離糖鎖が分泌されるかどうかを調べるとともに、同時に同一個体の血清中の遊離糖鎖に共通性があるかどうかを検証しました。その結果、どちらにも多様な構造を持つ遊離糖鎖が存在することが分かり、血液中の遊離糖鎖は肝臓から分泌されることが明らかとなりました。
本研究は、科学雑誌『The Journal of Biological Chemistry』オンライン版(2月1日付)に掲載されました。
背景
糖鎖は、私たちの細胞を構成する重要な成分で、通常はタンパク質や脂質に結合してその機能や局在性、安定性などの制御に関わっています。一方で糖鎖には他の生体高分子と結合しない、遊離糖鎖というものも存在します。鈴木主任研究員らはこれまで、細胞内の遊離糖鎖、特にその構造が糖タンパク質結合糖鎖の主要なものであるアスパラギン結合型糖鎖(N型糖鎖(Nは窒素原子、もしくはアスパラギンを指す))と類似する遊離糖鎖(遊離N型糖鎖(FNG)[2])について、その生成機構を世界に先駆けて明らかにし、主な生成、分解機構が酵母とヒトで全く異なることなどを示してきました注1)。一方、最近になって、動物の血清中といった細胞外にもFNGが存在することが分かってきました注2)。これらの糖鎖は、肝臓がんの患者血清で増加傾向にあることから、将来的にはさまざまな疾患のマーカーとして使える可能性が示唆されていました。しかし、それらの細胞外遊離糖鎖がどのように生成されるかについてはこれまで知見が全くありませんでした。
- 注1)Harada, Y. et al. (2015) Generation and degradation of free asparagine-linked glycans. Cell Mol Life Sci 72, 2509, 10.1007/s00018-015-1881-7
- 注2)Seino, J. et al. (2016) Occurrence of free sialyl oligosaccharides related to N-glycans (sialyl free N-glycans) in animal sera. Glycobiology 26, 1072, 10.1093/glycob/cww048
研究手法と成果
共同研究グループは、いろいろな動物血清を用いてFNGの解析を行い、主要なFNGの構造は動物種によって異なり、その構造は主要な血清糖タンパク質上の糖鎖と一致することを示してきました注2)。血清糖タンパク質のほとんどは肝臓から分泌されることが知られています。そこで共同研究グループは遊離糖鎖も肝臓から分泌されているのではないかという仮説を立て、ラットの初代肝細胞を用いて、肝細胞が遊離糖鎖を分泌することができるかどうかを検証しました。
まず、ラットの初代肝細胞を無血清中で培養する技術を開発しました。その後培養した肝細胞の培地を回収し、培地中の遊離糖鎖を単離、分析しました。同時に肝細胞を単離したラットの同一個体の血清からも遊離糖鎖を単離し、それらの構造を培地由来のものと比較しました(図1)。
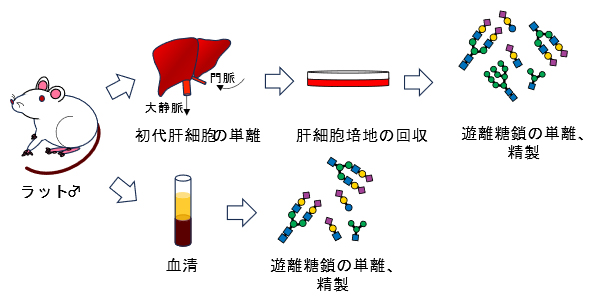
図1 ラットの肝細胞と血清から得た遊離糖鎖を比較する実験の概要
ラットの肝細胞を培地で培養し、その培地の遊離糖鎖を単離・精製する(上側)。また同じラットの血清からも遊離糖鎖を単離・精製する(下側)。この二つの遊離糖鎖を比較した。
共同研究グループは血清中の遊離糖鎖の精製方法を検討する過程で、遊離N型糖鎖の他にも脂質に結合した糖鎖と類似の構造を持つようなシアリルラクトース型遊離糖鎖[3]を同定し、遊離糖鎖にはFNG以外にも多様な構造が存在することを明らかにしてきました注3)。
今回初代肝細胞の培地中からも多様な遊離糖鎖が同定され、主要な糖鎖の構造は培地と血清の両方で観察されました(図2)。このことから、血液中の遊離糖鎖が肝臓から分泌されることが強く示唆されました。また、培地中の糖鎖構造に比べて、血清中の糖鎖は分解されて小さくなっている傾向があり、血清中に糖鎖を分解する酵素活性を確認できました。これらはリソソーム由来の酵素であると考えられ、血液中にはリソソーム由来の酵素が常に分泌されていて、遊離糖鎖の緩やかな代謝に関わることが示されました。

図2 肝細胞の培地と血清で同定された主要な遊離糖鎖
ラットの肝細胞の培地と同じラットの血清から単離・精製した遊離糖鎖には共通するものが多かった。ここに示すのは両者で確認できた主要な糖鎖構造の例。
さらに、今回確立したラット肝細胞の系を用いて、さまざまな阻害剤の影響を調べました。その結果、糖鎖をタンパク質に転移してN型糖鎖を作るオリゴ糖転移酵素(OST)[4]の阻害剤の添加により、FNG特異的にその量の減少が認められました。哺乳動物においては、細胞内のFNGは、OSTの作用によってそのほとんどが作られます注4)。これらのことから、細胞外FNGの生成機構として、少なくともOSTが部分的に関与することが示唆され、FNGの生成、分泌機構の一端を明らかにすることができました(図3)。
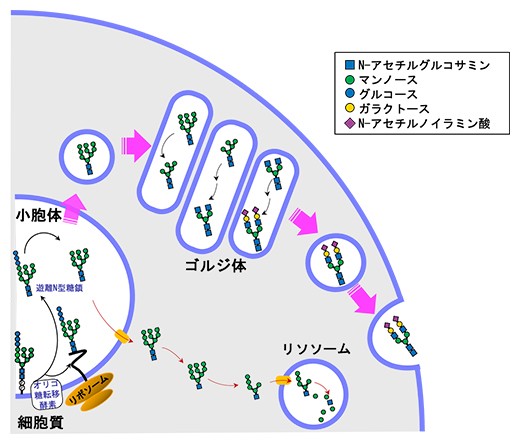
図3 血清遊離N型糖鎖の生成と分泌機構のモデル
通常、オリゴ糖転移酵素(OST)の作用によって作られた遊離N型糖鎖(FNG)は小胞体膜上のトランスポーターによって細胞質に放出され、最終的にリソソームで単糖にまで分解される(図下側の経路)。一方、肝細胞ではその一部が細胞質に放出される代わりに、小胞輸送によって細胞外に分泌される(図上側の経路)。分泌の過程で、遊離N型糖鎖の構造はシアル酸(Nアセチルノイラミン酸)を末端に持つ糖鎖に構造が変換される。
- 注3)Huang, C. et al. (2022) Occurrence of free N-glycans with a single GlcNAc at the reducing termini in animal sera. Glycobiology 32, 314, 10.1093/glycob/cwab124
- 注4)Harada, Y. et al. (2015) Cytosolic free oligosaccharides are predominantly generated by the degradation of dolichol-linked oligosaccharides in mammalian cells. Glycobiology 25, 1196, 10.1093/glycob/cwv055
今後の期待
今回の研究によって、共同研究グループが同定してきた新規の遊離糖鎖、細胞外遊離糖鎖の生成、分泌機構の一端が解明され、血液中に存在する多様な遊離糖鎖は肝臓から分泌されていることが明らかになりました。これまで見過ごされてきた、糖鎖代謝の基本的なプロセスの理解を深めるものであり、基礎科学としての価値があります。さらに、血清FNGは肝がん患者で増加傾向にあることが示されていましたが注2)、今回、これらの遊離糖鎖が肝臓から分泌されることが実際に示されました。これによって、血中の遊離糖鎖が、将来肝臓の機能や病態を表すバイオマーカー[5]として有用である蓋然性が高まったと考えられ、血清遊離糖鎖の将来的な医学応用が期待されます。
補足説明
- 1.細胞外遊離糖鎖
遊離糖鎖はタンパク質や脂質に結合せず糖のみで構成される生体高分子で、さまざまな種類が存在する。哺乳動物において、アスパラギン結合型糖鎖(N型糖鎖)の代謝に関わる遊離糖鎖は主に細胞の中に蓄積することが知られているが、最近血液など細胞外にも遊離糖鎖が存在することが明らかになってきた。この細胞外遊離糖鎖の由来や代謝機構、生物学的意義は現在のところほとんど不明である。 - 2.遊離N型糖鎖(FNG)
遊離糖鎖のうち構造上N型糖鎖に類似しているものの総称で、糖タンパク質、およびドリコールという脂質に結合した糖鎖(N型糖鎖の糖鎖供与基質)からの脱離により生じることが知られている。FNGは、free N-glycanの略。 - 3.シアリルラクトース型遊離糖鎖
遊離糖鎖のうちコア構造としてラクトース(Galβ1-4Glc)あるいはN-アセチルラクトサミン(Galβ1-4GlcNAc)を持つ糖鎖の総称。 - 4.オリゴ糖転移酵素(OST)
タンパク質の糖鎖修飾はさまざまなものがあるが、そのうちN型糖鎖は生物で最もよく保存された糖鎖修飾である。オリゴ糖転移酵素はタンパク質にN型糖鎖を付加する酵素で、ヒトではドリコールと呼ばれる脂質上に合成された14糖(Glc3Man9GlcNAc2)を特定の配列(Asn-Xaa-Ser/Thr)上のアスパラギン残基にそのまま転移する反応を担う(図3参照)。OSTはOligosaccharyltransferaseの略。 - 5.バイオマーカー
がんなどの疾病において、その疾病の存在や状態、および治療の効果などの指標となる物質の総称。主に血液中の物質を検出することが多い(血液バイオマーカー)。
共同研究グループ
理化学研究所
開拓研究本部 鈴木糖鎖代謝生化学研究室
協力研究員 黄 澄澄(ホアン・チェンチェン)
テクニカルスタッフⅠ 清野 淳一(セイノ・ジュンイチ)
基礎科学特別研究員 本田 晃伸(ホンダ・アキノブ)
研究員 藤平 陽彦(フジヒラ・ハルヒコ)
主任研究員 鈴木 匡(スズキ・タダシ)
グローバル研究クラスタ システム糖鎖生物学研究グループ(研究当時)
疾患糖鎖研究チーム(研究当時)
副チームリーダー(研究当時)北爪 しのぶ(キタツメ・シノブ)
(現 福島県立医科大学 保健科学部 教授)
大学院生リサーチ・アソシエイト(研究当時)岡原 京平(オカハラ・キョウヘイ)
(現 株式会社カン研究所 研究員)
名古屋大学 糖鎖生命コア研究所 統合生命医科学糖鎖研究センター
助教 呉 迪(ウ・デイ)
教授・部門長 北島 健(キタジマ・ケン)
教授・センター長 佐藤 ちひろ(サトウ・チヒロ)
島津製作所 分析計測事業部 Solutions COE
ライフサイエンスグループ
主任 中家 修一(ナカヤ・シュウイチ)
研究支援
本研究は、AMED-CREST「プロテオスタシスの理解と医療応用」(Grant No. JP23gm1410003、研究代表者:鈴木匡)と日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「出芽酵母の遊離糖鎖解析がもたらす新規糖鎖代謝機構の解明とヒト稀少疾患への応用(研究代表者:鈴木匡、JP18H03990)」、および理化学研究所開拓研究課題「糖の脂質の構成原理を読み解く先端研究」による助成を受けて行われました。
原論文情報
- Chengcheng Huang, Junichi Seino, Akinobu Honda, Haruhiko Fujihira, Di Wu, Kyohei Okahara, Shinobu Kitazume, Shuichi Nakaya, Ken Kitajima, Chihiro Sato, Tadashi Suzuki, "Rat hepatocytes secrete free oligosaccharides", The Journal of Biological Chemistry, 10.1016/j.jbc.2024.105712
発表者
理化学研究所
開拓研究本部 鈴木糖鎖代謝生化学研究室
主任研究員 鈴木 匡(スズキ・タダシ)
協力研究員 黄 澄澄(ホアン・チェンチェン)
 鈴木糖鎖代謝生化学研究室
鈴木糖鎖代謝生化学研究室
 黄 澄澄
黄 澄澄
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
