理化学研究所(理研)生命医科学研究センター がんゲノム研究チームの中川 英刀 チームリーダーらの国際共同研究グループは、中国で最も多いB型肝炎ウイルス(HBV)感染から発症した肝臓がん(HCC)の全ゲノム解析を行い、日本人のHCCのゲノム変異と比較して、中国特有の肝発がんの要因を複数同定しました。
本研究成果は、HCCの予防および治療標的の同定に結び付くことが期待されます。
今回、国際共同研究グループは、HBV感染が主原因である中国でのHCCについて、494例の全ゲノムシークエンス(WGS)解析[1]を行い、その変異を網羅的に同定して特徴を解析しました。その結果、新たに34個の変異が蓄積するドライバー遺伝子[2]やゲノム領域を同定しました。そして、食品に含有される可能性のあるカビ毒のアフラトキシン[3]または生薬に含まれるアリストロキア酸[4]の暴露によって発がんしたと考えられる形跡(変異シグニチャー[5])をそれぞれ10%、18%のHCCで検出しました。また、HBVのヒトゲノムへの組み込み[6]が73%で検出され、一部は染色体外DNA(ecDNA)[7]を形成して、TERT、MYC、CCND1などのがん遺伝子の増幅を誘導して肝発がんに影響しているものと考えられます。中国では、HBV感染やHBVのヒトゲノムへの組み込みに加えて、アフラトキシンやアリストロキア酸といった化学物質の環境暴露が、がん発生の初期の段階で特異的変異を導入して、肝発がんに至るものと考えられます。
本研究は、科学雑誌『Nature』オンライン版(2月15日付:日本時間2月15日)に掲載されました。
背景
肝臓がん(HCC)は、世界的にみて、発症頻度が6番目に多く(推定年間90万人)、死亡者が3番目に多いがん腫です(同83万人)注1)。特に日本を含むアジアで発症頻度が高く、中でも、中国においては、世界のHCC発症者・死亡者の約45%を抱えています。
HCCの発症要因は、B型肝炎ウイルス(HBV)またはC型肝炎ウイルス(HCV)の感染、アルコール摂取、脂肪肝などがありますが、その頻度は世界各地域で異なっています。HBV感染者は、全世界で3億5,000人以上、中国で約8,700万人と推定されています。中国でのHBV感染者は全世界の感染者の約4分の1を占め、中国でのHCC発症のほとんどがHBV感染と考えられています。
一方、日本では、以前はHCV感染からのHCC発症が最も多かったのですが、HCV治療薬の開発と生活環境の変化に伴い、現在は肥満や脂肪肝などの非ウイルス性因子によるHCC発症が急増しています。HBV感染からのHCC発症は、HCC発症全体の10~20%を推移しており、以前から変化していません。
さらには、食品に含有される可能性のあるカビ毒のアフラトキシンや生薬に含まれるアリストロキア酸の摂取がHCC発症を引き起こすと報告されています。アフラトキシンやアリストロキア酸への暴露によるHCC発症は、中国やアフリカでは多いものの、日本や欧米ではまれな状況です。
がんは、ゲノムに変異が蓄積することで発症するゲノムの疾患です。がんのゲノムを網羅的に解析することによって、がんの発症原因や治療標的を同定することができます。中川チームリーダーらは、HCV関連のHCCを主とした日本人の全ゲノムシークエンス(WGS)解析を行ってきました注2)。また、国際連携全ゲノムがん横断的解析プロジェクト(PCAWG)[8]において、欧米と日本の38種類のがん腫の変異の全ゲノムレベルにおけるカタログを作成し公開しました注3)。これらの解析では、HCCにおいて、ドライバー変異や変異シグニチャー解析、そしてHBVのヒトゲノムへの組み込み注4)など、複数のHCCの発生要因を同定しました。
- 注1)WHO・IARCホームページ
- 注2)2016年4月12日プレスリリース「肝臓がん300例の全ゲノムを解読」
- 注3)2020年2月6日プレスリリース「国際連携によるがん全ゲノムの大規模解析」
- 注4)2021年11月25日プレスリリース「B型肝炎ウイルスは肝臓がんの染色体転座を引き起こす」
研究手法と成果
国際共同研究グループは、上海を主とした中国のさまざまな地域から収集した494例のHCCのWGS解析を行いました。対象者のうち、HBV感染者は94.5%でした(男性86%、女性14%、平均年齢56歳)。解析の結果、計約9百万カ所、1サンプル当たりでは平均1万3,000カ所の変異が検出されました。また、TP53、CTNNB1、AXIN1、ARID2、および中国のHCC特有のJAK1遺伝子など既存のHCCドライバー遺伝子に加えて、六つの新規のドライバー遺伝子(FGA(頻度4.5%)、HNF1A(2.8%)、PRDM11(2.8%)、CDKN1B(2.0%)、BMP5(1.6%)、ECHS1(0.4%))を同定し、それらの機能的意義も確認しました。中国で最も頻度の高い変異遺伝子はTP53(51%)でした。非コード領域については、TERTプロモーター変異などに加えて、新規で28カ所の変異集積を認め、これらの変異が機能的にも重要であることを証明しました。
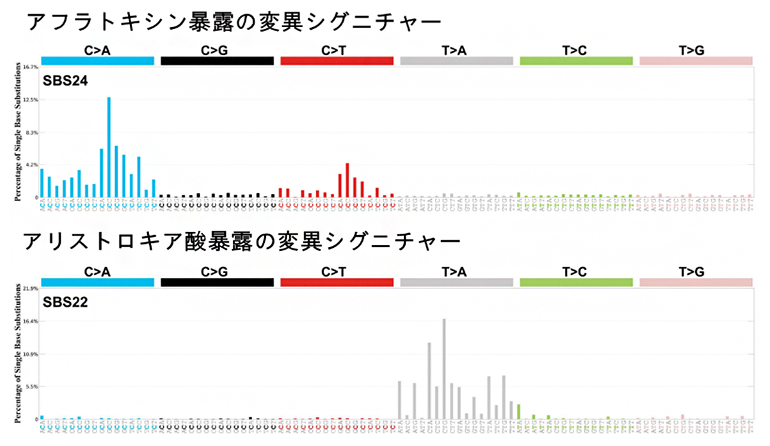
ゲノム全体での変異シグニチャーは、17個のSBS[5](SBS_H1-H17)、3個のDBS[5](DBS_H1-H3)、8個のID[5](ID_H1-H8)を抽出しました。これら変異シグニチャーの意義を国際標準であるシグニチャーデータベースCOSMICに基づいて解釈し、加齢と関連するシグニチャー、アフラトキシン暴露と関連するシグニチャー、アリストロキア酸暴露と関連するシグニチャー(図1)、そして新規または意義不明のシグニチャーに分類しました。アフラトキシンのシグニチャーは、「C>A」(CがAに置換)という塩基置換、アリストロキア酸のシグニチャーは「T>A」(TがAに置換)という特異な塩基置換パターンをそれぞれ多く含んでいます。
日本におけるPCAWGで収集したWGSデータ(平均年齢67歳)を、今回の中国でのデータと比較しました注2、3)。HCC発症の平均年齢は中国では56歳と有意に若く、HBV感染者は中国では94.5%に対し日本では30%でした。日本では、アフラトキシンのシグニチャーやアリストロキア酸のシグニチャーは、ほとんど検出されませんでした。
個々のサンプルをそれぞれの変異シグニチャーの割合に応じて分類したところ、五つのクラスターに分類できました(図2)。
- クラスターⅠ:
- アリストロキア酸が発がんに強く関与。
- クラスターⅡ:
- 加齢による変異シグニチャーが多く、加齢現象が発がんに強く関与。
- クラスターⅢ:
- 特異的なTP53変異があり、アフラトキシンが発がんに強く関与。
- クラスターⅣ:
- DNA複製時のエラーと関連する変異シグニチャーが多く、細胞分裂が発がんに関与する可能性。
- クラスターⅤ:
- CTNNB1変異が多い傾向にあり、新規で意義不明の変異シグニチャーSBS_H8(T>Aが主)が多く、最も予後が悪い。
この結果から、中国では、HBV感染に加えて、アフラトキシンやアリストロキア酸といった化学物質の暴露により、肝発がんの初期の段階で特異的変異が導入されているものと考えられます。
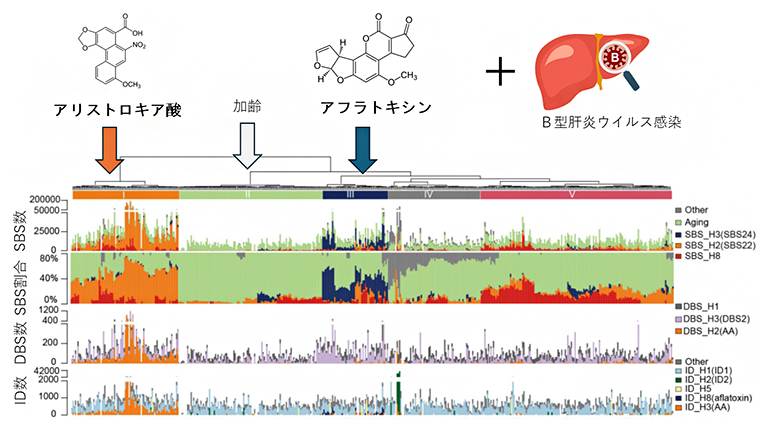
図2 中国のHBV感染によるHCCの特異的な変異シグニチャー分類
HCCは変異シグネチャーの割合に基づいて五つのクラスター(図ではⅠ~Ⅴ)に分類できる。がん発症に大きく寄与しているシグネチャーは、クラスターⅠがアリストロキア酸(オレンジ)、クラスターⅡが加齢関連(緑)、クラスターⅢがアフラトキシン(紺色)、クラスターⅣがDNA複製時エラー(灰色)、クラスターⅤがSBS_H8(赤)であった。クラスターⅤに特有の新規変異シグニチャーSBS_H8(T>Aが主)は、アリストロキア酸シグニチャーと似ているが異なるものであり、どのような環境暴露があったのか不明。
HBVはDNAウイルスです。HBVゲノムは全長が3,200塩基対(ベースペア:bp)程度の環状2本鎖DNAであり、感染時に肝細胞のヒトゲノム(約30億bp)に組み込まれることが分かっていました。HBVがヒトゲノムに組み込まれると、肝細胞内の組み込み部位周辺のヒトゲノムが不安定になり、がん関連遺伝子の発現が変化します。また、中川 チームリーダーらが報告してきたように注4)、染色体の構造までも大きく変化して、HCCの発生につながると考えられています。今回の中国のHCCのWGS解析では、HBVのヒトゲノムへの組み込みが73%で検出され、一部は染色体外DNA(ecDNA)を形成していました(図3)。このecDNAはTERT、MYC、CCND1などのがん遺伝子の増幅につながり肝発がんに影響しているものと考えられます。このように、HBV感染時のヒトゲノムへの組み込みが、中国でのHCCの発症に大きく寄与していることが分かりました。
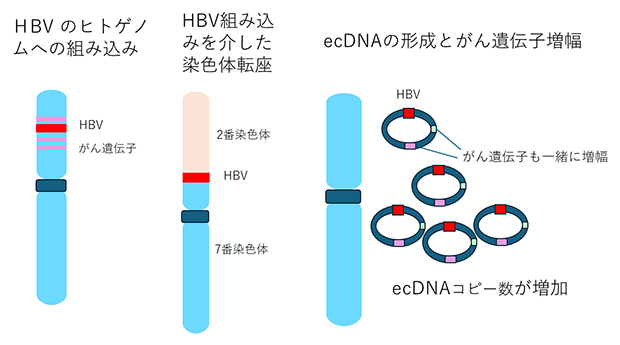
図3 HBVのヒトゲノムへの組み込みとecDNA形成とがん遺伝子の増幅
HBVゲノムが肝細胞のヒトゲノムに組み込まれる(左)と、組み込み部位周辺のヒトゲノムが不安定になり、がん関連遺伝子の発現に変化が現れる。また染色体の構造まで影響が及び(中)、HCCの発症につながる可能性がある。この組み込みは、多くのHCCで見られ、その一部ではecDNAが形成されていた。ecDNAのコピー数増加に伴い、それに含まれるがん遺伝子の増幅につながる(右)。
今後の期待
本研究成果から、ヒトでの肝発がんには、ウイルス感染や炎症だけでなく、化学物質の暴露(環境暴露)も深く関わっていることが明らかになりました。中国と日本のHCCは、そのゲノム構造や環境発がん要因が一部異なり、HBV感染以外にも中国特有の要因があることが分かりました。本研究の成果は、意義が分かったゲノム情報を標的としたHCCの新しい治療法や診断法、そして予防法の開発にも貢献し、ゲノム情報に基づいたHCC治療や予防の個別化へ発展が期待できます。
補足説明
- 1.全ゲノムシークエンス(WGS)解析
これま次世代シークエンサーを使って、個人(約30億塩基)やがんの全ゲノム情報を解読し、配列の違いや変化を同定すること。データが大量になるため、スーパーコンピュータを使って情報解析を行うのが一般的である。全ゲノムシークエンス解析の場合、タンパク質をコードする1~2%の範囲のエクソンだけでなく、遺伝子の発現を制御するゲノム領域の変異やさまざまな構造異常(大きなゲノム配列異常)も検出可能である。がんの場合は、がんのDNAと同一患者由来の正常DNAの全ゲノムシークエンス解析を行い、その差分を調べる。WGSはWhole Genome Sequenceの略。 - 2.ドライバー遺伝子
これまでの研究で、がんのゲノムに変異が高い頻度で検出され、機能的にもがんの発生や進行に関与する遺伝子をドライバー遺伝子という。HCCの場合、TP53、CTNNB1、AXIN1、ARID2が代表格であり、中国におけるHCC特有のJAK1遺伝子の変異が報告されていた。 - 3.アフラトキシン
落花生・ナッツ類およびその加工食品などに含まれる可能性があるカビ毒の一種で、HCCを引き起こす原因物質として知られており、日本や欧米では厳しい規制が敷かれている。発がん機構は、肝臓の代謝酵素によって活性化された後、DNAと結合して付加体を形成して、DNAの変異(核酸配列の変化)や複製阻害を引き起こす。 - 4.アリストロキア酸
ウマノスズクサ科の多くの植物に含有される天然に存在する成分。アリストロキア酸への暴露は、重篤な腎障害、そして泌尿器がんや肝胆道がんの危険因子であると報告されている。TからAという特異的な塩基配列の変化を引き起こす。さまざまな生薬・漢方薬に含まれている可能性があるが、現在の日本において、アリストリキア酸を含有する生薬・漢方薬は医薬品の承認許可を受けておらず製造・輸入されているものはない。 - 5.変異シグニチャー、SBS、DBS、ID
がん細胞に発生するさまざまな遺伝子の変異は、その要因によって異なるパターンを示す。そのパターンを変異シグニチャーと呼ぶ。がん細胞の変異の一種である塩基置換は、DNAを構成する核酸塩基(A、T、C、G)の化学反応によって起こる。塩基置換のパターンや数は、遺伝子毒性を持つ発がん物質への暴露と、変異を修復するための細胞内機構の適切な働きの有無によって決定される。例えば、喫煙が原因で発症した肺がんや紫外線が原因で発症した悪性黒色腫における塩基置換は、他のがんに比べて10倍以上多く、CがTに置き換わる(その相補としてGがAに置き換わる)パターンが非常に多くなる。現在、COSMICデータベースにおいて国際的には、100個以上の変異シグニチャーが定義されており、SBS(single base substitution:1塩基置換のパターン)、DBS(double base substitution:2塩基置換のパターン)、ID(indel:短い欠失挿入)のパターンとさらに細分化されている。 - 6.HBVのヒトゲノムへの組み込み
ウイルスゲノムの組み込みとは、ウイルスのDNA配列がヒトのゲノム配列へ入り込む現象のことを指す。HBVが正常肝細胞に感染するとHBVのゲノムがヒトゲノムに組み込まれる。このウイルスゲノムの組み込みにより、肝細胞内での、組み込み部位周辺のヒトゲノムが不安定となり、がん関連遺伝子の発現が変化するとともに、染色体構造の変化も引き起こし、HCCの発症に寄与すると考えられている。 - 7.染色体外DNA(ecDNA)
染色体から離れて細胞核の内部または外部に存在するDNA。がん細胞では、染色体DNAの一部が断裂後、環状になり、染色体とは別に複製、増幅して、細胞分裂時に分配されるという機構が発見された。ecDNAはしばしば高度にコピー数を増やすことから、環状のecDNAに発がんを誘導するがん遺伝子が含まれていた場合、発がんの大きな駆動力になると考えられている。ecDNAは extra-chromosomal DNAの略。 - 8.全ゲノムがん横断的解析プロジェクト(PCAWG)
国際連携共同体であるICGC/TCGA内のがんの全ゲノムシークエンス解析のデータを集積し、ICGC/TCGAの共同作業にてがんの横断的(PanCancer)解析を行うプロジェクトとして、2014年に始動した。世界各国の約2,800例のさまざまながんの全ゲノムシークエンスのビックデータを東京大学医科学研究所ヒトゲノム解析センターのスーパーコンピュータ「SHIROKANE」を含む世界10カ所のデータセンターで仮想空間を作り、分担して解析を行った。生シークエンスデータだけで約1ペタバイト(1,000兆バイト)の情報量になる。PCAWGは、PanCancer Analysis of Whole Genomesの略。
国際共同研究グループ
理化学研究所 生命医科学研究センター がんゲノム研究チーム
チームリーダー 中川 英刀(ナカガワ・ヒデワキ)
北京大学(中国)医学部
Biomedical Pioneering Innovation Center(BIOPIC)
教授 バイ・ファン(Bai Fan)
上海国家肝がんセンター(中国)東部肝胆膵外科病院
所長 ワン・ホンヤン(Hongyang Wang)
デューク・シンガポール国立大学(シンガポール)
教授 ローゼン・スティーブ(Steve Rosen)
原論文情報
- Lei Chen, Chong Zhang, Ruidong Xue, Mo Liu, Jian Bai, Jinxia Bao, Yin Wang, Nanhai Jiang, Zhixuan Li, Wenwen Wang, Ruiru Wang, Bo Zheng, Airong Yang, Ji Hu, Ke Liu, Siyun Shen, Yangqianwen Zhang, Mixue Bai, Yan Wang, Yanjing Zhu, Shuai Yang, Qiang Gao, Jin Gu, Dong Gao, Xin Wei Wang, Hidewaki Nakagawa, Ning Zhang, Lin Wu, Steven G. Rozen, Fan Bai, and Hongyang Wang, "Deep Whole Genome Analysis of 494 Hepatocellular Carcinomas", Nature, 10.1038/s41586-024-07054-3
発表者
理化学研究所
生命医科学研究センター がんゲノム研究チーム
チームリーダー 中川 英刀(ナカガワ・ヒデワキ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム