理化学研究所(理研)開拓研究本部 鈴木糖鎖代謝生化学研究室の平山 弘人 研究員、鈴木 匡 主任研究員らの共同研究チームは、真核生物が普遍的に持つペプチド:N-グリカナーゼ(PNGase/NGLY1)[1]という酵素の活性を簡便かつ高感度に検出する方法を開発しました。
この方法により、さまざまな細胞や生物種におけるPNGase/NGLY1活性を容易に検出できるようになっただけでなく、NGLY1欠損症の早期診断手法の開発に応用できる可能性があります。
NGLY1は異常糖タンパク質からの糖鎖の除去に重要な酵素ですが、生まれつきこの酵素を持たないNGLY1欠損症の患者は、発育不全、知的障害、四肢の筋力低下、運動障害、不随意運動などの重篤な症状を示します。治療法は確立していませんが、早期の治療介入が重要である可能性があり、簡便かつ正確な早期診断法が求められています。
今回、共同研究チームは、多くのタンパク質・酵素などの夾雑物(きょうざつぶつ)を含む細胞の抽出液からでも、NGLY1の活性のみを検出できる方法を開発しました。NGLY1としか反応しない化合物を新たに開発し、化合物がNGLY1と反応して生じる蛍光によってNGLY1活性を検出しました。これまでの検出法では、NGLY1以外の脱糖鎖酵素ENGase[2]の影響を除くために精度の高い分析機器が必要でしたが、今回の方法では、プレート上の蛍光強度を測るだけでNGLY1活性を検出できます。
本研究は、科学雑誌『Journal of Biological Chemistry』オンライン版(2月26日付)に掲載されました。なお、理研は「細胞溶解物中のNGLY1活性を測定する方法およびそれに用いられるプローブ」として特許を出願しています。
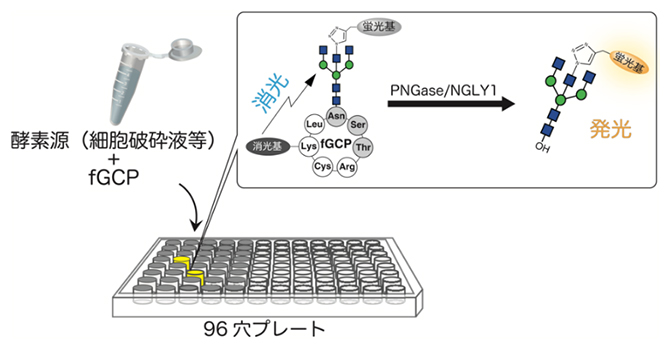
PNGase/NGLY1の活性を簡便・高感度に検出する方法
背景
真核生物が普遍的に持つ脱糖鎖酵素ペプチド:N-グリカナーゼ(PNGase/NGLY1)は、異常糖タンパク質の目印となる糖鎖を切り出し、プロテアソーム[3]という酵素複合体による異常糖タンパク質の分解を促進すると考えられています。
NGLY1遺伝子の変異により生じるNGLY1欠損症が2012年にアメリカで初めて報告されてから、現在までに100人以上の患者が世界で確認されており注1)、近年初めて日本でも確認されました注2)。発達障害、知的障害、運動障害などをはじめとする中枢および末梢神経系の異常に起因する重篤な症状が報告されています。しかし、この疾患の分子病態には不明な点が多く、治療方法は確立していません。
近年、NGLY1欠損症モデルラットを用いた研究により、NGLY1遺伝子を離乳後すぐのモデルラットの脳室内に導入することで、運動機能障害が著しく回復することが示されました注3)。このことから、生後早い段階で本疾患の診断を行い、早期に治療介入するための簡便かつ有効な診断法の開発が期待されています。
酵素が分解する対象を基質といい、一般に酵素活性は基質が分解されるかどうかで測定します。これまでにいくつかNGLY1活性の測定法が報告されていますが、通常の医療現場で得られる細胞や組織の抽出液にはNGLY1以外のタンパク質・酵素などの夾雑物が含まれており、このような検体におけるNGLY1活性のみを正確かつ簡便に検出する技術は開発されていませんでした。鈴木糖鎖代謝生化学研究室では、夾雑物の作用を受けにくい新たな基質の開発に取り組み、NGLY1の活性のみを測定する方法を確立しました注4)。しかし、この方法では高速液体クロマトグラフィーという分析機器が必須であり、通常の病理診断を行う現場では実施が困難であるという問題がありました。
そこで共同研究チームは、高精度な分析機器を用いることなく実施可能なNGLY1欠損症の診断方法の確立を試みました。
- 注1)Pandey A, Jafar-Nejad H., (2022) J Biochem. 171(2):153-160. PMID: 34270726
- 注2)Sonoda Y et al., (2024) Eur J Med Genet. 67:104895. PMID: 38070824
- 注3)2021年6月15日プレスリリース「遺伝性稀少疾患NGLY1欠損症の遺伝子治療法の可能性」
- 注4)Hirayama H et al., (2022) Glycobiology. 32(2):110-122. PMID: 34939090
研究手法と成果
過去に鈴木糖鎖代謝生化学研究室で開発した活性測定法では、環状構造の糖ペプチド(GCP)を蛍光標識した化合物を基質として用います。しかし、細胞抽出液にはNGLY1以外の脱糖鎖酵素ENGaseが含まれており、この酵素によっても糖鎖が切り出されてしまいます(図1A、副反応物)。そのため、高速液体クロマトグラフィーによってNGLY1による生成物だけを検出する必要があります。
そこで本研究では、NGLY1の活性があるときだけ蛍光を発するような基質をデザインしました(図1B)。まず、ENGaseの基質特異性を解析し、NGLY1と特異的に反応する糖鎖構造を推定しました。さらにその糖鎖構造をペプチドに結合し、糖鎖部分を蛍光基、ペプチド部分を消光基で標記した化合物fGCPを作成しました。fGCPは、NGLY1が存在しないときは消光基によって蛍光が抑えられていますが、NGLY1が存在するときだけ糖鎖が切り出されて蛍光を発します。反応が進むにつれて遊離する糖鎖が増え、蛍光強度が強くなります。この性質を利用して、プレート上で組織や細胞由来の粗抽出液と反応させ、蛍光強度によってNGLY1活性を検出する方法を確立しました。
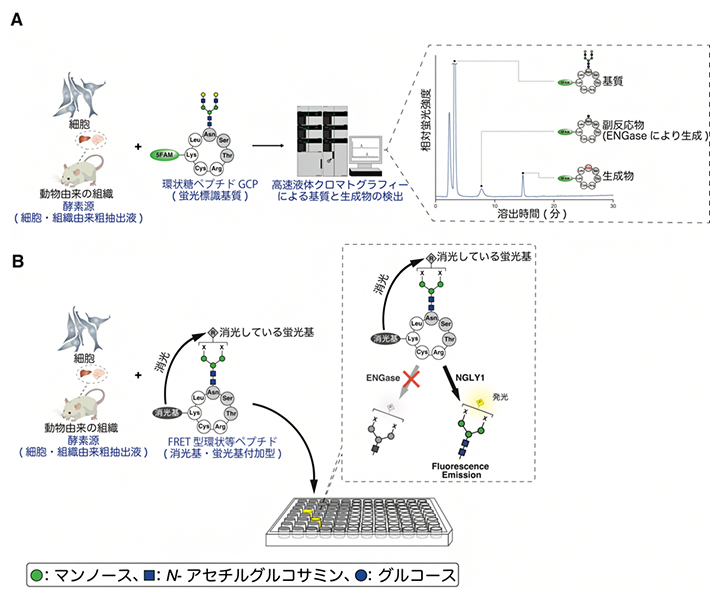
図1 既存のNGLY1活性測定法と本研究で開発した手法の比較
- A)既存の活性測定法の概要。細胞や組織から抽出した溶液を酵素源、GCPを基質として試験管内で反応させ、基質と生成物を高速液体クロマトグラフィーにより分離・検出する。抽出液中に存在するENGaseという酵素によっても糖鎖構造の一部が切り取られることで、副反応物が生成してしまう。
- B)本研究で開発した活性測定法の概要。Aで示したGCPを改変し、NGLY1によってのみ糖鎖が切り出されるfGCPを開発して基質とした。fGCPは、糖鎖部分に蛍光基、環状ペプチド部分に消光基が導入されており、蛍光基と消光基の間で励起エネルギーが移動するFRET(蛍光共鳴エネルギー移動)型環状ペプチドである。これにより、通常状態では蛍光を発することはないが、糖鎖部分が切断されて消光基から遊離することで蛍光を発する。
細胞および臓器の画像は、Togo Picture Gallery(© 2016 DBCLS TogoTV)の提供するものを利用した。
NGLY1欠損症患者の体内では、NGLY1活性が著しく低下しています。そこで、患者の細胞におけるNGLY1活性の低下をfGCPで検出できるか検討するため、健常者とNGLY1欠損症患者の線維芽細胞を培養し、細胞抽出液とfGCPをプレート上で反応させながら15分ごとに蛍光強度を測定し、NGLY1の活性を経時的に解析しました。その結果、健常者由来の細胞抽出液中では時間とともに蛍光強度が増加しましたが(図2青)、患者由来の細胞抽出液では蛍光は増加しませんでした(図2緑)。以上の結果から、fGCPを用いたNGLY1の活性検出法はこの疾患の診断に活用できることが示唆されました。
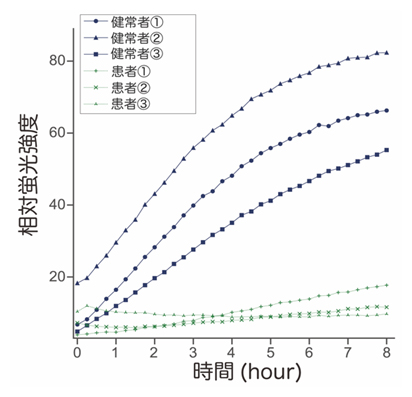
図2 GCPを用いたNGLY1欠損症患者細胞のNGLY1活性の検出
NGLY1欠損症患者または健常者の線維芽細胞の破砕液とfGCPを混合し、15分おきに蛍光強度を測定した。患者由来の細胞にはNGLY1タンパク質がないので、fGCPの糖鎖がNGLY1依存的に切り出されず、蛍光の増加が見られなかった。
NGLY1欠損症モデルラットでは患者と同様、中枢神経系に異常が見られることが知られています。また、5週齢の病態モデルラットの脳では神経炎症が観察されますが、2週齢のモデルラットでは炎症が見らないことが報告されています注5)。このことから、ラットが成長する各段階においてNgly1の発現量が大きく変化しているのではないかと考え、fGCPを用いてラットの脳に発現しているNgly1の活性を解析しました。その結果、2週齢の脳内でNgly1が最も多く発現している一方で、加齢とともに発現が減少していくという新たな知見を見いだしました(図3)。
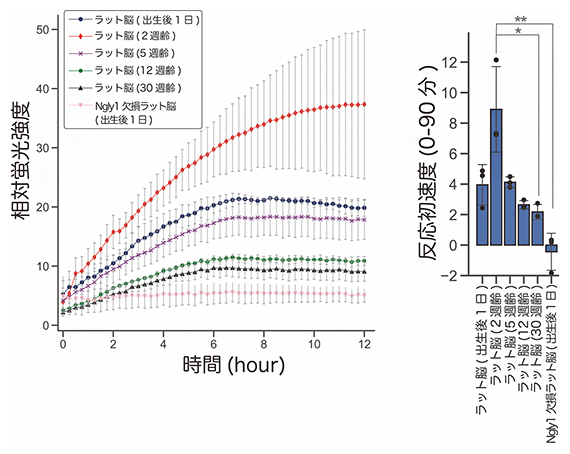
図3 ラット各週齢の脳由来の抽出液を用いたNgly1活性の解析
2週齢で反応曲線の蛍光強度が最大に達し、その後加齢とともに蛍光強度の最大値が減少した(左;各週齢3個体のラットを使用して解析)。測定開始後90分までの蛍光強度の増加の傾きから算出した反応初速度おいても、2週齢で最大に達し、その後加齢とともに反応初速度が減少した(右)。反応初速度を算出することで、反応曲線のパターンの違いを定量的かつ統計的に示すことができる。
- 注5)Asahina M et al., (2020) Hum Mol Genet. 29(10):1635-1647. PMID: 32259258
今後の期待
本研究で開発したfGCPを用いることで、精度の高い分析機器を用いることなく、プレート上の蛍光強度を測定するだけでNGLY1の検出が可能になりました。この方法を応用することで、血中の細胞を用いたNGLY1欠損症の簡便な診断方法の開発が期待されます。
また、消光基と蛍光基を最適化することで、fGCPの感度をさらに向上させるための研究を続けています。fGCPはさまざまな生物種のPNGase/NGLY1活性を容易に検出できるため、多様な生物の各発生段階や種々のストレス環境下におけるPNGase/NGLY1活性の変化を解析する有用なツールとなると考えられ、PNGase/NGLY1の生物学的機能や重要性を解明するための研究を加速することが期待できます。
補足説明
- 1.ペプチド:N-グリカナーゼ(PNGase/NGLY1)
N-結合型糖鎖を糖タンパク質の根元から切り取る活性のある酵素。ヒトを含む哺乳動物ではNGLY1(Ngly1)、他の生物ではPNGaseと呼ばれるが、同じタンパク質である。N-結合型糖鎖は、タンパク質のアスパラギン側鎖のアミド窒素に結合している糖鎖であり、細胞内ではタンパク質のフォールディング(ポリペプチドの折り畳みによる高次構造の構築)や細胞内輸送を制御することが知られている。正しい折り畳み構造を取らない異常糖タンパク質は、特定の糖鎖構造をタグとして小胞体品質管理機構に認識され、細胞質への逆行輸送後、プロテアソームによって分解される。NGLY1による糖鎖の切り離しは、プロテアソームによる分解を促進するとともに、細胞質における糖鎖代謝の初期ステップとしても機能する。
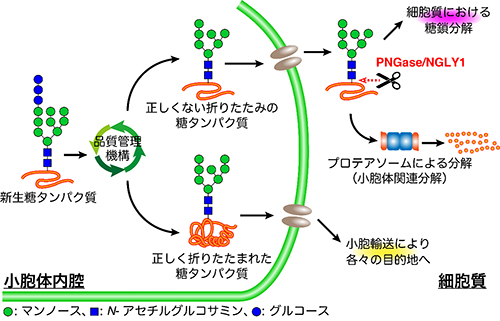
- 2.ENGase
細胞内には、物質の分解を担う細胞小器官であるリソソームが存在するが、細胞質内のリソソーム以外の場所でも糖鎖の分解が起こる。ENGaseはこの「糖鎖の非リソソーム分解機構」に関与する脱糖鎖酵素。ENGaseはエンド-β-N-アセチルグルコサミニダーゼ(Endo-beta-N-acetylglucosaminidase)の略。 - 3.プロテアソーム
タンパク質の分解を担う酵素複合体。細胞質や核内で不要になり、ユビキチン化されたタンパク質を分解する(ユビキチンプロテアソーム系)。真核生物に広く保存されており、さまざまな生命現象を制御する。
共同研究チーム
理化学研究所 開拓研究本部 鈴木糖鎖代謝生化学研究室
主任研究員 鈴木 匡(スズキ・タダシ)
研究員 平山 弘人(ヒラヤマ・ヒロト)
(T-CiRA共同研究プログラム (Takeda-CiRA Joint Program for iPS Cell Applications) NGLY1欠損症プロジェクト Sub-PI)
技師 立田 由里子(タチダ・ユリコ)
(T-CiRA共同研究プログラム (Takeda-CiRA Joint Program for iPS Cell Applications) NGLY1欠損症プロジェクト)
テクニカルスタッフ(研究当時)藤縄 玲子(フジナワ・レイコ)
(T-CiRA共同研究プログラム (Takeda-CiRA Joint Program for iPS Cell Applications) NGLY1欠損症プロジェクト)
株式会社糖鎖工学研究所
技術部 松田 由佳(マツダ・ユカ)
事業部 部長 村瀬 健文(ムラセ・タケフミ)
技術部 部長 西内 祐二(ニシウチ・ユウジ)
研究支援
本研究は、T-CiRA共同研究プログラム(NGLY1欠損症プロジェクト)、理化学研究所先駆的研究プロジェクト「Glyco-lipidologue Initiative」、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「プロテオスタシスの理解と革新的医療の創出」研究開発領域における研究開発課題「細胞質における糖鎖生物学―細胞恒常性維持の包括的理解を目指して」(研究開発代表者:鈴木匡、23gm1410003)、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「Peptide:N-glycanaseの欠損によるタンパク質分泌減少の機構解析(研究代表者:平山弘人、JP22K06155)」による助成を受けて行われました。
原論文情報
- Hiroto Hirayama, Yuriko Tachida, Reiko Fujinawa, Yuka Matsuda, Takefumi Murase, Yuji Nishiuchi, and Tadashi Suzuki, "Development of a Fluorescence and Quencher-based FRET Assay for Detection of Endogenous Peptide:N-glycanase/NGLY1 Activity", Journal of Biological Chemistry, 10.1016/j.jbc.2024.107121
発表者
理化学研究所
開拓研究本部 鈴木糖鎖代謝生化学研究室
主任研究員 鈴木 匡(スズキ・タダシ)
研究員 平山 弘人(ヒラヤマ・ヒロト)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
