理化学研究所(理研)開拓研究本部 田中生体機能合成化学研究室の田中 克典 主任研究員(東京工業大学 物質理工学院 応用化学系 教授)、チャン・ツンチェ 研究員(同大学 物質理工学院 応用化学系 特任助教(研究当時))、アンバラ・プラディプタ 客員研究員(同大学 物質理工学院 応用化学系 助教)、笠原 隆継 研修生(研究当時)(同大学 物質理工学院 応用化学系 修士課程2年(研究当時))、吉岡 広大 基礎科学特別研究員らの共同研究グループは、がん細胞に多く存在する「アクロレイン[1]」という分子を利用し、シアル酸転移酵素[2]阻害剤をマウス体内のがん細胞内で合成し、がん細胞表面上の糖鎖構造を変えて、副作用なくがんを治療することに成功しました。
本研究成果は、副作用のない抗がん剤の開発に貢献できると期待されます。
細胞内のシアル酸転移酵素の阻害は、新たながん治療戦略として期待されますが、既存の阻害剤は正常組織にも作用してしまうため、腎臓の機能障害などの副作用を引き起こすことが課題となっていました。今回、共同研究グループは、がん細胞内でのみ阻害剤を合成し作用させれば副作用の恐れが少ないと考えました。そこで、アジド基を持つ化合物とアクロレインが選択的に環化付加反応を起こすことを利用した、阻害剤の原料となる「プロドラッグ[3]」を設計しました。プロドラッグががん細胞内でアクロレインと反応して、ドラッグ活性体が合成され、シアル酸転移酵素を阻害し、がんを治療することができました。副作用である腎臓の機能障害による体重増減は見られませんでした。
本研究は、科学雑誌『Chemical Science』オンライン版(5月24日付:日本時間5月24日)に掲載されます。
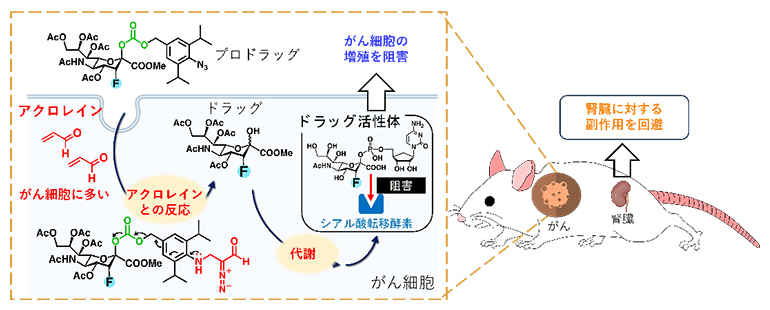
がん細胞内でのシアル酸転移酵素阻害剤の合成
背景
がん細胞表面上の糖鎖にある過剰なシアル酸は生体内の免疫細胞によるがん細胞の排除を邪魔します。これはがんの浸潤や転移につながるため、糖鎖上のシアル酸を減らし、糖鎖構造を変えることのできるシアル酸転移酵素阻害剤が新たながん治療戦略になる可能性があります。しかし、シアル酸を有する糖鎖は正常な細胞にも存在し、多様な生体機能の調整に関わることから、正常な細胞のシアル酸を減らしてしまう既存のシアル酸転移酵素阻害剤は重篤な副作用を生じます。特に腎臓の機能障害は大きな問題です。
これまでに田中主任研究員らは、がん細胞にアクロレインが多く存在することを発見しました注1)。また、アクロレインと反応する保護基[4]を開発し、がん細胞内のみで薬剤を合成する戦略を報告しています注2)。
そこで本研究では、シアル酸転移酵素阻害剤を、がん細胞内でのみ合成し、がん細胞上の糖鎖構造のみを合成化学的に変換することができれば、副作用のない治療法になると考え、その実現を目指しました。
- 注1)2018年11月28日プレスリリース「有機合成反応で乳がん手術を改革」
- 注2)2021年3月31日プレスリリース「体内での環化付加反応によるがん化学療法」
研究手法と成果
共同研究グループは、以前開発した、細胞内でアクロレインと効率的に反応する保護基を、シアル酸転移酵素阻害剤(ドラッグ)に導入し、プロドラッグに変換しました。このプロドラッグはがん細胞に取り込まれると、がん細胞が産生するアクロレインと環化付加反応を起こし、保護基の部分のみが切断されドラッグへと変換されます。
プロドラッグの作用機序を確認すべく、マウスのがん治療を通じて検証を行いました。その結果、マウス体内ではプロドラッグによる腫瘍成長の抑制効果が見られ(図1A左下)、がん細胞内では確かにドラッグが合成されていることが分かりました。さらに、腎臓の障害による体重増減の副作用が見られず(図1A右下)、正常な腎臓組織上ではドラッグ合成がされていないことが示唆されました。実際にがん治療後のマウス体内の腎臓組織ではドラッグによってシアル酸が減少しているが、プロドラッグではシアル酸が減少していないことが分かりました(図1B)。このことから、正常な腎臓組織ではドラッグの合成が起きていないことが強く支持され、副作用の回避につながっていることが示されました。
このように、シアル酸転移酵素阻害剤をプロドラッグ化することで、がん細胞内のみでドラッグを合成し、がん細胞の糖鎖構造のみを合成化学的に変換するという、副作用のないがんの治療戦略を実証することに成功しました。
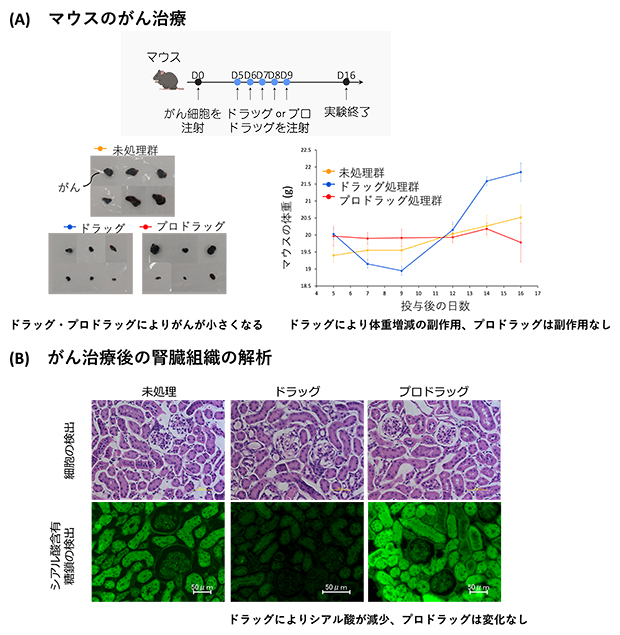
図1 プロドラッグとドラッグによるマウスのがん治療とがん治療後の腎臓組織の解析
- (A)動物実験の概要(上、実験期間16日)。マウスにおける未処理群、ドラッグ投与群、プロドラッグ投与群の腫瘍体積変化(左下)と体重変化(右下)。ドラッグやプロドラッグは腫瘍の成長を抑える。ドラッグは体重増減の副作用があるが、プロドラッグにはその副作用がない。
- (B)標準的な色素を用いたヘマトキシリン・エオジン(HE)染色による細胞の検出(上段)とシアル酸含有糖鎖の検出(下段)。シアル酸含有糖鎖は緑色の蛍光として検出される。ドラッグは腎臓組織のシアル酸を減少させるが、(下段中)、プロドラッグは腎臓組織のシアル酸を減少させない(下段右)。
今後の期待
本研究では、アクロレインが多く存在するがん細胞内でシアル酸転移酵素阻害剤を合成し、がん細胞上のみで糖鎖構造を合成化学的に変化させ、副作用なくマウスのがんを治療することに成功しました。がん細胞内で薬剤を合成するという本研究の戦略は、他の作用機序を有する抗がん剤の開発においても、副作用を減らす戦略としての活用が期待されます。
補足説明
- 1.アクロレイン
生体内で生成される反応性の高い化合物。さまざまな生体分子と反応する。また、がん細胞内では特に過剰に生成していることが知られる。 - 2.シアル酸転移酵素
タンパク質表面に存在する糖の一つであるシアル酸の合成に関与する酵素。がんやさまざまな疾患との関連が報告されている。 - 3.プロドラッグ
生体内の薬剤標的部位での化学反応によって、薬効を示す分子に変換されるようにデザインされた薬剤。標的部位選択的に活性を示すため、副作用の軽減が期待できる。標的部位での化学反応には、生体内の酵素による触媒反応や生体内の低分子化合物との反応が主に用いられる。また、近年は生体内に導入した遷移金属触媒によって分子を合成する研究も進められている。 - 4.保護基
反応性の高い官能基に導入し、その反応性を下げる官能基。有機合成においては、特定の官能基の反応性を低下させて副反応を防ぐために用いられる。また、プロドラッグの戦略としては、薬剤の活性を一時的に低下、もしくは消失させるためにも用いられる。
共同研究グループ
理化学研究所
開拓研究本部
田中生体機能合成化学研究室
主任研究員 田中 克典(タナカ・カツノリ)
(東京工業大学 物質理工学院 応用化学系 教授)
客員研究員 アンバラ・プラディプタ(Ambara Pradipta)
(東京工業大学 物質理工学院 応用化学系 助教)
研修生(研究当時)笠原 隆継(カサハラ・タカツグ)
(東京工業大学 物質理工学院 応用化学系 修士課程2年(研究当時))
研究員 チャン・ツンチェ(Tsung-Che Chang)
(東京工業大学 物質理工学院 応用化学系 特任助教(研究当時))
基礎科学特別研究員 吉岡 広大(ヨシオカ・ヒロマサ)
テクニカルスタッフⅡ(研究当時)浦野 清香(ウラノ・サヤカ)
研究パートタイマーⅡ 江河 泰子(エガワ・ヤスコ)
客員研究員(研究当時)盛本 浩二(モリモト・コウジ)
生命機能科学研究センター
分子標的化学研究チーム
客員研究員 田原 強(タハラ・ツヨシ)
(徳島大学 先端研究推進センター バイオイメージング研究部門 准教授)
先端バイオイメージング研究チーム
テクニカルスタッフⅠ 井上 美智子(イノウエ・ミチコ)
原論文情報
- Takatsugu Kasahara, Tsung-Che Chang, Hiromasa Yoshioka, Sayaka Urano, Yasuko Egawa, Michiko Inoue, Tsuyoshi Tahara, Koji Morimoto, Ambara R Pradipta and Katsunori Tanaka, "Anticancer Approach by Targeted Activation of a Global Inhibitor of Sialyltransferases with Acrolein", Chemical Science, 10.1039/D4SC00969J
発表者
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(タナカ・カツノリ)
(東京工業大学 物質理工学院 応用化学系 教授)
客員研究員 アンバラ・プラディプタ(Ambara Pradipta)
(東京工業大学 物質理工学院 応用化学系 助教)
研修生(研究当時)笠原 隆継(カサハラ・タカツグ)
(東京工業大学 物質理工学院 応用化学系 修士課程2年(研究当時))
研究員 チャン・ツンチェ(Tsung-Che Chang)
(東京工業大学 物質理工学院 応用化学系 特任助教(研究当時))
基礎科学特別研究員 吉岡 広大(ヨシオカ・ヒロマサ)
 左から田中 克典、笠原 隆継、アンバラ・プラディプタ
左から田中 克典、笠原 隆継、アンバラ・プラディプタ
 上から吉岡 広大、チャン・ツンチェ
上から吉岡 広大、チャン・ツンチェ
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
東京工業大学 総務部 広報課
Tel: 03-5734-2975 / Fax: 03-5734-3661
Email: media [at] jim.titech.ac.jp
