理化学研究所(理研)開拓研究本部 眞貝細胞記憶研究室の新海 暁男 上級研究員、志村 知古 テクニカルスタッフⅠ、福田 渓 客員研究員、眞貝 洋一 主任研究員らの国際共同研究グループは、さまざまな生命現象やがんや免疫不全などの疾患に関与しているDNAメチル化をコントロールする仕組みを明らかにしました。
本研究成果は、DNAメチル化制御の全容解明に向けた一歩であり、疾患治療や創薬の基礎につながるものと期待されます。
ICF症候群[1]と呼ばれる免疫不全ではDNAの低メチル化が認められ、その原因遺伝子にHELLSとCDCA7が含まれていることなどからHELLS-CDCA7(HELLSタンパク質とCDCA7タンパク質の複合体)がDNAメチル化の制御をつかさどっていると考えられてきました。しかしその分子機構は不明でした。
今回、国際共同研究グループは、両側鎖がメチル化されたDNAの複製の際に形成される、DNAの片側鎖だけがメチル化されたDNA(ヘミメチルDNA)にCDCA7が強く結合すること、ICF変異を持つCDCA7にはその結合が認められないことを発見しました。すなわち、複製後生じるヘミメチルDNAの、メチル化されていない鎖(新生鎖)をDNAメチル化酵素[2]DNMT1がメチル化する際に、CDCA7によるヘミメチルDNAの認識を介して、HELLS-CDCA7をそこに動員することが重要であると示唆されました。
本研究は、科学雑誌『Nucleic Acids Research』オンライン版(8月15日付:日本時間8月15日)に掲載されました。
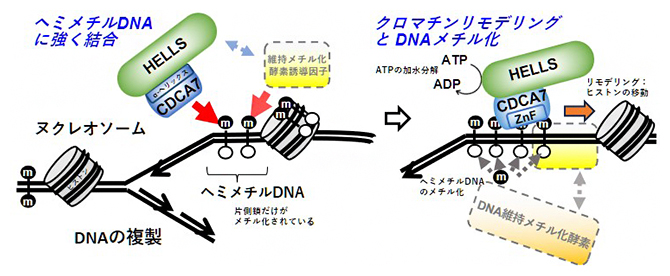
HELLS-CDCA7によるDNAメチル化制御の仕組み
背景
高等真核生物においてDNAメチル化は遺伝子の発現制御などの生命現象に関係しています。また、がんや免疫疾患においてはDNAメチル化の異常が認められる場合があります。従って、DNAメチル化やその制御機構を明らかにすることは、それらの生命現象や疾患の理解につながると考えられます。DNAメチル化はDNAメチル化酵素によって導入されますが、両側鎖がメチル化されていないDNAがメチル化される「新規メチル化」、および、両側鎖がメチル化されているDNAが複製される際にできるメチル化されていない片側(新生)鎖がメチル化される「維持メチル化」があります。
真核生物の染色体はヒストンにDNAが巻き付いているヌクレオソーム[3]が連なったクロマチン[3]構造を形成しています。クロマチンリモデリング因子[4]はATP(アデノシン三リン酸)の加水分解を行いながらヒストンの移動や交換を行います。その因子の一つであるHELLSはCDCA7に結合して活性化されます。一方、ICF症候群と呼ばれる免疫疾患ではDNAの低メチル化が起こり、その原因遺伝子にHELLSとCDCA7が含まれることなどから、HELLS-CDCA7はDNAメチル化の制御をつかさどっていると考えられてきましたが、その分子機構は不明でした。国際共同研究グループは生化学的、細胞生物学的手法を用いてCDCA7の機能の解明に取り組み、HELLS-CDCA7がDNA維持メチル化の制御にどのように関与しているか、その一面を明らかにすることに挑みました。
研究手法と成果
CDCA7のC末端側にはジンクフィンガードメイン(ZnF)[5]と呼ばれる領域があり、中央部にはα-ヘリックス構造[6]を形成していると予測される領域があります(図1)。これらの領域は他生物由来のCDCA7と共通している特徴です。ICF症候群の一部の患者にはそのZnF内に変異(ICF変異)が見つかっています。国際共同研究グループは、HELLSの活性化に対するCDCA7の各領域の機能を解明するために、ヒト由来の野生型CDCA7、N末端側あるいはC末端側を欠失させた各種変異CDCA7、および、ICF変異を持つ3種類の変異CDCA7を調製し、HELLSの結合、および、HELLSのATP加水分解活性とヒストンを移動させるクロマチンリモデリング活性に与える影響を調べました(図1)。その結果、α-ヘリックス構造を形成していると予測される領域を含む中央部領域がHELLSの結合と活性化に重要であること、N末端の領域が活性を負に調節していることが分かりました。さらに、ZnFが欠損すると、ヒストンが片側方向に偏って移動していたのが、両方向に移動するように変化する傾向が観察されました。この領域はヌクレオソームあるいはDNAの正確な認識に関与していることが示唆されました。
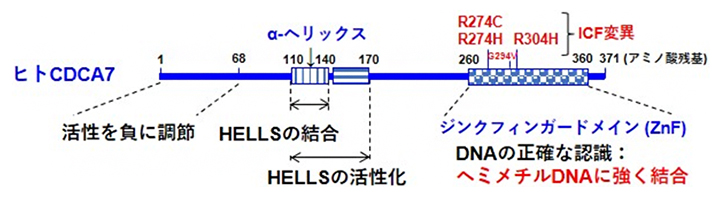
図1 ヒト由来CDCA7タンパク質の機能
これまで見つかっている4種類のCDCA7のICF変異体のうち、本研究では3種類のCDCA7タンパク質のICF変異体(R274C、R274H、R304H)を作製し、主としてR274C変異体の性質を調べた。
DNAはHELLS-CDCA7のATP加水分解活性を促進します。そこで次に、HELLS-CDCA7のATP加水分解活性に影響を及ぼすメチル化DNAを調べました(図2)。
メチル化を含まないDNA、片側鎖だけがメチル化されているDNA(ヘミメチルDNA)、および、両側鎖がメチル化されているDNA(両鎖メチルDNA)の3種類のDNAを調べた結果、HELLS-野生型CDCA7はヘミメチルDNAの存在下で最も高いATP加水分解活性を示しました。一方、CDCA7のC末端ZnFを欠失させた場合(HELLS-CDCA7_1-261)およびZnF内に変異を持つICF変異CDCA7の場合(HELLS-CDCA7_R274C)では、どのDNAの存在下でも同程度のATP加水分解活性を示しました。他のICF変異体(CDCA7_R274H、CDCA7_R304H)を用いた場合もCDCA7_R274Cと同様の結果でした。
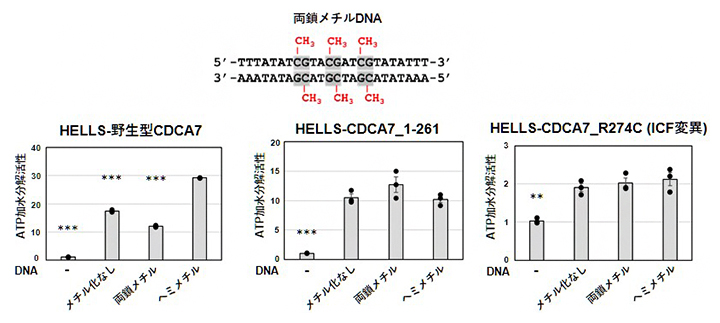
図2 各種HELLS-CDCA7のATP加水分解活性に及ぼす各種DNAの影響
- (上)実験に使用したDNAの配列。高等動物では主として、シトシン-グアニンジヌクレオチド(CG)のシトシン塩基がメチル化される。このメチル化がさまざまな生命現象や疾患に関与する。
- (下)「メチル化なしDNA」はメチル基(CH3)だけがない。ヘミメチルDNAは片側鎖(本実験の場合は上のDNA配列の下側)だけがメチル基を含む。*** P<0.001、**P<0.01はヘミメチルDNAの場合に対する有意差を示す。野生型CDCA7に対してはヘミメチルDNAの効果が最も高いが、ZnFが欠損したCDCA7(CDCA7_1-261)ではその効果が失われることが分かる。
次に、CDCA7のDNA結合活性を調べました(図3)。上記3種類のDNAのうち、野生型CDCA7は、ヘミメチルDNAに強く結合しましたが、ICF変異CDCA7ではいずれのDNAに対しても結合が認められませんでした。
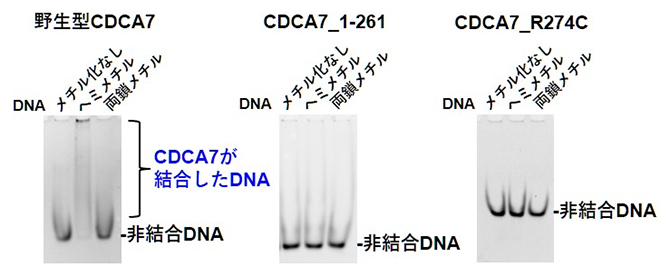
図3 各種CDCA7の、各種DNAへの結合
CDCA7とDNAを混合しゲル電気泳動を行った。DNAにCDCA7が結合すると(非結合に相当する)DNAのバンドが薄くなり、上部に現れる。野生型CDCA7はヘミメチルDNAに強く結合することが分かる。
最後に、CDCA7とHELLSの細胞内における局在を免疫染色[7]を使って調べました。マウスの胚性幹細胞(ES細胞)[8]で調べた結果、CDCA7、HELLSともにある頻度でペリセントロメア領域[9]に局在していました(図4a)。また、両タンパク質ともに、このペリセントロメア領域のDNAが複製するタイミングである細胞周期[10]のS期[10]中~後期にある細胞で、ペリセントロメア領域への局在が観察される割合がピークを迎えることが分かりました(図4b)。
次に、Cdca7遺伝子をノックアウト(KO)したマウスES細胞に、野生型CDCA7、あるいは、ICF変異CDCA7(CDCA7_R285C:ヒトR274Cのマウス型)を発現させ、それらの細胞内局在を調べました(図4c)。その結果、野生型CDCA7は、複製が進行しているS期中~後期のペリセントロメア領域に局在しており、同じタイミングでペリセントロメア領域にHELLSも局在していました。一方、CDCA7_R285Cは、細胞核内に局在していたものの、ペリセントロメア領域への局在は認められず、HELLSのペリセントロメア領域への結合もほとんど認められませんでした。さらに、ヘミメチルDNAをメチル化する酵素に対するメチル化酵素阻害剤(GSK-3484862)[2]を添加することでDNA複製の際に形成されるヘミメチルDNAの量を増やすと、CDCA7、HELLSともペリセントロメア領域への局在ならびにその強度がさらに高進することが分かりました(図4d)。
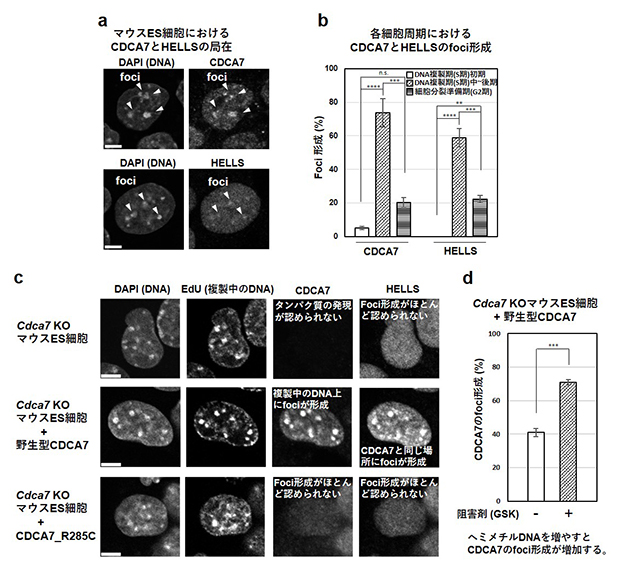
図4 マウスES細胞におけるCDCA7、HELLSの局在
- (a、c)細胞の核を撮影したもの。細胞を4',6-ジアミジノ-2-フェニルインドール(DAPI)で染色するとDNAが染色される。DNAの密度の高い部分が焦点(foci = 集積箇所)として見える。細胞を5-エチニル-2'-デオキシウリジン(EdU)の存在下で培養すると複製中のDNAをfociとして観察することができる。CDCA7とHELLSはそれぞれの抗体を用いた免疫染色で検出した。密度の高い部分がfociとして検出されている。
- (b)図に示した細胞周期にある細胞を調製し、CDCA7とHELLSの局在を調べた。DNA複製期(S期)初期の場合に対する有意差(**** P<0.0001、***P<0.001、**P<0.01、n.s.:有意差なし)を示す。
- (d)細胞をメチル化酵素阻害剤(GSK:GSK-3484862)で処理してヘミメチルDNAが多い状態にし、CDCA7のfoci形成を解析した。阻害剤非添加の場合に対する有意差(***P<0.001)を示す。
以上の結果より、HELLS-CDCA7は、CDCA7のC末端ZnFによるヘミメチルDNA認識を介して、DNA複製の際に形成されるヘミメチルDNAに集積することが明らかとなりました。このことから、クロマチンリモデリング因子であるHELLSの作用によってヒストンが移動し、そこに、DNA維持メチル化酵素がDNAに誘導され、ヘミメチルDNAが順次メチル化されると考えられます。
今後の期待
本研究成果で明らかにしたHELLS-CDCA7のDNAメチル化制御の仕組みは多くの生物に共通していると考えられ、その普遍性から生命現象の理解に貢献すると期待できます。実際、私たちは植物も同様の仕組みを持っていることを示しました。
また、本研究成果は、DNAメチル化の異常が認められるがんや免疫疾患の治療や創薬への貢献も期待できます。
今後、新規DNAメチル化への関与など、HELLS-CDCA7の性質をさらに詳細に解析し、DNAメチル化制御のメカニズムを明らかにしていきます。
補足説明
- 1.ICF症候群
先天性免疫不全症候群に分類される遺伝病。免疫不全、染色体の不安定性、軽度の顔貌(がんぼう)異常が見られる。原因遺伝子としてDNAメチル化酵素遺伝子DNMT3B(補足説明[2]参照)、HELLS、CDCA7、CDCA7の転写促進因子であるZBTB24、UHRF1(補足説明[2]参照)が同定されている。ICFはImmunodeficiency Centromeric instability, Facial anomaliesの略。 - 2.DNAメチル化酵素、メチル化酵素阻害剤(GSK-3484862)
DNMT3AとDNMT3Bは、両側鎖がメチル化されていないDNAをメチル化する新規メチル化酵素である。DNMT1は、両側鎖がメチル化されているDNAが複製される際にできるメチル化されていない片側(新生)鎖をメチル化する維持メチル化酵素である。いずれもS-アデノシルメチオニンを基質として用いる。DNMT1はUHRF1タンパク質に誘導されてヘミメチルDNAを認識する。GSK-3484862はDNMT1の活性を阻害する薬剤である。 - 3.ヌクレオソーム、クロマチン
高等真核生物において、ゲノムDNAは、主としてヒストンH2A、H2B、H3、および、H4が二つずつ集まったヒストン8量体に巻き付いている。これをヌクレオソームと呼び、ヌクレオソームを基本単位とするゲノムDNAとタンパク質の高次複合体をクロマチンと呼ぶ。 - 4.クロマチンリモデリング因子
ヒストンの交換反応や移動といったクロマチンの構造変化を引き起こす因子の総称。クロマチンの構造が変化することによって、転写因子や酵素などの因子とDNAとの相互作用が可能となる。 - 5.ジンクフィンガードメイン(ZnF)
ジンクフィンガーモチーフを含む領域をジンクフィンガードメイン(ZnF)という。
ジンクフィンガーモチーフはDNAやRNAに結合する性質を持つタンパク質の部分配列の一つであり、複数のタイプがある。CDCA7が持つモチーフ(配列パターン)は、四つのCXXC配列(Cはシステイン残基、Xは任意のアミノ酸残基)から成る4CXXCタイプである。このタイプの機能はこれまで明らかにされていなかった。 - 6.α-ヘリックス構造
タンパク質の2次構造の共通モチーフの一つで、右巻きのらせんを形成している。 - 7.免疫染色
細胞や組織において、ある特定のタンパク質の局在を可視化する手法。標的タンパク質を特異的に認識する1次抗体と、1次抗体を抗原として認識し蛍光物質などが結合した2次抗体を用いることで、抗原の局在を顕微鏡で可視化する。 - 8.胚性幹細胞(ES細胞)
動物の胚盤胞(はいばんほう)から単離された細胞。自己複製能力を持つと同時に、分化多能性を持つ。ESはEmbryonic Stemの略。 - 9.ペリセントロメア領域
染色体のセントロメア(動原体)と隣接するクロマチン領域。マウスでは234塩基から成るメジャーサテライトと呼ばれる配列が1万回近くも繰り返されており、常に凝縮した状態にある。 - 10.細胞周期、S期
細胞は分裂を繰り返して増殖するが、このサイクルを細胞周期と呼ぶ。細胞分裂が起こるM(Mitosis)期と、DNAの複製が起こるS(Synthesis)期、それぞれの間をつなぐG1(Gap1)期、G2(Gap2)期がG1→S→G2→M→G1の順に進行する。
国際共同研究グループ
理化学研究所 開拓研究本部 眞貝細胞記憶研究室
上級研究員 新海 暁男(シンカイ・アケオ)
テクニカルスタッフⅠ 志村 知古(シムラ・チカコ)
研修生(当時)藤本 聖章(フジモト・ヒロアキ)
客員研究員 福田 渓(フクダ・ケイ)
主任研究員 眞貝 洋一(シンカイ・ヨウイチ)
トーマス・ジェファーソン大学(アメリカ)生化学・分子生物学科
博士研究員 橋本 秀春(ハシモト・ヒデハル)
准教授 エリック・デブラー(Erik W. Debler)
東京大学 定量生命科学研究所
准教授 堀越 直樹(ホリコシ・ナオキ)
教授 胡桃坂 仁志(クルミザカ・ヒトシ)
熊本大学発生医学研究所 幹細胞部門 多能性幹細胞分野
准教授 岡野 正樹(オカノ・マサキ)
教授 丹羽 仁史(ニワ・ヒトシ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究(研究領域提案型)「細胞分化にともなうクロマチンポテンシャルの変化とその分子基盤(研究代表者:眞貝洋一、18H05530)」「ヌクレオソーム高次構造とダイナミクスの解析によるクロマチン潜在能の解明(研究代表者:胡桃坂仁志、18H05534)」、同基盤研究(A)「ヒストンH3K9メチル化修飾による転写抑制の包括的理解(研究代表者:眞貝洋一、18H03991)」、同基盤研究(S)「クロマチンにおけるDNA修復機構の構造基盤の解明(研究代表者:胡桃坂仁志、23H05475)」、RIKEN internal research funds 「Pioneering project “Genome building from TADs”(研究代表者:眞貝洋一)」、日本医療研究開発機構(AMED)の生命科学・創薬研究支援基盤事業(BINDS)「エピジェネティクスの基盤原理解明と創薬のためのヒストンおよび再構成クロマチンの生産(研究代表者:胡桃坂仁志、JP23ama121009)」、科学技術振興機構(JST)戦略的創造研究推進事業(ERATO)「胡桃坂クロマチンアトラスプロジェクト(研究総括:胡桃坂仁志、JPMJER1901)」、および、National Institute of Allergy and Infectious Diseases (NIAID) grants from the National Institutes of Health (NIH)(to Erik W. Debler、R01 AI165840)による助成を受けて行われました。
本研究では、理研バイオリソース研究センターから提供されたバイオリソース(シロイヌナズナ完全長cDNAクローンpda08628、pda19584)を使用し、理研脳神経科学研究センター生体物質分析支援ユニットの支援を受けました。
原論文情報
- Akeo Shinkai, Hideharu Hashimoto, Chikako Shimura, Hiroaki Fujimoto, Kei Fukuda, Naoki Horikoshi, Masaki Okano, Hitoshi Niwa, Erik W. Debler, Hitoshi Kurumizaka, Yoichi Shinkai, "The C-terminal 4CXXC-type zinc finger domain of CDCA7 recognizes hemimethylated DNA and modulates activities of chromatin remodeling enzyme HELLS", Nucleic Acids Research, 10.1093/nar/gkae677
発表者
理化学研究所
開拓研究本部 眞貝細胞記憶研究室
上級研究員 新海 暁男(シンカイ・アケオ)
テクニカルスタッフⅠ 志村 知古(シムラ・チカコ)
客員研究員 福田 渓(フクダ・ケイ)
主任研究員 眞貝 洋一(シンカイ・ヨウイチ)
 新海 暁男
新海 暁男
 志村 知古
志村 知古
 福田 渓
福田 渓
 眞貝 洋一
眞貝 洋一
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
