理化学研究所(理研)脳神経科学研究センター 神経老化制御研究チーム(研究当時)の盛戸 貴裕 特別研究員(研究当時、現 神経細胞動態研究チーム 特別研究員)、西道 隆臣 チームリーダー(研究当時)らの共同研究グループは、アルツハイマー病(AD)[1]の患者において脳内に蓄積するアミロイドベータ(Aβ)[2]の分解酵素であるネプリライシン(NEP)[3]のAD発症リスク遺伝子変異[4]M8V変異[5]がAD発症へ影響を与える機序を解明しました。
本研究成果は、AD発症におけるAβ分解系の重要性を示しており、NEPを標的とした早期ADの治療法開発に貢献することが期待されます。
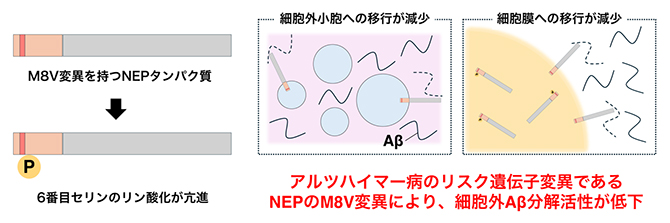
近年、NEPのM8V変異がAD発症のリスクとなることが発見されましたが、なぜM8V変異がAD発症を促進するのか、その詳細な機序は不明でした。本研究では、M8V変異はNEPの6番目のセリン(S6)のリン酸化を促進することによって、NEPの細胞表面や分泌顆粒(かりゅう)への移行を抑制し、NEPによる細胞外Aβの分解効率を低下させることを解明しました。このことは、NEPを中心とするAβ分解系の異常が、ADの疾患原因となり得ることを示しています。
本研究は、科学雑誌『The Journal of Neuroscience』オンライン版(4月29日付)に掲載されました。
アルツハイマー病発症におけるAβ分解酵素ネプリライシン(NEP)の機能解析
背景
アルツハイマー病(AD)は世界で最も患者数の多い、認知症の原因疾患です。ADは現在の科学では完全に進行を抑制することができないため、その克服を目指した治療法の開発が求められています。
AD患者の脳には、アミロイドベータ(Aβ)が蓄積した老人斑[6]が認められます。西道チームリーダーらはこれまで、Aβを分解する酵素であるNEPに着目し、その機能について研究を進めてきました。NEPは加齢とともに脳内で減少することが知られており、Aβ分解系の異常がADの原因の一つとなっていると考えられていますが、その重要性については明らかとなっていませんでした。特に、Aβを分解する酵素としてインスリン分解酵素(IDE)[7]も知られており、NEPとIDEの機能の違いは不明でした。
近年、ゲノムワイド関連解析(GWAS)[8]により、AD発症リスク遺伝子変異としてNEPのM8V変異が同定されました。この発見は、NEPによるAβ分解系の異常がADの疾患原因となることを裏付けています。しかし、NEPのAβ分解活性部位は細胞表面の細胞外領域に存在するのに対して、NEPの8番目のメチオニン(M8)は細胞内領域に存在します。M8V変異はAβを分解する部分の変異ではないため、表面的にはM8V変異がAβ分解に影響しないように思えます。そのため、なぜM8V変異がADの発症リスクとなるのか、M8V変異がAD発症リスクとなるのであればどのような機序によるのかについては分かっていませんでした。
そこで、共同研究グループは、NEPとIDEのAβ分解系への機序とともに、M8V変異によりNEPがAD発症へ与える影響の解明に挑みました。
研究手法と成果
共同研究グループはまず、NEPとIDEをそれぞれ欠損、もしくは両方を欠損させたAβ蓄積マウスを作製し、それらのAβ蓄積に与える影響を調べました。その結果、NEP欠損マウスはIDE欠損マウスと比較して、よりAβを蓄積するようになりました(図1A、B)。このことは、NEPがIDEよりもAβ分解酵素として重要な役割を有していることを示しています。また興味深いことに、NEP/IDE二重欠損マウスではAβの蓄積がさらに早まっていました。このことは、IDEがNEPの機能に対して補完的に働いていることを示しています。これらの実験結果は、NEPの機能不全がAβの蓄積に伴うAD発症を促進すること、その役割はIDEよりも大きなものであることを強く示唆しています。

図1 NEP、IDE、NEP/IDE欠損マウスにおけるAβ蓄積
- A:NEPもしくはIDE、またその両方を欠損したAβ蓄積マウスのAβ病理。だいだい色の着色部分(斑点)が脳内に蓄積したAβを示す。
- B:マウスの脳皮質におけるAβの蓄積割合。**: p(有意水準)<0.01、 ****: p<0.0001。
次に共同研究グループは、GWASで同定されたNEPのM8V変異の機能解析に取り組みました。
西道チームリーダーらは先行研究で、NEPの6番目のセリン(S6)がリン酸化[9]を受けることで、NEPの細胞膜への移行を阻害してAβの分解を抑制することを報告していました(図2A)。そこで、M8V変異がS6のリン酸化を促進することでAβ分解を抑制すると仮説を立て、培養細胞を用いた実験によって検証しました。
まず、通常のNEP、S6のリン酸化を防止することでNEPの細胞膜移行と細胞外Aβ分解を促すS6A変異[10]を有するNEP、M8V変異を有するNEP、またその両方の変異を有するNEPの4種類を、ヒト神経芽細胞腫細胞由来の培養細胞であるSH-SY5Y細胞[11]に発現させました。
それぞれのNEPを発現させたSH-SY5Y細胞における細胞外Aβの分解割合を評価したところ、M8V変異を導入したNEPでAβの分解割合が減少していました(図2B)。また、その減少効果は、S6のリン酸化を防止するS6A変異によって相殺されたため、S6のリン酸化がM8V変異によるNEPのAβ分解能低下に関わっていることが示されました。これらの結果は、M8V変異がS6のリン酸化を亢進(こうしん)させることで、NEPの細胞膜上への移行を抑えてAβの分解効率を低下させ、AD発症リスクを上昇させることを示唆しています。実際に、M8V変異を持つNEPではS6のリン酸化が増加したこと、細胞膜表面への局在が減少したことが本研究で示されています。

図2 NEP M8V変異の機能解析
- A:NEPの細胞膜構造。M8V変異は細胞表面の活性部位とは正反対の細胞内領域に存在する。
- B:培養細胞を用いた各NEP変異体による細胞外Aβの分解割合。****: p<0.0001。
今後の期待
本研究では、NEPがマウスのAβ分解系で重要な役割を担っていること、またNEPのAD発症リスク変異がNEPの細胞外Aβの分解能力を低下させることを明らかにしました。これらの実験事実は、NEPの機能不全がADの発症リスクとなることを裏付けています。今後、本研究成果などに基づいた、NEPの活性や発現を制御する早期ADの治療薬開発が期待されます。
補足説明
- 1.アルツハイマー病(AD)
日本で最も多い、認知症の原因疾患として知られる神経変性疾患。進行性、かつ不可逆な記憶障害を主な特徴とする。患者の脳内に「老人斑([6]参照)」と呼ばれる構造物が認められる。ADはAlzheimer's diseaseの略。 - 2.アミロイドベータ(Aβ)
ADの原因物質とされるペプチド。「老人斑([6]参照)」の主成分であり、Aβの蓄積がADの発症原因とされる。Aβを脳内から取り除く抗体療法により、ADの進行を抑制できることが近年明らかとなっており、認知症発症を防ぐためには、早期にAβの蓄積を予防することが重要だと考えられている。Aβはamyloid-βの略。 - 3.ネプリライシン(NEP)
西道 チームリーダーらが発見したAβの分解酵素。細胞膜タンパク質であり、酵素活性部位を細胞外に突出する構造を持っているため、細胞外のAβを分解することができる。NEPはneprilysinの略。 - 4.AD発症リスク遺伝子変異
ADの発症確率を高める、もしくは早期の発症を引き起こす遺伝子変異。多くの遺伝子変異が知られているが、その中でもAβの蓄積を促進する遺伝子変異が多いことから、AβがADの発症原因と考えられる一つの証拠となっている。 - 5.M8V変異
AD発症リスク遺伝子変異として同定されたNEP遺伝子変異の一つ。NEPの8番目のアミノ酸であるメチオニン(M)をバリン(V)に置換することから、M8V変異と呼ぶ。 - 6.老人斑
加齢に伴って脳内に沈着するタンパク質。主にAβを主成分とし、AD患者脳に大量に観察されることから、アルツハイマー病の原因物質であると考えられている。 - 7.インスリン分解酵素(IDE)
インスリンを分解する酵素として発見されたが、後にAβを分解することが示され、NEPと並んでAβを分解する酵素としても知られている。IDEはinsulin-degrading enzymeの略。 - 8.ゲノムワイド関連解析(GWAS)
ヒトの遺伝子情報を網羅的に解析することで、特定の疾患にかかりやすい遺伝子変異を発見する研究手法。疾患発症の予測や、疾患原因の同定に応用することができる。GWASはgenome-wide association studyの略。 - 9.リン酸化
タンパク質の翻訳後修飾の一つ。主にタンパク質に含まれるセリン残基やトレオニン残基で見られる。特定のアミノ酸のリン酸化により、タンパク質の性質が変化することがある。 - 10.S6A変異
NEPがリン酸化を受けるセリン残基をアラニン残基に置換した変異体。これによりNEPがリン酸化を受けなくなるため、細胞膜への移行が増加し、細胞外Aβの分解効率が増加する。 - 11.SH-SY5Y細胞
ヒト神経芽細胞腫細胞由来の培養細胞であり、神経細胞のモデル細胞としてよく使用される。
共同研究グループ
理化学研究所 脳神経科学研究センター
神経老化制御研究チーム(研究当時)
チームリーダー(研究当時)西道 隆臣(サイドウ・タカオミ)
特別研究員(研究当時)盛戸 貴裕(モリト・タカヒロ)
(現 神経細胞動態研究チーム 特別研究員)
研究員(研究当時)綿村 直人(ワタムラ・ナオト)
研究員(研究当時)垣矢 直雅(カキヤ・ナオマサ)
日本学術振興会特別研究員DC2(研究当時)高村 理沙(タカムラ・リサ)
研究パートタイマーⅠ(研究当時)津吹 聡(ツブキ・サトシ)
(現 認知症病態連携研究ユニット 研究パートタイマーⅠ)
テクニカルスタッフⅠ(研究当時)関口 みさき(セキグチ・ミサキ)
テクニカルスタッフⅠ(研究当時)釜野 直子(カマノ・ナオコ)
(現 研究基盤開発部門 動物資源開発支援ユニット テクニカルスタッフⅠ)
テクニカルスタッフⅠ(研究当時)斉 茉含(サイ・マガン)
認知症病態連携研究ユニット
ユニットリーダー 笹栗 弘貴(ササグリ・ヒロキ)
テクニカルスタッフⅠ 藤岡 亮(フジオカ・リョウ)
テクニカルスタッフⅠ 三平 尚美(ミヒラ・ナオミ)
滋賀医科大学 創発的研究センター
特任准教授 橋本 翔子(ハシモト・ショウコ)
特任助手 松葉 由紀夫(マツバ・ユキオ)
長崎大学 大学院 医歯薬学総合研究科
教授 岩田 修永(イワタ・ノブヒサ)
特任研究員 渡邊 かおり(ワタナベ・カオリ)
名古屋市立大学 大学院 医学研究科
教授 齊藤 貴志(サイトウ・タカシ)
研究支援
本研究は、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト(プロジェクトリーダー:宮脇敦史、岡野栄之)」の柱B「アルツハイマー病マーモセットモデル作出と解析(代表者:西道隆臣)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「βアミロイドーシスは何故タウ病理を促進するのか?(研究代表者:西道隆臣、23H02097)」からの助成を受け、理研脳神経科学研究センター動物資源開発支援ユニットの支援を受けて行われました。
原論文情報
- Takahiro Morito, Shoko Hashimoto, Risa Takamura, Naoto Watamura, Naomasa Kakiya, Ryo Fujioka, Naomi Yamazaki, Misaki Sekiguchi, Kaori Watanabe-Iwata, Naoko Kamano, Mohan Qi, Yukio Matsuba, Satoshi Tsubuki, Takashi Saito, Nobuhisa Iwata, Hiroki Sasaguri, Takaomi C. Saido., "The Role of Neprilysin and Insulin-Degrading Enzyme in the Etiology of Sporadic Alzheimer's Disease.", The Journal of Neuroscience, 10.1523/jneurosci.2152-24.2025
発表者
理化学研究所
脳神経科学研究センター 神経老化制御研究チーム(研究当時)
特別研究員(研究当時)盛戸 貴裕(モリト・タカヒロ)
(現 神経細胞動態研究チーム 特別研究員)
チームリーダー(研究当時)西道 隆臣(サイドウ・タカオミ)
 盛戸 貴裕
盛戸 貴裕
 西道 隆臣
西道 隆臣
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
