2025年5月17日
理化学研究所
株式会社ダイセル
日本医療研究開発機構
新規プレバイオティクスによる抗肥満作用の発見
-酢酸と腸内細菌代謝を介した糖質吸収抑制効果-
理化学研究所(理研)生命医科学研究センター 粘膜システム研究チームの大野 博司 チームディレクター、竹内 直志 特別研究員(研究当時)、株式会社ダイセル(本社:大阪市北区、代表取締役社長:榊 康裕)の島本 周 フェローらの共同研究グループは、消化管内で酢酸を特異的に増加させるセルロース試料である水溶性酢酸セルロース(WSCA)が腸内細菌に作用することで消化管からの糖質吸収を抑え、肥満を改善することを明らかにしました。
本研究成果は、プレバイオティクス[1]に基づく食品を介した肥満予防に貢献するものと期待されます。
今回、共同研究グループは、WSCAをマウスに投与した結果、肥満や高血糖、脂肪肝が改善すること、WSCAの効果により腸内環境の変化を介して吸収可能な単純糖質[2]を減少させること、および、WSCAが肝臓での糖質貯蓄を減少させることを突き止めました。
本研究は、科学雑誌『Cell Metabolism』オンライン版(5月16日付:日本時間5月17日)に掲載されました。
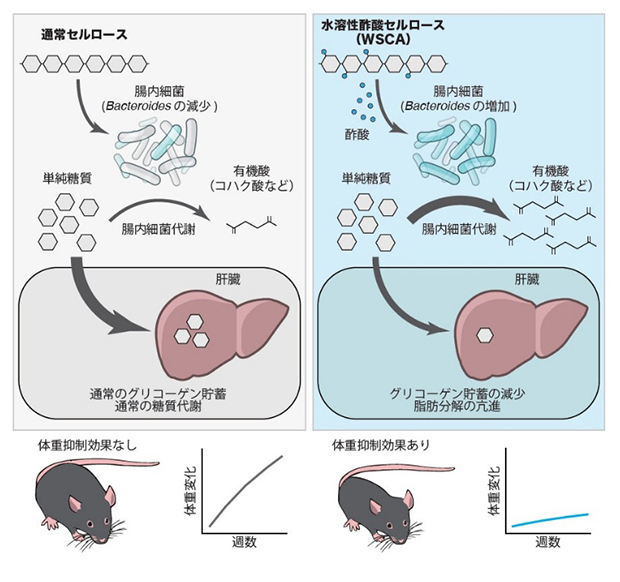
水溶性酢酸セルロース(WSCA)による腸内細菌を介した肥満抑制効果
背景
肥満は2型糖尿病や心臓病などいろいろな生活習慣病の基盤となる病態です。肥満は日本のみならず世界中で増加しており、その効果的な対策が望まれています。近年、GLP-1作動薬[3]などさまざまな治療法が開発され、実用化されていますが、投薬にかかるコストや副作用の懸念などから、安価で手軽な対策の開発が望まれています。
プレバイオティクスは消化管内で特定の腸内細菌に働きかけることでヒトに有益な効果をもたらす食品成分と定義されています。例えば、プレバイオティクスの一種である食物繊維は腸内細菌に代謝されて短鎖脂肪酸[4]など有益な代謝物[5]を増加させることや食物繊維を多く含む食事は健康増進につながることも知られています注1)。一方、ヒトの腸内細菌には個人差があることから、プレバイオティクスを効果的に分解して有益な代謝物を産生する細菌を保有するとは限らず、その効果が人それぞれ異なる理由の一つであると考えられます注2)。
そこで、共同研究グループは短鎖脂肪酸の一種である酢酸を消化管内で効果的に遊離するWSCAを作成し、どのような腸内環境であっても酢酸を増加させることができる手法を開発しました。大野チームディレクターらは以前の研究でWSCAが消化管の免疫機能を高めることを明らかにしましたが注3)、今回新たに代謝機能に対する効果を検証しました。
- 注1)Morrison, D.J. et al. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism. Gut Microbes. 2016 May 3;7(3):189-200.
- 注2)Kovatcheva-Datchary, P. et al. Dietary Fiber-Induced Improvement in Glucose Metabolism Is Associated with Increased Abundance of Prevotella. Cell Metab. 2015 Dec 1;22(6):971-82.
- 注3)Takeuchi, T. et al. Acetate differentially regulates IgA reactivity to commensal bacteria. Nature. 2021 Jul;595(7868):560-564.
研究手法と成果
共同研究グループは、WSCAをマウスに投与すると、マウスの体重増加が抑制されることを突き止めました(図1A)。この効果はその大部分が上部消化管で吸収される酢酸ナトリウムの投与では見られないため、消化管内で酢酸を増加させるWSCAに特徴的であることが分かりました。さらに、肥満マウス[6]にWSCAを投与したところ、高血糖や脂肪肝などが改善することが判明しました(図1B~D)。一方、他の短鎖脂肪酸であるプロピオン酸、酪酸の効果も同様の方法で調べましたが、体重増加などに変化は見られませんでした。
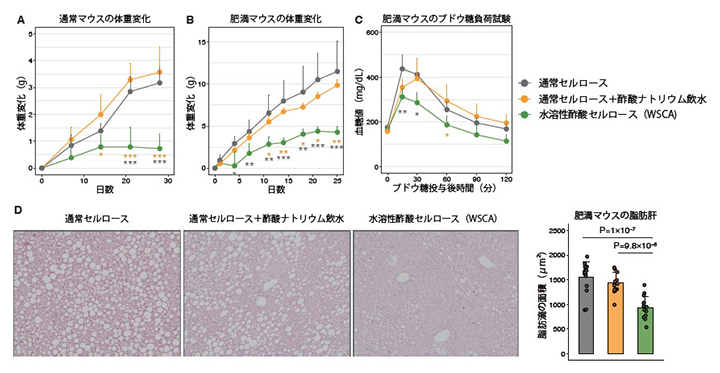
図1 水溶性酢酸セルロース(WSCA)による体重抑制効果
- A:通常マウスにおける体重変化。WSCA群では体重抑制効果が見られた。
- B:肥満マウスにおける体重変化。WSCA群では体重抑制効果が見られた。
- C:肥満マウスにおけるブドウ糖負荷試験時の血糖変化。ブドウ糖の投与によりマウスは高血糖を呈するが、WSCA群では血糖降下効果が見られた。
- D:肥満マウスにおける脂肪肝の組織像および脂肪滴面積の測定。脂肪滴は円形の空白として観察されるが、WSCA群ではその面積が減少した。
A~Cのアスタリスク(*)はWSCA群と他二群との統計的有意差を示す(*P<0.05、**P<0.01、***P<0.001、灰色:WSCA群 vs 通常セルロース群、オレンジ色:WSCA群 vs 酢酸ナトリウム群)。
次に共同研究グループはWSCAがマウスの代謝に及ぼす影響を調べました。その結果、WSCAは脂肪分解の代謝を促進するとともに、糖質代謝を抑制することが分かりました(図2A)。特に肝臓におけるグリコーゲン[7]の貯蔵量が減少していたことから(図2B)、WSCAが消化管からの糖質吸収に影響を与えている可能性があるのではないかと考えました。
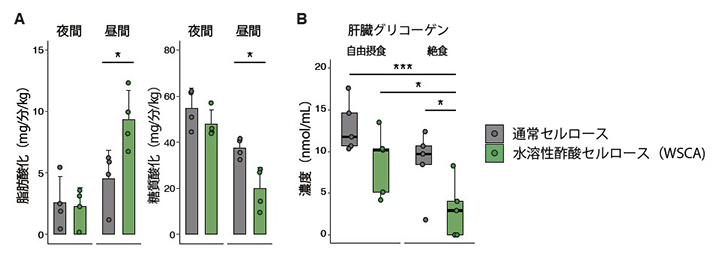
図2 水溶性酢酸セルロース(WSCA)による宿主代謝に対する効果
- A:マウス代謝パラメータの測定。夜間、昼間の脂肪および糖質酸化(分解)を示す。なお、マウスは主に夜間に摂食、行動する。WSCA群では昼間の脂肪酸化が亢進(こうしん)し、糖質酸化が抑制された。
- B:自由摂食および絶食下のマウス肝臓グリコーゲンの測定。WSCAは肝臓グリコーゲンを減少させた。アスタリスク(*)は統計的有意差を示す(*P<0.05、***P<0.001)。
そこで、WSCAが腸内環境に与える影響を調べたところ、WSCAは消化管内の代表的なヒト腸内細菌であるBacteroides目の細菌を増加させていました(図3A)。また、通常マウス、Bacteroides thetaiotaomicron菌の単独定着マウス[8]、および無菌マウス[8]いずれにおいても消化管内の酢酸濃度を増加させたものの、無菌マウスでは体重抑制効果が見られませんでした(図3B)。さらに、WSCAは消化管内においてマウスが分解・吸収可能な麦芽糖などの単純糖質を減少させましたが、この効果は無菌マウスでは見られませんでした(図3C)。
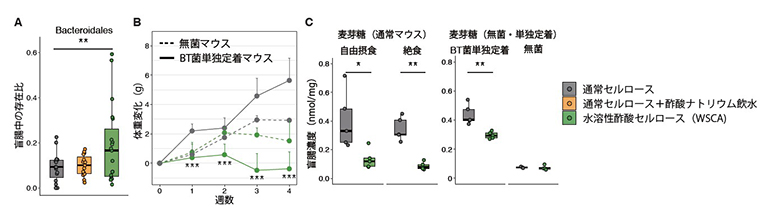
図3 水溶性酢酸セルロース(WSCA)の腸内環境に対する効果
- A:盲腸内容物中のBacteroidales目の存在比。WSCA群では同細菌種が増加した。
- B:無菌マウスおよびBacteroides thetaiotaomicron(BT)菌単独定着マウスにおける体重変化。BT菌単独定着マウスではWSCAによる体重抑制効果が見られたが、無菌マウスでは見られなかった。
- C:単純糖質の一種である麦芽糖の通常マウス、BT菌単独定着マウス、および無菌マウスにおける盲腸内容物中の濃度。通常マウスおよびBT菌単独定着マウスにおいてWSCAは麦芽糖を減少させたが、無菌マウスでは減少が見られなかった。
A~Cのアスタリスク(*)は統計的有意差を示す(*P<0.05、**P<0.01、***P<0.001)。BのアスタリスクはBT菌単独定着マウスの二群間検定の結果を示す。
最後に、共同研究グループは酢酸が腸内細菌に与える直接的な効果を調べました。その結果、酢酸はBacteroides thetaiotaomicron菌の増殖を促すことで糖質消費を加速させること、また、同菌の糖質代謝に関わる遺伝子の発現を増やすことが分かりました。
以上の結果から、WSCAは消化管内で酢酸を増加させることで、Bacteroides thetaiotaomicron菌をはじめとする腸内細菌による糖質消費を促進し、その結果、消化管からの糖質吸収を制限して体重増加を抑制する効果をもたらすことが明らかになりました。
今後の期待
本研究ではWSCAによって消化管内で増加した酢酸が腸内細菌の糖代謝機能を変化させ、結果として消化管からの糖質吸収を低下させることで体重抑制効果をもたらす可能性を示しました。WSCAは短鎖脂肪酸の一種である酢酸を効果的に消化管に届けることが可能な新規プレバイオティクスとして、投薬に比べて安価で手軽であることから、食品分野への応用も期待できます。従来の食物繊維素材に比べてより安定的な効果が見込まれ、今後、実用化を目指して安全性とヒトにおける抗肥満作用の検証が望まれます。
補足説明
- 1.プレバイオティクス
消化管内で特定の腸内細菌に働きかけることでヒトに有益な効果をもたらす食品成分。食物繊維やオリゴ糖などを含む。 - 2.単純糖質
宿主が吸収可能な単糖や二糖を指す。主にブドウ糖、ショ糖、麦芽糖などを含む。単純糖質は、より複雑な複合糖質がヒト由来の酵素、もしくは腸内細菌由来の酵素により分解されて生成される。複合糖質はヒト体内に吸収されない一方、単純糖質は吸収可能なため、ヒトの代謝生理に影響を与える。 - 3.GLP-1作動薬
血糖値を下げるインスリンの分泌を促し、食欲も抑えるホルモンであるGLP-1を補う薬。主に2型糖尿病の治療に使われ、体重減少の効果も知られている。 - 4.短鎖脂肪酸
一般に、炭素数6以下の直鎖状の脂肪酸を指す。腸内細菌が産生する主要な有機酸。酢酸、プロピオン酸、酪酸など。過去の研究により、免疫システムへのさまざまな効果が知られている。 - 5.代謝物
細胞や細菌が代謝によりつくる脂肪酸、アミノ酸、糖、ビタミンなどの低分子化合物。腸内細菌が産生する代謝物はヒトや動物体内では合成が不可能な物質も多く、食事由来成分から腸内細菌独自の機能で合成される。腸内細菌の種類によって合成される代謝物は異なる。 - 6.肥満マウス
肥満の病態を解析するためのモデルマウス。本研究ではob/obマウス(食欲抑制ホルモンであるレプチンをつくる遺伝子に生まれつき変異があるため、満腹感を感じにくく過食になってしまい、結果として著しい肥満や高血糖の症状を示すマウス)を用いた。 - 7.グリコーゲン
グルコース(ブドウ糖)が重合した多糖で、枝分かれが非常に多い構造の高分子。肝臓と骨格筋で主に合成され、エネルギーの貯蔵物質として知られる。 - 8.単独定着マウス、無菌マウス
無菌マウスとは腸内細菌や皮膚表面などの常在細菌が全く存在しないマウスを指す。無菌アイソレーターと呼ばれる内部を無菌状態に保つことができる特殊な飼育装置に、帝王切開で無菌操作により取り出した胎児マウスを搬入し、飼育することで得られる。また、無菌マウスに特定の1種類の細菌のみを導入して作出するマウスを単独定着マウスと呼ぶ。一般のマウスと異なり、存在する腸内細菌を厳密に制御できるため、特定の腸内細菌とマウスの表現型との因果関係を調べるのに適している。
共同研究グループ
理化学研究所 生命医科学研究センター
粘膜システム研究チーム
チームディレクター 大野 博司(オオノ・ヒロシ)
特別研究員(研究当時)竹内 直志(タケウチ・タダシ)
上級研究員(研究当時)宮内 栄治(ミヤウチ・エイジ)
(現 客員研究員、群馬大学 生体調節研究所 粘膜エコシステム制御分野 准教授)
研究員(研究当時)中西 裕美子(ナカニシ・ユミコ)
専門技術員 加藤 完(カトウ・タモツ)
テクニカルスタッフⅡ 青木(川住)雅美(アオキ(カワズミ)・マサミ)
テクニカルスタッフⅡ 橘 直子(タチバナ・ナオコ)
テクニカルスタッフⅡ 伊藤 鮎美(イトウ・アユミ)
大学院生リサーチアソシエイト(研究当時、現 客員研究員)谷口 勝城(ヤグチ・カツキ)
研修生(研究当時)伊藤 祐介(イトウ・ユウスケ)
株式会社ダイセル
研究開発本部 事業創出センター
フェロー 島本 周(シマモト・シュウ)
ヘルスケアSBU 事業推進室事業戦略グループ
アドバイザー 松山 彰収(マツヤマ・アキノブ)
群馬大学 生体調節研究所 粘膜エコシステム制御分野
教授 佐々木 伸雄(ササキ・ノブオ)
京都大学 大学院生命科学研究科 生体システム学分野
教授 木村 郁夫(キムラ・イクオ)
研究支援
本研究は、理化学研究所独創的研究提案制度「共生の生物学」、同横断プロジェクト「共生」により実施し、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「宿主ー腸内細菌叢相互作用が宿主の病理に及ぼす影響の研究(研究代表者:大野博司)」、日本医療研究開発機構(AMED)ムーンショット型研究開発事業目標7「健康寿命伸長に向けた腸内細菌動作原理の理解とその応用(プロジェクトマネージャー:慶應義塾大学本田賢也、分担者:大野博司)」による助成を受けて行われました。
本研究は株式会社ダイセルとの共同研究として実施され、その一部は株式会社ダイセルから提供された研究費によって実施されたものです。本稿の内容および結論に株式会社ダイセルの影響はありません。
*AMEDでは、ムーンショット型研究開発事業の目標7「2040年までに、主要な疾患を予防・克服し100歳まで健康不安なく人生を楽しむためのサステイナブルな医療・介護システムの実現」の達成にむけて研究開発を推進しています。
原論文情報
- Tadashi Takeuchi, Eiji Miyauchi, Yumiko Nakanishi, Yusuke Ito, Tamotsu Kato, Katsuki Yaguchi, Masami Kawasumi, Naoko Tachibana, Ayumi Ito, Shu Shimamoto, Akinobu Matsuyama, Nobuo Sasaki, Ikuo Kimura, Hiroshi Ohno, "Acetylated Cellulose Suppresses Body Mass Gain through Gut Commensals Consuming Host-Accessible Carbohydrates", Cell Metabolism, 10.1016/j.cmet.2025.04.013
発表者
理化学研究所
生命医科学研究センター 粘膜システム研究チーム
チームディレクター 大野 博司(オオノ・ヒロシ)
特別研究員(研究当時)竹内 直志(タケウチ・タダシ)
株式会社ダイセル
フェロー 島本 周(シマモト・シュウ)
 大野 博司
大野 博司
 島本 周
島本 周
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
株式会社ダイセル 研究開発本部 事業創出センター
Tel: 03-6711-8162(島本、恩地)
AMED事業に関する問い合わせ先
日本医療研究開発機構(AMED)
シーズ開発・基礎研究事業部挑戦的研究開発課
Tel: 03-6870-6893、Email: moonshot@amed.go.jp
