2025年5月19日
理化学研究所
サントリーウエルネス株式会社
京都大学iPS細胞研究所
ヒトiPS細胞を用いて神経細胞における脂質の役割を解明
-高度不飽和脂肪酸が神経機能と脳病態を制御する-
理化学研究所(理研)バイオリソース研究センター iPS創薬基盤開発チームの森田 賢 客員研究員(サントリーウエルネス株式会社 生命科学研究所 研究員)、近藤 孝之 客員研究員(京都大学 iPS細胞研究所特定拠点 講師)、井上 治久 チームディレクター(革新知能統合研究センター iPS細胞連携医学的リスク回避チーム 客員主管研究員、京都大学 iPS細胞研究所 教授)らの共同研究チームは、ヒト人工多能性幹細胞(iPS細胞)[1]から作製した神経細胞を解析することで、細胞の脂質膜を構成するさまざまな種類の脂肪酸の組成比の変化が、神経細胞の機能と脳病態生理に大きな影響を及ぼすことを発見しました。
本研究成果は、ドコサヘキサエン酸(DHA)やアラキドン酸(ARA)などの高度不飽和脂肪酸(PUFA)[2]が豊富に存在するヒトの脳特有の脂質構成の重要性を示唆するとともに、脂質が関わる多様な疾患のモデル構築と治療法開発、さらには多数サンプルの疾患表現型を一度に効率よく解析するための基盤開発に貢献すると期待されます。
本研究は、科学雑誌『iScience』オンライン版(5月11日付)に掲載されました。
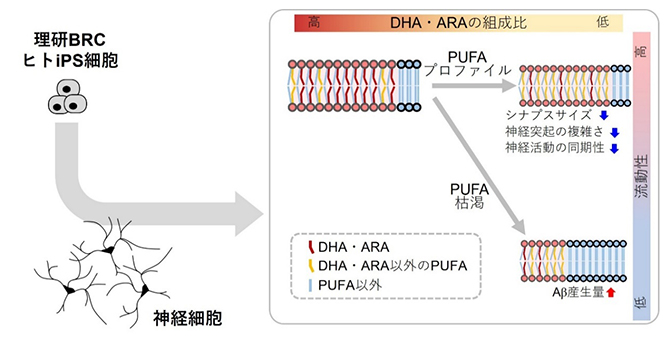
本研究の概要
背景
脂質は、脳の乾燥重量の半分以上を占めます。脂質の中でもドコサヘキサエン酸(DHA)やアラキドン酸(ARA)といった高度不飽和脂肪酸(PUFA)は、脳に特に多く存在し、この摂取や欠乏を通じて脳機能へ影響します。しかし、神経細胞の機能と脳病態生理における脂肪酸の役割は、完全には解明されていませんでした。
これまで、ヒトiPS細胞から分化誘導して作製した神経細胞は、培養皿内でヒトの神経細胞の機能と脳病態生理を評価するためのモデルとして利用されてきました。しかしながら、ヒトの特徴的な脂質膜の状態を再現するモデル化はなされていませんでした。本研究では、ヒトiPS細胞由来の神経細胞を用いて、異なる脂質培養条件で神経細胞の脂質膜の状態をさまざまに変化させ、神経細胞の機能と脳病態生理への作用を解析しました。
研究手法と成果
共同研究チームは、理研バイオリソース研究センターに寄託された健常者由来のヒトiPS細胞を使って神経細胞を作製しました。まず、PUFAが枯渇している条件において神経細胞を培養した後、培地中にDHAやARAを添加することでPUFAの枯渇状態が解消し、脂質膜を構成するPUFAの比率が高まるとともに、細胞の脂質膜の流動性[3]が高まっていることを見いだしました。このとき、生成過程において流動性の影響を受けることが知られているアルツハイマー病病因分子として脳病態に関わるアミロイドβ(Aβ)[4]の産生量は、流動性が高い条件で低下しました(図1)。
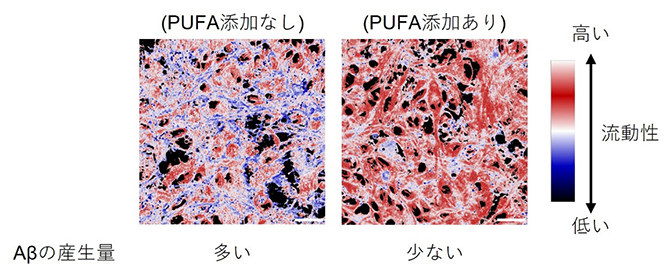
図1 脂質膜流動性とAβ産生量の評価
神経細胞に脂質膜の流動性を測定するためのプローブを導入し、PUFAを添加せずに培養した神経細胞と、PUFAを添加して培養した神経細胞の脂質膜の流動性を比較した。流動性が低い部分を青、流動性が高い部分を赤で示している。PUFAを添加した神経細胞の流動性が高まり、Aβの産生量は流動性が高い状態で低下した。スケールバーは20マイクロメートル(μm、1μmは1,000分の1ミリメートル)。
次に、PUFA枯渇状態ではないものの、DHAやARAの量が少ない条件において神経細胞を培養しました。この条件で、DHAやARAを培地中に添加することで、脂質膜を構成するPUFAの比率と脂質膜の流動性に変化は確認されませんでしたが、PUFAのうちDHAとARAの組成比が高まっていました。このとき、神経細胞の機能の基盤となる重要な構造であるシナプス[5]のサイズが大きくなっていることが観察されました(図2)。
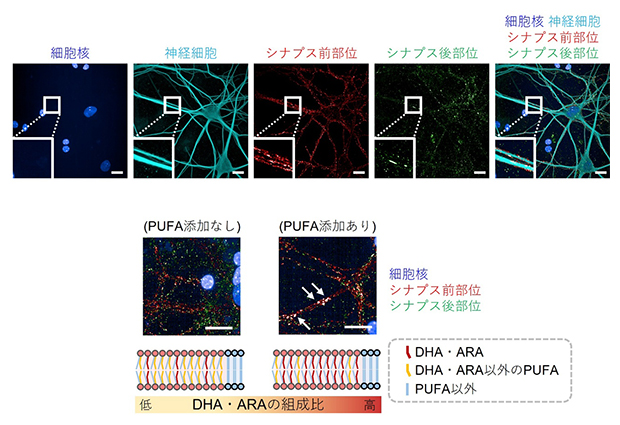
図2 シナプスの評価
- (上)細胞核(青)、神経細胞(水色)、シナプス前部位(赤)、シナプス後部位(緑)にそれぞれ特異的なマーカーで染色した画像。スケールバーは20μm。
- (下)PUFAを添加して培養した神経細胞では、添加しなかった場合より、免疫染色では、サイズの大きなシナプスを形成していた(白矢印)。スケールバーは20μm。
さらに、神経細胞の形態を詳しく観察したところ、DHAやARAを添加した培養条件では、神経突起[6]が長くなり、神経突起の枝別れが多い、より複雑な形態を形成していました(図3)。
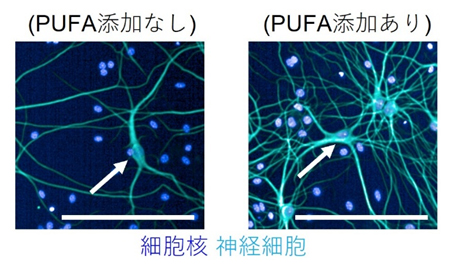
図3 神経突起の評価
神経細胞に特異的なマーカー(水色)で染色した画像。PUFAを添加なしで培養した神経細胞より、PUFAを添加して培養した神経細胞の方が、多くの神経突起を有していた。細胞核は青のマーカーで示した。スケールバーは200μm。
神経細胞の大きなシナプスと複雑な形態形成から、DHAやARAにより神経細胞同士のつながりが変化している可能性が考えられました。そこで、多電極アレイシステム[7]を用いて神経細胞の活動を経時的に測定したところ、培養期間が長くなると神経活動の同期性[8]が高まることが分かりました(図4)。
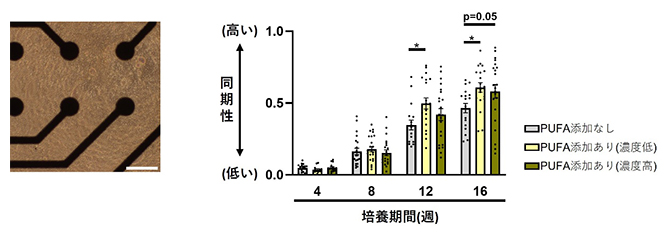
図4 神経活動の評価
- (左)培養皿上に配置した微小電極(マッチ棒様の形)で、神経細胞の電気活動を測定している。スケールバーは200μm。
- (右)細胞の培養期間に依存して神経活動の同期性が高まることに加えて、PUFAを添加して培養した細胞において、さらに同期性が高まっていた。「*」は統計的に有意な変化であることを示す。
これらの結果から、ヒトiPS細胞から作製した神経細胞において、脂質膜を構成するPUFAとしての組成比、ならびにPUFAを構成している脂肪酸プロファイル(個々の脂肪酸の組成比)の両者が、神経細胞の機能と脳病態生理に重要な役割を果たす可能性が示されました。また、これらの脂質に関連する表現型解析は、多数のサンプルを短い時間で一度に処理をすることができる解析系として構築されたことから、より広範な病態の脂質関連表現型解析の基盤となることが期待されます。
今後の期待
本研究では、ヒトiPS細胞から作製した神経細胞を利活用することで、神経細胞の機能とAβの産生過程という脳病態生理におけるPUFAの役割を示しました。DHAやARAなどのPUFAが豊富に存在するヒトの脳特有の脂質構成の重要性を示唆するとともに、本研究で得られた知見を基に、今後、脂質が関わる多様な疾患のモデル構築と治療法の研究、さらには多数サンプルの疾患表現型を一度に効率よく解析するための基盤開発に役立つことが期待されます。
補足説明
- 1.人工多能性幹細胞(iPS細胞)
血液や皮膚の細胞にOct3、Sox2、Klf4遺伝子などを導入することで人工的に作製される。培養皿内で無限に増やすことができ、かつ、多様な種類の体細胞に分化させることができる。 - 2.高度不飽和脂肪酸(PUFA)
脂肪酸とは、食品中の脂肪の主成分であり、生体内ではエネルギー源や脂質膜の構成要素として利用されたりする。高度不飽和脂肪酸は分子内に複数の不飽和結合を持つ脂肪酸で、日常の食事から摂取されている。特に脳に多く存在する代表的な高度不飽和脂肪酸に、青魚に多いドコサヘキサエン酸(DHA)と、肉類や卵に多いアラキドン酸(ARA)がある。PUFAはpolyunsaturated fatty acidの略。 - 3.脂質膜の流動性
細胞内の脂質膜とは、細胞内に存在する脂質二重層でできた膜構造。流動性とは、脂質膜を構成する脂質分子が自由に動き回れる性質のことで、温度や脂質の種類によって変化し、膜タンパク質の機能などに影響する。 - 4.アミロイドβ(Aβ)
脳内でつくられるタンパク質の一種で、通常は分解・排出されるが、過剰に蓄積すると脳内で凝集し、アルツハイマー病の病因分子として脳内に沈着する。 - 5.シナプス
神経細胞間の情報伝達を行う接続部位。シナプス前部位、シナプス間隙(かんげき)、シナプス後部位から構成され、神経伝達物質を使って別の神経細胞へと信号を伝える役割を持つ。 - 6.神経突起
神経細胞から伸びる枝のような構造。これらは複雑に枝分かれして神経細胞同士をつなぎ、情報を伝達する役割を果たす。 - 7.多電極アレイシステム
培養皿上に多数の微小電極が配置されており、培養している神経細胞の電気活動を経時的に測定する。 - 8.神経活動の同期性
複数の神経細胞が同じタイミングで活動(発火)すること。
共同研究チーム
理化学研究所 バイオリソース研究センター
iPS創薬基盤開発チーム
客員研究員 森田 賢(モリタ・サトシ)
(サントリーウエルネス株式会社 生命科学研究所 研究員)
客員研究員 近藤 孝之(コンドウ・タカユキ)
(京都大学 iPS細胞研究所 特定拠点講師)
チームディレクター 井上治久(イノウエ・ハルヒサ)
(革新知能統合研究センター iPS細胞連携医学的リスク回避チーム 客員主管研究員、京都大学 iPS細胞研究所 教授)
サントリーウエルネス株式会社 生命科学研究所
所長 中尾 嘉宏(ナカオ・ヨシヒロ)
研究支援
本研究の一部は、日本医療研究開発機構(AMED)再生・細胞医療・遺伝子治療プロジェクト「脳細胞ヒト化による神経病態と免疫応答解析の基盤技術開発(研究代表者:井上治久、JP23bm1423012)」、同脳神経科学統合プログラム(Brain/MINDS 2.0)「認知症保護的バリアントの機能解明に基づく治療の研究開発(研究代表者:井上治久、JP24wm0625501)」の助成により行われました。また、本研究には理研バイオリソース研究センターから提供されたバイオリソース(ヒトiPS細胞株HPS1043、HPS1046)が使用されました。
原論文情報
- Satoshi Morita, Takayuki Kondo, Hisanori Tokuda, Yoshihisa Kaneda, Takayuki Izumo, Yoshihiro Nakao, Haruhisa Inoue, "Polyunsaturated fatty acids in lipid membranes regulate human neuronal function and amyloid-β production", iScience, 10.1016/j.isci.2025.112557
発表者
理化学研究所
バイオリソース研究センター iPS創薬基盤開発チーム
客員研究員 森田 賢(モリタ・サトシ)
(サントリーウエルネス株式会社 生命科学研究所 研究員)
客員研究員 近藤 孝之(コンドウ・タカユキ)
(京都大学 iPS細胞研究所 特定拠点講師)
チームディレクター 井上 治久(イノウエ・ハルヒサ)
(革新知能統合研究センター iPS細胞連携医学的リスク回避チーム 客員主管研究員、京都大学 iPS細胞研究所 教授)
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
京都大学 iPS細胞研究所(CiRA)国際広報室
Tel: 075-366-7005
Email: media@cira.kyoto-u.ac.jp
