理化学研究所(理研)生命医科学研究センター 粘膜システム研究チームの山崎 和久 客員主管研究員(新潟大学 名誉教授)、宮内 栄治 客員研究員(群馬大学 生体調節研究所 粘膜エコシステム制御分野 准教授)、大野 博司 チームディレクターらの国際共同研究グループは、歯周病[1]以外に全身的な疾患のない患者と歯周病を含む全身的な疾患のない健康な対象者の唾液、ならびにふん便中の細菌叢(そう)を網羅的に解析し、歯周病患者では唾液中の細菌叢だけでなく腸内細菌叢にも乱れが生じていることを突き止めました。また、歯周病を治療することで唾液中の細菌叢だけでなく、腸内細菌叢も変化することを明らかにしました。
本研究成果は、ヒトにおいても腸内細菌叢が病的口腔細菌叢の影響を受けることを示すとともに、歯周病治療・予防により健全な口腔細菌叢を回復し、それを維持することが全身の健康にとっても重要であることを明確に示唆しています。
本研究は、科学雑誌『Journal of Oral Microbiology』オンライン版(5月8日付)に掲載されました。
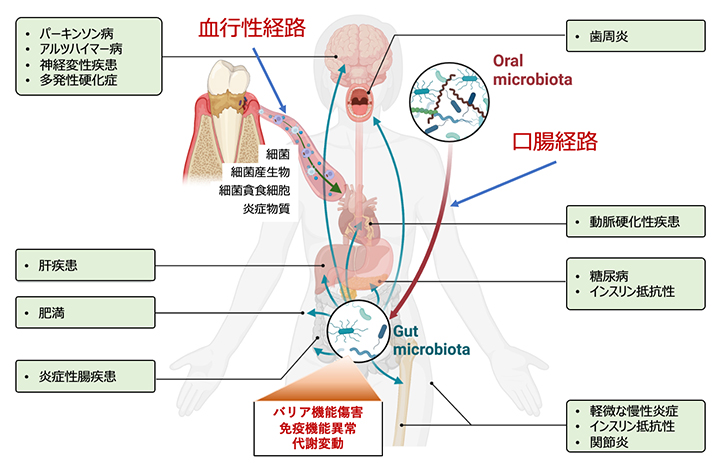
歯周病が全身疾患に影響を与える因果メカニズム
背景
歯周病は、病気の進行に伴い、歯周ポケットと呼ばれる、歯と歯肉の境界に深い溝が形成され、そこでは嫌気性菌を主体とする細菌が増殖してバイオフィルム(デンタルプラーク)を形成しています。深い歯周ポケット内では細菌叢の構成が変化するとともに、多様性が高くなっており、新たな"歯周病原細菌[2]"と考えられる菌種も複数報告されています。
近年の疫学研究により、歯周病は口腔内固有の疾患であるのみならず、心血管疾患、2型糖尿病、代謝機能障害関連脂肪性肝疾患(MASLD、旧:非アルコール性脂肪性肝疾患)、関節リウマチ、炎症性腸疾患、アルツハイマー病、ある種のがんなど、口腔からは遠隔の組織・臓器の疾患リスクを有意に上昇させることが報告されています。
これらの因果関係を説明するメカニズムとして、①歯周炎病変部から侵入した細菌による菌血症、②病変部で産生された炎症メディエーター(炎症の発生や増幅につながる物質)の血中への流入が考えられてきました。これは、歯周炎により形成された歯周ポケット内には多量の細菌が生息しており、一部の細菌は組織浸入性が高いこと,歯周ポケット内面の上皮は細菌と炎症の影響で一部潰瘍化していること、炎症歯周組織では多量の炎症メディエーターが産生されていることから想起されました。実際、歯周炎患者血中からは歯周病原細菌をはじめとする口腔細菌の遺伝子が検出され、歯周炎を有する全身性の疾患患者の動脈硬化病変、心臓弁、滑膜組織、肝臓などからは歯周病原細菌のDNAが検出されています。また、歯周炎患者血中の炎症マーカー(高感度CRP)は歯周病の重症度と比例して上昇し、治療により低下することが示されています。
しかし、歯周病原細菌の検出頻度は比較的高いものの、血中の歯周病原細菌のDNAコピー数は概して少なく、その他の口腔細菌や腸内細菌の検出率・相対頻度の方がはるかに高いという報告もあります。また、歯周病の結果上昇した血中のサイトカイン濃度が、全身疾患の発症や進行を引き起こすに足りるというエビデンスは不足しています。さらに、血中の高感度CRPの上昇が歯周病に罹患(りかん)した歯周組織に由来する炎症性サイトカインの直接的影響によるものかも明らかになっていません。このように、従来の因果メカニズムでは歯周病と全身疾患の関連は十分に説明できませんでした。
近年、腸内細菌叢の乱れ(ディスバイオーシス)がさまざまな疾患のリスクを高めることが明らかになっていますが、それらの疾患は歯周病とも密接に関係しています。山崎客員主管研究員らのグループは代表的な歯周病原細菌Porphyromonas gingivalisをマウス口腔から投与すると,腸内細菌叢の乱れが誘導されることを世界で初めて報告しました注)。その後、世界中でさまざまな疾患モデル動物に歯周病原細菌や歯周病患者唾液細菌を投与したときに腸内細菌叢の変化を介して病態が悪化することが報告され、口腔細菌の腸内細菌叢への影響が注目されるようになっていますが、ヒトでは明らかになっていません。
国際共同研究グループは腸内細菌叢が歯周病患者において健康な人とどう違うのかを明らかにしようと挑みました。
- 注)Kei Arimatsu et al. Oral pathobiont induces systemic inflammation and metabolic changes associated with alteration of gut microbiota. Scientific Reports. 2014 May 6:4:4828.doi: 10.1038/srep04828.
研究手法と成果
本研究には、過去に系統的歯周治療を受けていない中等度から重度の歯周炎患者30人および対照として口腔内が健康な(う蝕(歯質融解)・歯周炎を有さない)23人のいずれも全身的には健康な人に、インフォームドコンセントを得た上で参加してもらいました。歯周病の検査を行った上で、唾液、血液を採取するとともにふん便を採取しました。患者については歯周病治療終了後に再びサンプリングを実施しました。唾液・ふん便中の細菌叢はメタ16S rRNA遺伝子解析[3]を行い、血液についてはNMRを用いたメタボローム解析[4]とサイトカインの解析を行いました。
歯周病患者の唾液細菌叢はすでに健常者とは違うことは知られていますが、唾液に含まれる細菌の種類は増加していました(α多様性[5]の上昇)。その特徴として、いわゆる歯周病原細菌と呼ばれる細菌種が増加していました。腸内細菌叢ではそこに含まれる細菌の種類が減少することは一般に良くないこととされていますが、歯周病では逆に健康なときと比べて細菌の種類が増えています。健康な人と比較すると個々の細菌の占める割合(β多様性[6])も大きく変化していました。治療によって唾液細菌叢は健康な人のものに近づくことが示されました。ここまでは従来の研究でも証明されていたことです(図1)。
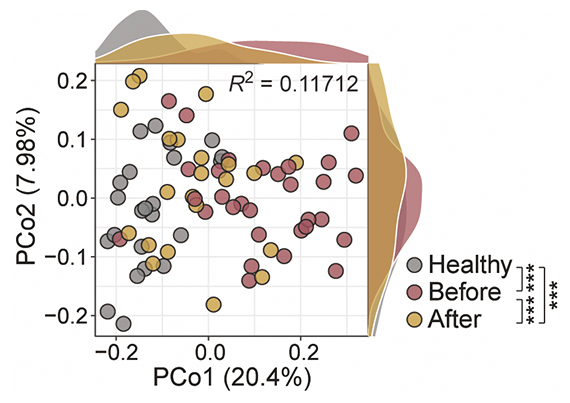
図1 歯周病患者と健康な人の唾液細菌叢の違い
それぞれの○は各被験者の唾液細菌叢を示す。それぞれの○間の距離が大きいほど細菌叢が異なる。歯周病治療により健康な人に近づいていることが分かる。縦軸と横軸は検体間の違いの大きさを、R2は決定係数を示す。縦軸と横軸の数値(7.98%、20.4%)は主座標分析(Principal Coordinate Analysis:PCoA)によるデータの持つ情報量の何%を説明しているかの寄与率を示す。
Healthy:健康な人、Before:歯周病患者治療前、After:歯周病患者治療後。「***」:有意水準0.1%での有意差あり。
一方、これまで明らかにされていなかった日本人の歯周病患者の腸内細菌叢ですが、治療前の歯周病患者では健康な人と比較して、腸内細菌に含まれる細菌の種類は増加していました。また、腸内細菌の構成も健康な人と比較して異なっていました。口腔が健康な人では短鎖脂肪酸[7]を産生するとされる細菌種が優勢であったのに対し、歯周病患者ではパルミチン酸のような飽和脂肪酸合成に関係する細菌種が優勢でした。さらに、徹底した歯周病治療を行うことで、唾液細菌叢ほどの明確さは示されませんでしたが、腸内細菌叢も健康な人に近づくことが明らかになりました(図2)。
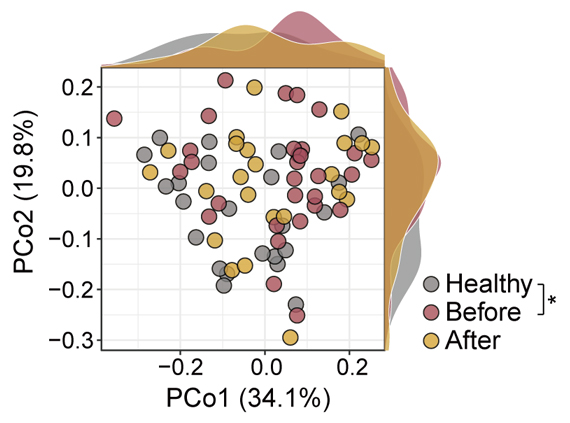
図2 歯周病患者と健康な人の腸内細菌叢の違い
それぞれの○は各被験者の腸内細菌叢を示す。それぞれの○間の距離の違いが大きいほど細菌叢が異なる。健康な人と歯周病患者では分布に違いがあることが分かる。縦軸と横軸は検体間の違いの大きさを、R2は決定係数を示す。縦軸と横軸の数値(19.8%、34.1%)は主座標分析(Principal Coordinate Analysis:PCoA)によるデータの持つ情報量の何%を説明しているかの寄与率を示す。
Healthy:健康な人、Before:歯周病患者治療前、After:歯周病患者治療後。「*」有意水準5%での有意差あり。
健康な人、歯周病患者を問わず唾液細菌叢のα多様性が高い人は腸内細菌叢のα多様性も高いという明確な正の相関関係が認められました。唾液細菌叢は口腔内の細菌量、歯周炎の病態、特に炎症の強さと範囲が大きくなるほどα多様性が大きくなりましたが、腸内細菌叢のα多様性は口腔内の細菌量が増えるほど大きくなりました。これらのことは唾液、すなわち口腔の細菌叢が腸内細菌叢に影響を与えていることを示しています。
一方、唾液細菌叢のβ多様性については歯周病の全ての臨床指標と相関関係にあることが明らかになりました。このことは口腔の細菌叢が変化することで病気が悪化することを示すと同時に、病気の悪化がさらなる細菌叢の変化を誘導するという悪循環を引き起こすことを示唆しています。腸内細菌叢のβ多様性に関しては弱いながらも歯周病の重症度を示す臨床指標と相関することが分かりました。
腸内細菌の代謝の違いが血中代謝物の成分に影響することが知られていますが、歯周炎患者と健康な人においても異なることが分かりました。歯周病治療後には血中のヒスチジンというアミノ酸が減少していましたが、このアミノ酸は腸内細菌に代謝されて短鎖脂肪酸に変換されます。治療後の短鎖脂肪酸産生菌の割合が高まることと関連することが考えられました。
今後の期待
不健康な口腔細菌叢は腸内細菌叢を変化させ、全身の健康に悪影響を与えるという、歯周病と全身疾患を結び付ける新たな因果メカニズムが、マウスだけではなくヒトにも当てはまる可能性が示唆されました。
歯周病治療後の期間が短かったため、今回の結果では治療の効果が腸内細菌叢に及ぼす影響は大きくありませんでしたが、患者をより長期に管理をすることで明確な効果が示されるのではないかと考えています。
近年、大腸がんや炎症性腸疾患などで口腔から移行した歯周病原細菌の関与が注目されています。しかしそれらの患者の歯周病罹患状況は全く明らかになっていません。それを調べることで歯周病治療がそれらの疾患の予防や新たな付加的な治療として認知されることが期待されます。
補足説明
- 1.歯周病
歯と歯肉の境界に付着・増殖した口腔内細菌により引き起こされ、歯肉に限局した炎症性病変である歯肉炎と、歯根膜、歯槽骨まで炎症性に破壊される歯周炎に大別される。また、細菌によらず、過大な咬合(こうごう:かみ合わせ)力により歯槽骨が破壊される咬合性外傷がある。一般的に歯周病とは歯周炎を指す。 - 2.歯周病原細菌
歯周炎の原因となる細菌。歯周ポケットの中に集積し、タンパク質分解酵素、リポ多糖などの病原因子により炎症を誘発したり歯槽骨を吸収したりする。多くは嫌気性菌である。 - 3.メタ16S rRNA遺伝子解析
環境中(腸内細菌を解析する場合はふん便)の全ての細菌の持つ遺伝子(16SリボゾームRNA)を網羅的にシークエンシングすることで、微生物の種類を調べることが可能な解析方法。 - 4.NMRを用いたメタボローム解析
NMR法ではクロマトグラフィーなどを用いず、非破壊で試料を計測することが可能な利点がある。今回の研究においても健常者および患者の血清をNMR計測することで、血液の流動性に深く関わるリポタンパク質複合体(HDL、LDL、VLDL)、およびアミノ酸や有機酸といった低分子代謝物を混合物のまま解析している。 - 5.α多様性
個体内におけるある環境(例えば口腔内や腸内)に存在する細菌叢の多様性を指しており、細菌叢を構成する細菌種の多さ(種の豊富さ)を表したり、どのくらい均等に存在したりしているかを表す。 - 6.β多様性
個体間のある環境における細菌叢の多様性を表す指標。個体間の細菌叢の類似度を表すと考えることもできる。 - 7.短鎖脂肪酸
腸内細菌がつくる、酪酸、プロピオン酸、酢酸などの有機酸。特に酪酸は腸上皮細胞の最も重要なエネルギー源であり、抗炎症作用など優れた生理効果を発揮する。
国際共同研究グループ
理化学研究所
生命医科学研究センター
粘膜システム研究チーム
客員主管研究員 山崎 和久(ヤマザキ・カズヒサ)
(新潟大学名誉教授)
客員研究員 宮内 栄治(ミヤウチ・エイジ)
(群馬大学 生体調節研究所 粘膜エコシステム制御分野 准教授)
チームディレクター 大野 博司(オオノ・ヒロシ)
環境資源科学研究センター
環境代謝分析研究チーム
客員技師 坪井 裕理(ツボイ・ユウリ)
チームディレクター 菊地 淳(キクチ・ジュン)
ミシガン大学(米国)
博士研究員 山崎 恭子(ヤマザキ・キョウコ)
なかじま歯科クリニック
院長 中島 貴子(ナカジマ・タカコ)
小野歯科医院
院長 小野 滋(オノ・シゲル)
水野歯科医院
院長 水野 健太郎(ミズノ・ケンタロウ)
北海道大学 大学院歯学研究院 歯周病学教室
教授 高橋 直紀(タカハシ・ナオキ)
東京歯科大学 歯周病学講座
准教授 今村 健太郎(イマムラ・ケンタロウ)
岡山大学 大学院環境生命科学研究科
教授(研究当時)森田 英利(モリタ・ヒデトシ)
新潟大学
医歯学総合研究科
客員研究員 三浦 信明(ミウラ・ノブアキ)
医学部 メディカルAIセンター バイオインフォマティクス分野
教授 奥田 修二郎(オクダ・シュウジロウ)
群馬大学 生体調節研究所 粘膜エコシステム制御分野
教授 佐々木 伸雄(ササキ・ノブオ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「統合オーミクス解析に基づく口腸連関の解明-歯周病をモデルとした関連解析ー(研究代表者:山崎和久、18H04067)」「宿主ー腸内細菌叢相互作用が宿主の病理に及ぼす影響の研究(研究代表者:大野博司、22H00452)」、同基盤研究(B)「歯周炎が惹起するInflammagingにおける口腸連関機構の解明(研究代表者:山崎和久、23H03085)」、日本医療研究開発機構(AMED)AMED-CREST革新的先端研究開発支援事業(疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出)「オミクス解析に基づくアレルギー発症機構の理解と制御基盤の構築(研究代表者:大野博司、19gm0710009h0006)」、AMEDムーンショット型研究開発事業「健康寿命伸長に向けた腸内細菌動作原理の理解とその応用(プロジェクトマネージャー:本田賢也、分担者:大野博司、22zf0127007)」による助成ならびにサンスター株式会社の支援を受けて行われました。
原論文情報
- Eiji Miyauchi, Kyoko Yamazaki, Yuuri Tsuboi, Takako Nakajima, Shigeru Ono, Kentaro Mizuno, Naoki Takahashi, Kentaro Imamura, Hidetoshi Morita, Nobuaki Miura, Shujiro Okuda, Jun Kikuchi, Nobuo Sasaki, Hiroshi Ohno, Kazuhisa Yamazaki, "Patients with periodontitis exhibit persistent dysbiosis of the gut microbiota and distinct serum metabolome", Journal of Oral Microbiology, 10.1080/20002297.2025.2499284
発表者
理化学研究所
生命医科学研究センター 粘膜システム研究チーム
客員主管研究員 山崎 和久(ヤマザキ・カズヒサ)
(新潟大学名誉教授)
客員研究員 宮内 栄治(ミヤウチ・エイジ)
(群馬大学 生体調節研究所 粘膜エコシステム制御分野 准教授)
チームディレクター 大野 博司(オオノ・ヒロシ)
 山崎 和久
山崎 和久
発表者のコメント
歯周病患者は多量の歯周病原細菌を唾液とともに飲み込んでいます。これまで胃酸の分泌を抑える薬剤を服用している、肝硬変があるなどの場合を除いて口腔細菌が腸内細菌に影響を与えることはないと考えられてきました。しかし、われわれの研究により病的口腔細菌は腸内細菌叢の変動を介して全身に悪影響を与えることが明らかになりました。口腔の健康なくして全身の健康はないことを広く伝えていきたいと思います。(山崎 和久)
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
新潟大学 広報事務室
Email: pr-office@adm.niigata-u.ac.jp
群馬大学 昭和地区事務部総務課 研究所庶務係
Tel: 027-220-8822
Email: kk-msomu4@ml.gunma-u.ac.jp
