理化学研究所(理研)生命医科学研究センター 疾患エピゲノム遺伝研究チームの井上 梓 チームディレクターらの研究チームは、マウスを用いて、卵子の成熟に欠かせない因子を新たに同定しました。
本研究成果は、卵成熟不全による不妊症の原因解明など、将来的に生殖補助医療に貢献することが期待されます。
哺乳類の卵巣内で、卵母細胞は減数分裂の前期で細胞周期を停止させ、さまざまなタンパク質を蓄積して成長します。その後、減数分裂を再開し(成熟)、排卵されて受精へと至ります。卵母細胞の成長過程では、その後の成熟や受精に必須な因子が発現します。このためにはエピジェネティック修飾(クロマチンに施される化学修飾、エピゲノム)[1]による遺伝子の働きの制御が必要不可欠です。
今回、研究チームはDNAを収納するヒストンタンパク質の一つであるヒストンH2Aの亜型[2]に着目し、その一つであるH2A.Z[2]が卵母細胞の遺伝子発現とエピジェネティック修飾の制御、また、その後の成熟に必須であることを明らかにしました。
本研究は、科学雑誌『Nature Structural Molecular Biology』オンライン版(6月13日付)に掲載されました。
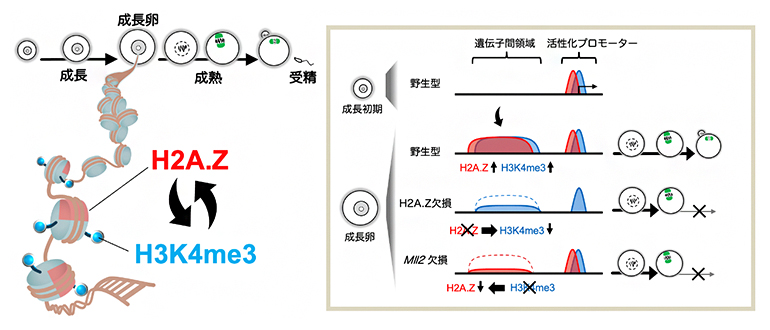
マウス卵における亜型ヒストンH2A.Zとヒストン修飾H3K4me3の協奏的な役割
背景
卵母細胞の成長過程では、エピジェネティック修飾によりゲノム機能が適切に制御され、その後の成熟や受精に関わる遺伝子が活性化します。このとき、体細胞では見られないユニークなエピジェネティック修飾が確立されます。例えばヒストンH3リジン4トリメチル化修飾(H3K4me3)[3]は、体細胞では活発に転写が行われている遺伝子の転写制御領域(活性化プロモーター)に特異的に付与されますが、卵母細胞においては活性化プロモーターから離れた遺伝子間領域にも広範囲に付与されます。このような特殊な分布は「非典型H3K4me3ドメイン」と呼ばれます。非典型H3K4me3ドメインの形成にはH3K4メチル化修飾酵素の一つであるMLL2が必須です。MLL2の欠損卵は卵成熟に異常を来し、受精に至ってもすぐに発生停止することが知られています。
クロマチンはDNAとヒストンタンパク質から構成されます。ゲノム機能の適切な制御にはヒストン修飾だけでなく、ヒストンタンパク質自体の性質も重要です。例えば、ヒストンH2Aには、H2A.Z、H2A.X、TH2Aなど、互いにアミノ酸配列が異なる亜型が存在します。しかし、卵母細胞においてそれらがどのようなゲノム領域に存在するか、また、卵母細胞に特有なエピジェネティック修飾の確立や遺伝子発現制御にどのような役割を果たすかは不明でした。
研究手法と成果
研究チームははじめに、マウスの卵母細胞におけるヒストンH2Aの亜型の分布を調べることにしました。そのために、少数の細胞からヒストンの分布を高解像度に分析できる最新の微量クロマチン免疫沈降シーケンス法[4]を用いて、成長を完了した卵母細胞(成長卵)におけるH2A.Z、H2A.X、TH2A、および典型H2Aの分布を調べました。その結果、H2A.X、TH2A、典型H2Aはゲノム内にほぼ均一に存在する一方で、H2A.Zは活性化プロモーターを含む遺伝子制御領域に集積していました。この結果から、H2A.X、TH2A、典型H2Aが卵母細胞のクロマチンの主要構成ヒストンであることや、H2A.Zが卵母細胞の遺伝子発現制御に関わることが示唆されました。
次に、卵成長過程の各段階におけるH2A.Zの分布を詳細に調べました(図1A)。その結果、ゲノム全体に占めるH2A.Z存在領域の割合が、成長初期の3.2%から成長卵では13%にまで上昇していました(図1B)。その分布について、成長初期には主に活性化プロモーターに局在していましたが、成長に従って活性化プロモーターから離れた遺伝子間領域にも広範に蓄積することが分かりました(図1C)。H2A.Zの遺伝子間領域への蓄積は他の細胞種では知られておらず、本研究で「非典型H2A.Zドメイン」と名付けました。同様に遺伝子間領域に蓄積することが知られていたH3K4me3との比較解析を行ったところ、H2A.ZとH3K4me3は卵成長過程を通じてほぼ共通のゲノム領域に局在していました(図1C)。このことから、卵母細胞においてH2A.ZとH3K4me3は何らかの相互作用があることが予想されました。
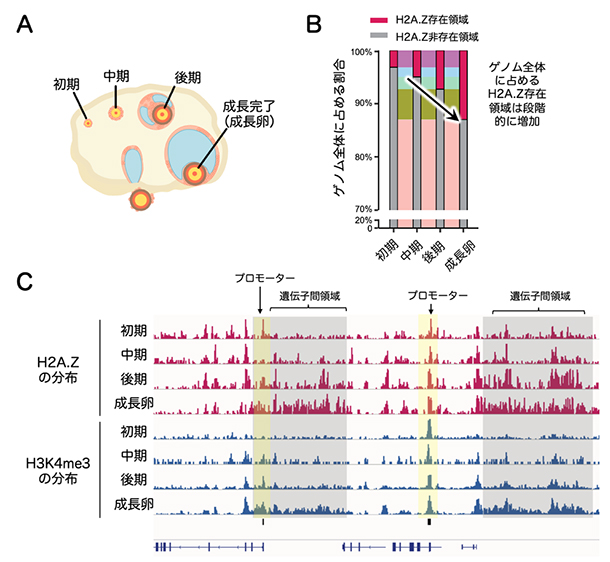
図1 卵成長過程におけるH2A.ZとH3K4me3の分布変化
- (A)卵巣の模式図。マウスにおいて、卵は約1カ月かけて成長を完了する。
- (B)各成長過程の卵におけるゲノム全体に占めるH2A.Z存在領域の割合。
- (C)代表的なゲノム領域のH2A.ZとH3K4me3修飾の動態を示す。両者とも初期あるいは中期以降に活性化プロモーターへの局在が認められるが、成長卵に至るまでに遺伝子間領域にも蓄積していることが分かる。
続いて、卵成長過程におけるH2A.Zの役割を調べるために、卵特異的なH2A.Zの欠損マウスを作製しました。H2A.Z欠損卵の表現型(遺伝子型が形質として表れたもの)を調べたところ、成長後の卵成熟が正常に進行せず、ほとんどが第一減数分裂中期で停止しました(図2A、B、C)。また、受精に至った場合でも4細胞期以降の胚まで発生できず、完全不妊になりました(図2D)。
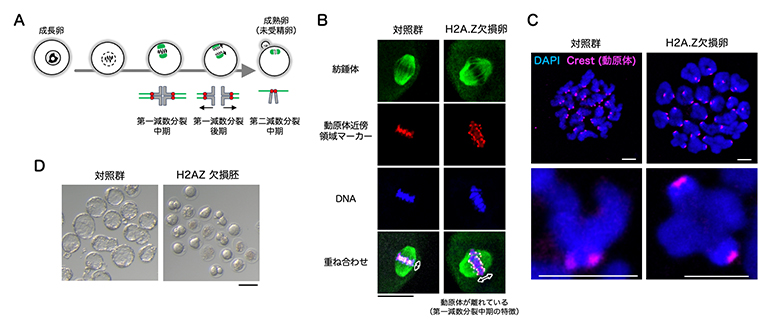
図2 H2A.Z欠損卵の表現型
- (A) 卵成熟中の染色体の挙動。赤は動原体(どうげんたい)、緑は紡錘体(ぼうすいたい)、灰色は染色体を示す。
- (B、C) 成熟後の未受精卵の免疫染色像(染色体を含む紡錘体部分の拡大像(B))および染色体標本の免疫染色像(C)。対照群では第二減数分裂中期に特徴的な動原体が近接した染色体構造を取るのに対し、H2A.Z欠損卵では第一減数分裂中期に特徴的な動原体が離れた染色体構造を取っていることが分かる。Bスケールバーは20マイクロメートル(μm、μmは100万分の1メートル)。Cのスケールバーは2.5μm。
- (D) 受精後4日目の着床前胚の写真。スケールバーは100μm。
H2A.Z欠損卵において分子レベルで何が起こっているかを明らかにするために、RNAシーケンス法を用いて遺伝子発現の変化を解析したところ、H2A.Z欠損卵では減数分裂や染色体分配に関する遺伝子の発現が顕著に低下していました(図3A)。上述のようにH2A.ZとH3K4me3との間に相互作用があることが予想されたため、次にH3K4メチル化酵素MLL2の欠損卵のRNAシーケンスデータと比較解析しました。その結果、H2A.Z欠損卵とMLL2欠損卵では多くの遺伝子が共通して発現変動していました(図3B、C)。続いて、微量クロマチン免疫沈降シーケンス法を用いてH2A.Z欠損卵とMLL2欠損卵のH2A.ZおよびH3K4me3の変化を詳細に解析しました。その結果、H2A.Z欠損卵では遺伝子間領域に蓄積する非典型H3K4me3ドメインが減少すること、また、MLL2欠損卵では非典型H2A.Zドメインが減少することを見いだしました(図3D)。このことから、H2A.ZとMLL2は互いに補強し合うことで卵母細胞特有の非典型H2A.Z/H3K4me3ドメインが形成されることが示唆されました。
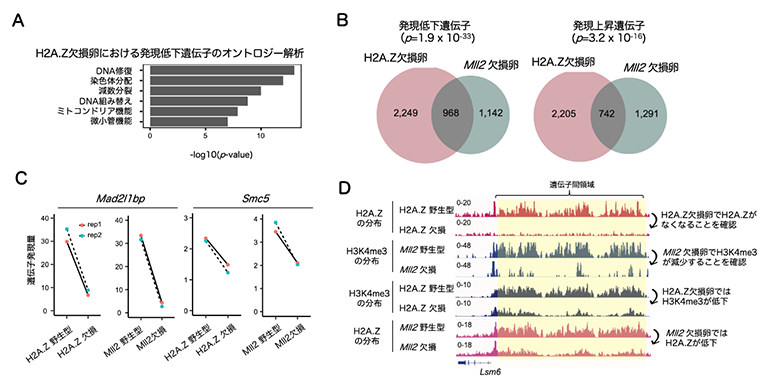
図3 H2A.Z欠損卵とMll2遺伝子欠損卵の遺伝子発現およびエピジェネティクス解析
- (A)H2A.Z欠損卵で発現低下する遺伝子の機能的特徴(Y軸)とその統計値(X軸)を示す。
- (B)H2A.Z欠損卵とMll2遺伝子欠損卵の発現低下遺伝子および発現上昇遺伝子の重なりを示すベン図。数字は発現遺伝子数。
- (C)H2A.Z欠損卵とMll2遺伝子欠損卵で共通して発現低下する減数分裂関連遺伝子の例。
- (D)それぞれの卵における代表的な遺伝子座のH2A.ZとH3K4me3の変化を示す。H2A.Zの欠損で遺伝子間領域のH3K4me3が低下することや、MLL2の欠損で同領域のH2A.Zが低下することが分かる。
今後の期待
今回、哺乳類の卵成熟に必須な因子としてH2A.Zを新たに同定し、卵母細胞に特徴的なエピジェネティック修飾の形成機構の一端を明らかにしました。H2A.ZやMLL2はヒトを含む多くの生き物で保存されています。H2A.Zの変異や局在異常がヒトの卵成熟異常や不妊と関連する可能性があり、今後の研究による解明が期待されます。
補足説明
- 1.エピジェネティック修飾(クロマチンに施される化学修飾、エピゲノム)
細胞には、自身の膨大なゲノム情報から必要な情報だけを取り出すための「ゲノムの取扱説明書」のような機構が備わっている。エピジェネティック修飾はその主要な機構の一つである。エピジェネティック修飾の分子実体は、DNAメチル化などのDNA自体への化学修飾と、DNAを収納するタンパク質であるヒストンへの化学修飾が主である。これらのエピジェネティック修飾がゲノム内の適切な場所に配置することで、必要に応じた遺伝子を発現させることができる。エピジェネティック修飾が適切に配置される機構については、現在世界中で活発に研究が行われている最中であり、本研究もその一つと位置付けられる。 - 2.ヒストンH2Aの亜型、H2A.Z
ヒストンにはH2A、H2B、H3、H4の4種類があり、それぞれが2分子ずつ集合してヌクレオソームというヒストン8量体構造を取る。DNAはヌクレオソームに巻き付いて数珠状に連なりクロマチン構造を取る。真核生物のDNAはクロマチンの形で核内に収納される。それぞれのヒストンにはアミノ酸配列の異なる複数の亜型が存在する(「ヒストンバリアント」とも呼ばれる)。H2A.ZはH2Aの亜型の一つで、進化的保存性が高く、活性化遺伝子のプロモーター領域に局在する。 - 3.ヒストンH3リジン4トリメチル化修飾(H3K4me3)
ヒストンのN末端テールにさまざまな化学修飾(ヒストン修飾)が付加される。例えば、ヒストンH3のN末端から4番目のリジン残基(K)に三つのメチル基が付加(トリメチル化)したものはH3K4me3と記載される。体細胞においてH3K4me3は活性化遺伝子のプロモーター領域に局在する。しかし、成長卵においてはH3K4me3は遺伝子間領域にも広範に存在する(非典型H3K4me3ドメイン)。 - 4.微量クロマチン免疫沈降シーケンス法
クロマチンを200~400塩基対(bp)ごとに細断し、特定のヒストン修飾やタンパク質に対する特異的抗体を用いてクロマチン断片を免疫沈降させる。免疫沈降させたクロマチン断片からDNAを抽出し、次世代シーケンサーでその配列を読むことで、ヒストン修飾やタンパク質の結合箇所を同定することができる。この手法には従来100万個以上の細胞が必要であったが、近年の技術革新の結果、1,000個以下の細胞でも実施可能な微量クロマチン免疫沈降シーケンス技術が確立されている。研究チームは、その黎明(れいめい)期から開発・応用に携わっており、世界最高水準の技術を有する。
研究チーム
理化学研究所 生命医科学研究センター
疾患エピゲノム遺伝研究チーム
チームディレクター 井上 梓(イノウエ・アズサ)
研究員 メイ・ハイリャン(Mei Hailiang)
研究員 小塚 智沙代(コヅカ・チサヨ)
テクニカルスタッフⅡ 公文 麻美(クモン・マミ)
研修生(研究当時)林 凌也(ハヤシ・リョウヤ)
免疫器官形成研究チーム
チームディレクター 古関 明彦(コセキ・ハルヒコ)
研究支援
本研究は、文部科学省科学研究費補助金新学術領域研究(研究領域提案型)「全能性プログラム:デコーディングからデザインへ(領域代表者:小倉淳郎)」における「全能性消失時のエピゲノム制御機構の解明(研究代表者:井上梓)」、RIKEN Pioneering Projects「Genome building from TADs(研究代表者:古関明彦、研究分担者:井上梓)」「Long-timescale molecular chronobiology(研究代表者:北島智也、研究分担者:井上梓)」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業PRIME「経世代ヒストン修飾を介した疾患素因の形成機構(研究開発代表者:井上梓)」、日本学術振興会(JSPS) 科学研究費助成事業特別研究員奨励費「ヒストン修飾による母性エピゲノム遺伝機構の解明(研究代表者:林凌也)」による助成を受けて行われました。
原論文情報
- Hailiang Mei, Ryoya Hayashi, Chisayo Kozuka, Mami Kumon, Haruhiko Koseki, and Azusa Inoue, "H2A.Z reinforces maternal H3K4me3 formation and is essential for meiotic progression in mouse oocytes", Nature Structural Molecular Biology, 10.1038/s41594-025-01573-x
発表者
理化学研究所
生命医科学研究センター 疾患エピゲノム遺伝研究チーム
チームディレクター 井上 梓(イノウエ・アズサ)
 井上 梓
井上 梓
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
