理化学研究所(理研)生命医科学研究センター 免疫細胞治療研究チームの清水 佳奈子 上級研究員、藤井 眞一郎 チームディレクター(最先端研究プラットフォーム連携(TRIP)事業本部創薬・医療技術基盤プログラム 副プログラムディレクター)らの共同研究チームは、腫瘍近傍に存在し低酸素環境で誘導される特殊な腫瘍関連マクロファージ(TAM)[1]のサブセットを見いだしました。
このTAMサブセットの存在は腫瘍免疫に対して正と負の両方向の影響を与え得るため、これを標的とした新たな治療法の可能性が期待できます。
このTAMは細胞の一部を取り込むトロゴサイトーシス[2]という機序により腫瘍細胞の膜断片を獲得し、腫瘍細胞の膜上に存在する腫瘍抗原エピトープ(決定基)と主要組織適合複合体(MHC)[3]とから成る複合体をそのまま獲得します。そして自らの細胞表面上に提示することにより細胞傷害性Tリンパ球(CTL)[4]の標的となることが明らかになりました。このTAM自体は腫瘍増大促進に働くタイプの免疫抑制性の細胞ですが、効率よくCTLが活性化した際には、このTAMサブセットは腫瘍細胞とともに一掃され、腫瘍免疫微小環境(TIME)[5]は抗腫瘍免疫へ大きく傾きます。これにより腫瘍の増大を抑制する効果が期待できます。また、このTAMのトロゴサイトーシスを制御する分子としてCH25H[6]を同定しました。さらにTAMのトロゴサイトーシスはTIMEの環境因子により影響を受けることも判明しました。
本研究は、科学雑誌『Cell Reports』オンライン版(6月8日付)に掲載されました。
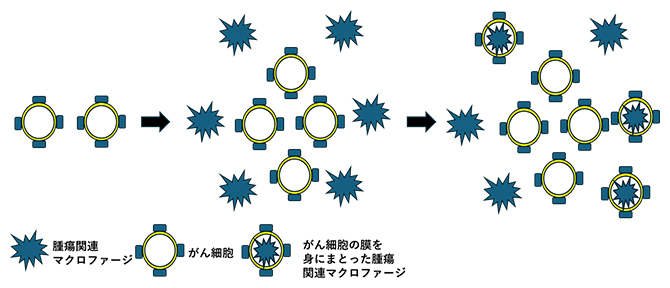
がん細胞膜を獲得した抑制系腫瘍関連マクロファージ
背景
免疫チェックポイント分子阻害剤(ICB)[7]は現在では標準治療に取り入れられていますが、その有効性や抵抗性に関する研究は精力的に継続されており、免疫学的要因と非免疫学的環境要因の両方が関与していることが明らかになっています。非免疫的環境要因としては、遺伝的不均一性、突然変異負荷、腸内細菌の影響などが挙げられます。一方、免疫学的要因が関連した抵抗性には、制御性T細胞や腫瘍関連マクロファージ(TAM)などの抑制性細胞の関与が報告されています。
TAMは腫瘍免疫微小環境(TIME)の中で大分部を占めるミエロイド系(骨髄系)の免疫細胞です。従来マクロファージは、M1[1]、M2[1]の表現型で分類されてきましたが、さまざまな解析により、TAMには複数のサブセット(クラスター)が存在することが判明してきました。その中の一部についてはICBの有効性や予後との関連が報告されています。しかしながら、多くのTAMサブセットは遺伝子発現レベルでの分類にとどまり、その機能や役割については不明です。
従って、どのTAMサブセットが抗腫瘍免疫を促進するのか、あるいは抑制するのかを明らかにすることが重要です。TAMの表現型の多様性に関する理解は深められてきましたが、TAMサブセットの機能的分類を証明するには多角的なアプローチが必要です。本研究では、TIME内の腫瘍促進と抗腫瘍免疫のバランスを制御するTAMの存在を証明することに挑みました。
研究手法と成果
マウスモデルでICBに感受性の高い大腸がん細胞MC38を用いて検証しました。MC38細胞を、野生株(WT)マウスと樹状細胞(DC)サブセットcDC1[8]が欠損したマウスに投与し、ICBの効果を検証しました。cDC1の欠損マウス(IRF8 cKO)では細胞傷害性Tリンパ球(CTL)が誘導されずにICBは効果を示すことができませんでした。また、MC38担がんマウスに抗体を投与することで、エフェクター細胞[9]であるCD4T細胞[9]、CD8T細胞[9]、NK細胞[9]を生体内から除去し、TIMEの変化を調べたところ、CD8T細胞を除去した場合に、TAMにおいていわゆるM2タイプ(CD11loClassIIlo)のサブセットの割合が増えることが分かりました。つまり、CTLとTAMには何らかの関連があることが示唆されました。
そこでIRF8 cKOマウスにオボアルブミン(OVA)抗原を発現したMC38(MC38-OVA)を接種し、腫瘍が増大したところで抗原特異的な活性化CTLを投与しました。経時的に腫瘍内を解析すると、腫瘍細胞以外にマクロファージがアポトーシス(細胞死)を起こし、殺傷されていました(図1)。またCTLを投与したマウスでは明らかな腫瘍の退縮が起こっていました(図1)。
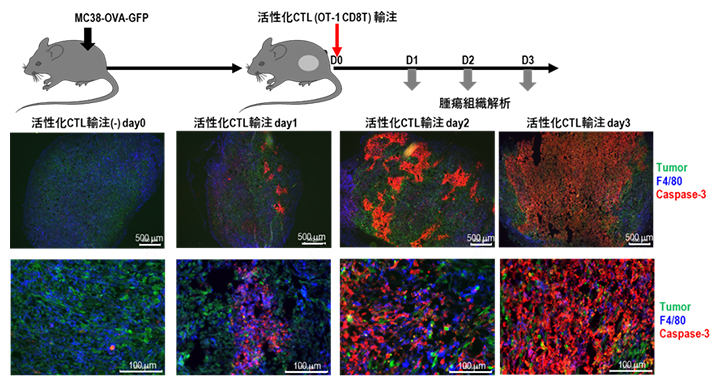
図1 MC38-OVAを接種したcDC1の欠損マウスの活性化CTL投与後の腫瘍の解析
OVAタンパク質および蛍光色素のGFPを遺伝子導入したMC38細胞株をcDC1欠損マウスに接種し、腫瘍のサイズが大きくなったところで、OVA抗原に対するCD8T(OT-1 CD8T)細胞を活性化した状態で輸注(静脈内投与)した(Day0)。Day1、Day2、Day3と腫瘍組織を採取して、GFP(緑:腫瘍細胞)、F4/80(青:TAM)、Caspase3(赤:アポトーシスを起こした死細胞)に対する抗体で免疫染色した。Day1の早期からマクロファージが殺傷されていることが分かる。
さらにCTLとマクロファージの関係について解析を進めたところ、CTLは他のミエロイド系の免疫細胞に比べTAMを抗原特異的に効率よく殺傷しており、TAM自体が何らかの方法でCTLが認識するがん抗原を獲得していることが示唆されました。
そこでマクロファージがどのように腫瘍細胞からがん抗原を獲得するか検討したところ、トロゴサイトーシスという機序により腫瘍細胞の膜断片を取り込むことが分かりました。膜を標識した腫瘍細胞とマクロファージを短時間(1時間)共培養することで、マクロファージが高率で腫瘍細胞の膜を取り込めることが判明しました(図2)。
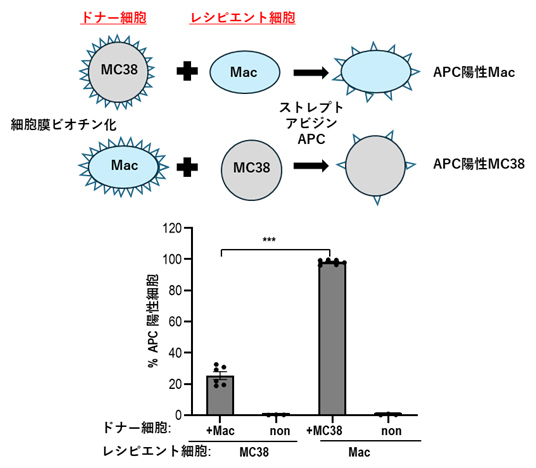
図2 マクロファージと腫瘍細胞(MC38)間のトロゴサイトーシスの検討
トロゴサイトーシスを測定するために、ドナー細胞の細胞膜をビオチン(ビタミンB群の一つ)化し、レシピエント細胞と共培養した。その後、蛍光色素タンパク質APCで標識されたストレプトアビジン(ビオチンとよく結合するタンパク質)で染色することで、ドナー細胞からレシピエント細胞へビオチン化した細胞膜の移行をフローサイトメトリー法により検出した。ドナー細胞がマクロファージ(Mac)、レシピエント細胞がMC38の場合に比べ、ドナー細胞がMC38、レシピエント細胞がMacの場合にトロゴサイトーシスが高率に起こることが判明した。「***」:有意水準0.1%での有意差あり。
次に生体内でもマクロファージによるトロゴサイトーシスが起きているかどうかを検証しました。MC38-OVA細胞とMHC class Iを欠損させたMC38-OVA細胞(Class IKO MC38-OVA)をマウスに接種して腫瘍組織内のTAMを解析しました。MC38-OVAは細胞表面のMHC Class I上にOVA抗原ペプチドを発現しており、それを認識する抗体があります。Class IKO MC38-OVAは細胞内にOVAタンパク質を発現しているものの、Class Iを欠損しているため、その抗体は結合しません。MC38-OVAを接種した場合、この抗体が腫瘍周辺のM2タイプのTAMに対してより多く結合するのに対し、Class IKO MC38-OVAを接種した場合は、腫瘍細胞のみならずTAMも抗体で検出することができませんでした。これにより腫瘍組織のTAMにおいてClass I上にがん抗原エピトープ(決定基)を発現するメカニズムはトロゴサイトーシスによることが明らかとなりました。実際にトロゴサイトーシスを起こしているTAM(TG-TAM)の特性について、フローサイトメトリー[10]解析により、TG-TAMはCD9[11]、CD63[11]という分子を高発現していることが判明しました。
一方、遺伝子解析によりTG-TAMは低酸素応答遺伝子を高発現していることが分かりました。また、TG-TAMは血管新生に関連する分子や免疫抑制分子を高発現するなど腫瘍増大を促進する免疫抑制系の形質を示しました。さらに、トロゴサイトーシスは細胞膜間の移行が起こる現象のため、細胞膜の流動性を制御する分子に着目したところ、TG-TAMはCH25Hの発現が低いことが判明しました。
慢性的なtype I IFNのシグナル[12]はCD8Tの疲弊を促進することが報告されています。そこで、WTとtype I IFNの受容体欠損マウス(IFNαβR KO)においてICBの効果を比較したところ、IFNαβR KOマウスの方で、より高い抗腫瘍効果を認めました(図3)。
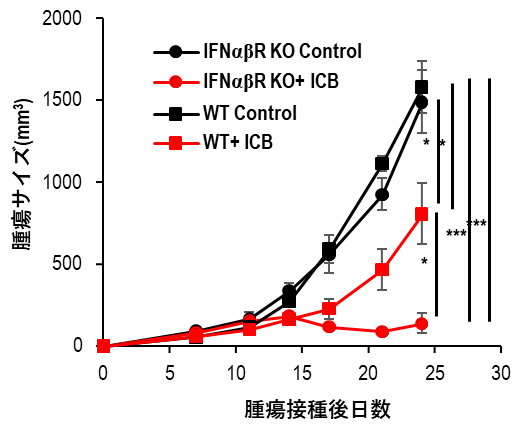
図3 type I IFNの受容体欠損マウス(IFNαβR KO)におけるICBの効果
野生型(WT)マウスおよびtype I IFNの受容体欠損マウス(IFNαβR KO)にMC38細胞を接種し、接種7日後より免疫チェックポイント分子阻害剤(ICB)治療を開始して、腫瘍サイズを測定した。WTマウスに比べ、IFNαβR KOマウスにおいて、よりICBの効果が有効であった。「*」:有意水準5%での有意差あり、「**」:有意水準1%での有意差あり、「***」:有意水準0.1%での有意差あり。
TG-TAMに着目して解析すると、IFNαβR KOのTIMEにおいてTAMのトロゴサイトーシスが亢進(こうしん)していること、またTAMにおけるCH25Hの発現はWTに比べ低下していました(図4)。実際、in vitro(試験管内)においてマクロファージをIFN(インターフェロン)-βで刺激した場合、CH25Hの発現が上昇することから、type I IFNシグナルはCH25Hの発現を促進し、トロゴサイトーシスを低下させることが示唆されました。CH25Hとトロゴサイトーシスの直接的な関連を調べるため、マクロファージ細胞を用いてCH25Hの欠失および強制発現細胞株を作製し、トロゴサイトーシス機能を比較したところ、CH25H欠失細胞株ではトロゴサイトーシスが亢進、CH25H強制発現細胞株ではトロゴサイトーシスが低下することが検証できました。
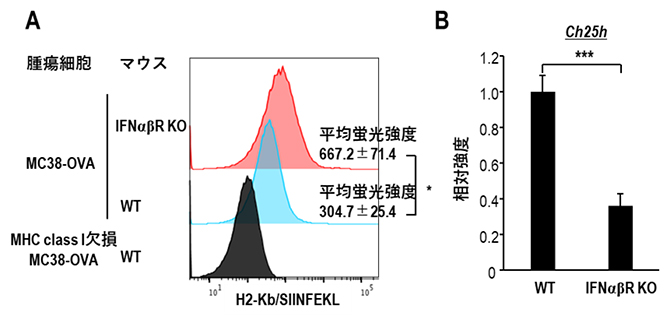
図4 type I IFN受容体欠損マウス(IFNαβR KO)におけるTAMの解析
MC38-OVA(A)またはMC38(B)を接種したIFNαβR KOマウスの腫瘍組織におけるトロゴサイトーシスを起こしたTAM(TG-TAM)とCH25H分子の発現をWTマウスのTAMと比較検討した。
- (A)MHC Class I(H2-Kb)に提示されたOVA一部のエピトープ(SIINFEKL)を認識する抗体(anti-H2-Kb/SIINFEKL)を用いて、TAMのH2-Kb/SIINFEKLの発現をフローサイトメトリーにより解析したところ、WTマウス由来のTAMに比べIFNαβR KO マウス由来のTAMはH2-Kb/SIINFEKLを高発現していた。
- (B)WTマウスおよびIFNαβR KOマウスからおのおのTAMを単離し、CH25Hの発現を比較したところ、IFNαβR KOマウスではWTマウスに比べ有意に低値であることが明らかとなった。「***」:有意水準0.1%での有意差ありを示す。
このようにTG-TAMは腫瘍細胞からがん抗原を含む細胞膜をトロゴサイトーシスにより獲得します。CTLから見ると腫瘍細胞と同様に標的細胞腫瘍の近傍にTG-TAMが分布することで、腫瘍細胞を囲んだガードができている訳です。しかし、適切なタイミングで機能的なCTLが十分誘導された場合ではTG-TAMを一掃することで、TIMEを抗腫瘍免疫へ傾けることが可能になります。
今後の期待
今後、トロゴサイトーシスを起こしているTAM(TG-TAM)が誘導されやすいがんの種類や条件、さらにトロゴサイトーシス機能に関与する分子の同定を進めることで、TG-TAMを標的とした新たな治療法の可能性が広がります。加えて、ヒト腫瘍組織におけるTG-TAMの存在や予後との関連を検証することで、患者がどのようながんに関与しているかが明らかになり、がんのステージとの関係性や免疫療法を開始する適切なタイミングの判断にも貢献できると期待されます。
補足説明
- 1.腫瘍関連マクロファージ(TAM)、M1、M2
腫瘍組織に集積しているマクロファージ。従来M1(炎症性、抗腫瘍)、M2(組織修復、免疫抑制)の2タイプに分類されてきたが、scRNA-seq(次世代シークエンサーによって、1細胞ごとに網羅的な遺伝子セットのmRNAの量などを求める方法)などにより遺伝子発現パターンより多様性があることが判明した。TAMはtumor associated macrophageの略。 - 2.トロゴサイトーシス
トロゴ(trogo-)は古代ギリシャ語源で「かじる」に相当し、ある細胞が別の細胞上のタンパク質を膜ごと奪い取る現象である。免疫細胞同士、がん細胞と免疫細胞、アメーバーと上皮細胞など種々の細胞間でトロゴサイトーシスが起こることが報告されている。 - 3.主要組織適合複合体(MHC)
自己・非自己を区別する分子で、免疫応答における免疫細胞間の相互作用や生体防御機構において重要な役割を担う細胞膜糖タンパク質である。構成される分子によって、クラスⅠとクラスⅡに分類される。T細胞受容体は、MHC上に提示される抗原を認識する。主として、MHCクラスⅠは内因性抗原、MHCクラスⅡは外来性抗原をおのおのCD8T細胞、CD4T細胞([9]参照)へ提示する。遺伝的な背景により、MHCには多型性があり、臓器移植の際には、MHCが異なると拒絶反応が生じることから、主要組織適合抗原とも呼ばれる。MHCはmajor histocompatibility complexの略。 - 4.細胞傷害性Tリンパ球(CTL)
免疫細胞の一種であるTリンパ球は、生体内の異物に対し免疫反応を起こす。異物(腫瘍細胞など)あるいは異物に感染した細胞(ウイルスに感染した細胞など)を殺傷し、排除できるTリンパ球の集団を細胞傷害性T細胞(キラー細胞)と呼ぶ。CTLはcytotoxic T lymphocyteの略。 - 5.腫瘍免疫微小環境(TIME)
腫瘍組織内には、さまざまな種類の免疫細胞や、血管や線維芽細胞など多くの正常細胞が、腫瘍細胞と混在しており、それら構成細胞の比率や種類は患者ごとに多様である。腫瘍内でがん細胞と免疫細胞は複雑に相互作用し、患者の予後や治療反応性に大きく関連する重要な要素となる。このような腫瘍組織内の状況は腫瘍免疫微小環境と呼ばれる。腫瘍内でがん細胞や非免疫細胞と免疫細胞が相互作用することにより、腫瘍の増殖、転移に有利な腫瘍免疫微小環境が構築されると考えられている。腫瘍免疫微小環境の理解によりがん免疫療法の効果を向上させることが期待できる。TIMEはtumor immune microenvironmentの略。 - 6.CH25H
コレステロールを可溶性のコレステロール25HCに変換する酵素。25HCは膜融合を遮断することでウイルス感染を防ぐことが知られている。 - 7.免疫チェックポイント分子阻害剤(ICB)
T細胞の活性化を抑制する負の共刺激分子(PD-1、CTLA-4)およびそのリガンドに結合し、それらの作用を阻害する抗体の総称。T細胞の免疫抑制を解除することにより、抗腫瘍免疫応答を増強する。ICBはimmune checkpoint blockadeの略。 - 8.樹状細胞(DC)サブセットcDC1
樹状細胞(DC)は樹状突起を持つ白血球。未感作T細胞に異物の情報を伝える細胞(抗原提示細胞)として働き、免疫反応の本質的な司令塔としての役割を担っている。DCのサブセットの中でcDC1といわれるサブセットは特にCD8T細胞([9]参照)への抗原提示に優れている。DCはdendritic cellの略。 - 9.エフェクター細胞、CD4T細胞、CD8T細胞、NK細胞
エフェクター細胞とはがんや病原体を直接攻撃し排除する、あるいは免疫応答を活性化する機能を有する細胞を指す。がんに対するエフェクター細胞としては、獲得免疫に属するCD4T細胞、CD8T細胞、自然免疫に属するNK細胞が代表的である。 - 10.フローサイトメトリー
細胞にレーザー光を当て、蛍光や散乱光を検出して分析する技術。この技術を用いて、細胞のサイズや構造、表面や内部の分子の発現を1細胞レベルで調べることができる。 - 11.CD9、CD63
CD9、CD63はテトラスパニンファミリー(細胞膜を4回貫通する構造を持つ膜タンパクファミリー)に属し、さまざまな細胞機能の調整に関与していることが報告されている。 - 12.type I IFNのシグナル
Ⅰ型のインターフェロン(IFN)からのシグナルで、このシグナル経路は、元来ウイルス感染に対する自然免疫応答の中心的な仕組みの一つとして同定された。IFN-αおよびIFN-βによって媒介されるこの経路は、抗ウイルス状態の誘導、細胞のアポトーシス、免疫活性化などを通じて感染の拡大を防ぐ。腫瘍免疫においては、抗原提示の促進やT細胞応答の増強などによって抗腫瘍効果を促進する一方で、このシグナルが慢性的に活性化されると、T細胞の疲弊を引き起こすなど、免疫抑制的に働くことも報告されている。
共同研究チーム
理化学研究所 生命医科学研究センター 免疫細胞治療研究チーム
チームディレクター 藤井 眞一郎(フジイ・シンイチロウ)
(最先端研究プラットフォーム連携(TRIP)事業本部 創薬・医療技術基盤プログラム 副プログラムディレクター)
上級研究員 清水 佳奈子(シミズ・カナコ)
テクニカルスタッフⅠ 三瓶 杏(サンペイ・アン)
テクニカルスタッフⅠ 中里 洋(ナカザト・ヒロシ)
テクニカルスタッフⅠ 信賀 順(シンガ・ジュン)
研究員 植田 翔悟(ウエダ・ショウゴ)
技師 伊豫田 智典(イヨダ・トモノリ)
研究員 山﨑 哲(ヤマサキ・サトル)
東京医科歯科大学 教養学部数学科(研究当時、現 東京科学大学 教育研究組織 リベラルアーツ研究教育院)
教授 中林 潤(ナカバヤシ・ジュン)
原論文情報
- Kanako Shimizu, An Sanpei, Hiroshi Nakazato, Jun Shinga, Shogo Ueda, Yan Liu, Tomonori Iyoda, Satoru Yamasaki, Jun Nakabayashi and Shin-ichiro Fujii, "Distinct TAM Subset with Cross-Dressing Capability Determines the Bifurcation of Tumor Immunity", Cell Reports, 10.1016/j.celrep.2025.115800
発表者
理化学研究所
生命医科学研究センター 免疫細胞治療研究チーム
チームディレクター 藤井 眞一郎(フジイ・シンイチロウ)
(最先端研究プラットフォーム連携(TRIP)事業本部 創薬・医療技術基盤プログラム 副プログラムディレクター)
上級研究員 清水 佳奈子(シミズ・カナコ)
発表者のコメント
組織マクロファージに比べてTAMは多様性に富むため、その機能解析は容易ではないことが分かっていました。実際TAMには沢山の種類が存在し、その機能解析は難解であると報告されております。その理由は、表現型による分類が必ずしも機能と一致せず、遺伝子発現解析と機能的解析の両方から結果を重ねる必要があるからです。今回同定したTG-TAMの存在も遺伝子発現データのみから検出することは難しく、TG-TAMがCTLの標的となるという発見から始まり、シングル細胞解析や免疫学的解析など試行錯誤しながら検証を積み重ねました。(藤井)
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
