理化学研究所(理研)生命医科学研究センター 疾患エピゲノム遺伝研究チームの福嶋 悠人 学振特別研究員PDと京都産業大学 生命科学部の武田 洋幸 教授の共同研究チームは、魚類の初期発生においてヒストン修飾[1]が遺伝子発現を制御するメカニズムを解明しました。
本研究成果は、動物の初期発生におけるヒストン修飾の重要性の解明であり、将来的には、動物の初期発生システムの普遍性・多様性の理解、さらには発生異常が原因となる疾患の理解・治療につながると期待されます。
これまで多くの動物において、受精後に初めて遺伝子発現が開始される時期にゲノム上にヒストン修飾が蓄積することが広く知られていましたが、その機能については完全には明らかになっていませんでした。今回、共同研究チームは、魚類(メダカやゼブラフィッシュ)を用いてヒストン修飾の機能解析を行い、複数種類のヒストン修飾が協調的に働き、遺伝子ごとに異なる様式で発現が制御されることを示しました。
本研究は、科学雑誌『Nature Communications』オンライン版(6月16日付:日本時間6月16日)に掲載されました。
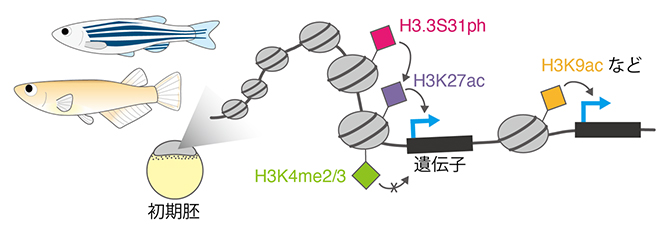
魚類初期胚において協調的に遺伝子発現を制御する複数種類のヒストン修飾
背景
多くの動物で、受精直後の初期胚においては、通常の細胞では見られない特殊な制御がしばしば起こることが知られています。例えば、通常の細胞では遺伝子ごとにその発現を活性化・抑制することでその細胞の機能が獲得・維持されますが、受精直後には初期胚のゲノムからの遺伝子発現は起こっておらず、複数回の細胞分裂を経た後に、初めて初期胚のゲノムからの遺伝子発現が開始されます。この現象は特に胚ゲノムの活性化(ZGA)[2]と呼ばれており、初期発生における細胞の多能性の獲得、およびその後の細胞分化を正常に進める上で必須だと考えられています。
この初期胚のZGAにおける遺伝子発現開始メカニズムとして近年注目されているのが、エピゲノム[3]、とりわけ、クロマチン[1]を構成するヒストンタンパク質に付与される化学的修飾(ヒストン修飾)です。一般的に、細胞の中には100種類以上のヒストン修飾が存在しています。また、特定のヒストン修飾については、遺伝子の活性状態・抑制状態を制御することが知られています。初期胚のZGAにおける遺伝子発現開始のタイミングでは多くのヒストン修飾が一斉にクロマチン上に蓄積する、つまり初期胚におけるエピゲノムの動態[4]の変化が起きるため、ヒストン修飾の蓄積がZGAにおける遺伝子発現を制御する可能性が示唆されていました。しかし実際には、通常の細胞とは異なる側面が多い初期胚においてもヒストン修飾による遺伝子発現制御が行われるのかについての実験的な検証はほとんど行われていませんでした。
研究手法と成果
この疑問に答えるため、共同研究チームは魚類の初期胚(メダカやゼブラフィッシュ)を用いてヒストン修飾の機能を検証することとしました。メダカやゼブラフィッシュに代表される魚類は脊椎動物のみならずショウジョウバエなどとも発生様式が類似するため、メカニズムの普遍性を検証する上で優れたモデル生物として知られています。また体外受精であり、哺乳類と比べてゲノムサイズが小さいため、実験的な操作・解析が行いやすいというメリットがあります。
まずは、一般的な細胞で遺伝子発現の活性化との関連が知られるヒストン修飾H3K27ac[5]に注目し、魚類初期胚においてH3K27acを人為的に除去しました。このときおよそ半数の遺伝子で遺伝子発現が阻害されたことから、H3K27acが初期胚における遺伝子発現開始に必須であることが分かりました。一方、残り半数の遺伝子は、H3K27acを人為的に除去しても、通常通り遺伝子発現が開始されました。そこで、遺伝子発現の活性化との関連が知られる他のヒストン修飾に注目したところ、H3K9ac、H4K16ac、H3K14ac[6]などのヒストン修飾が、残り半数の遺伝子の活性化を制御する可能性が示唆されました。つまり、初期胚のZGAにおける遺伝子発現開始は決して一様のメカニズムで起こるわけではなく、遺伝子ごとに異なる様式で活性化されることが初めて明らかになりました(図1)。
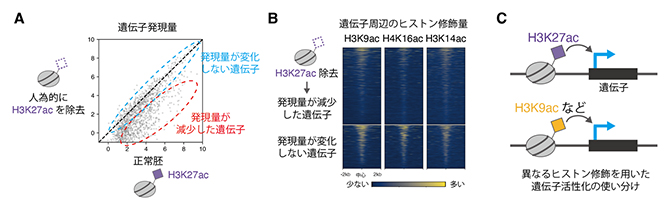
図1 異なるヒストン修飾を用いた遺伝子活性化
- (A)初期胚において発現される遺伝子の発現量を散布図で示す。人為的にH3K27acを除去した際、およそ半数の遺伝子は正常胚と比べ発現量が減少する。一方で残る半数は、発現量が変化しない。
- (B)初期胚において発現される遺伝子周辺のヒストン修飾量をデータ可視化手法の一つであるヒートマップで示す。H3K27acを除去しても発現量が変化しない遺伝子には、H3K9ac、H4K16ac、H3K14acなどのヒストン修飾が多く存在する。
- (C)魚類初期胚では、H3K27acを用いて活性化される遺伝子と、H3K9acなどその他のヒストン修飾を用いて活性化される遺伝子が存在する。
別のヒストン修飾であるH3K4me2/3[7]も、一般的な細胞では遺伝子発現の活性化を制御すると考えられています。そこで魚類初期胚においてH3K4me2/3を人為的に除去したところ、予想に反し遺伝子発現に影響が全くなかったため、初期胚のZGAにおいてはH3K4me2/3が遺伝子発現に必要ではないことが分かりました。
では、なぜ一般的な細胞では遺伝子発現に必要なH3K4me2/3が、初期胚のZGAにおける遺伝子発現開始に必要ではないのでしょうか。そこで、ヒストン修飾の量に注目したところ、初期胚では他の発生時期と比べ2~3倍のH3K27acが蓄積していました。また、この一時的なH3K27acの蓄積量の上昇は、別のヒストン修飾H3.3S31ph[8]により制御されることも分かりました。従って、初期胚ではH3K27acの量が非常に増加しているために、H3K4me2/3がなくともZGAにおける遺伝子発現を十分活性化できるのだと考えられます(図2)。
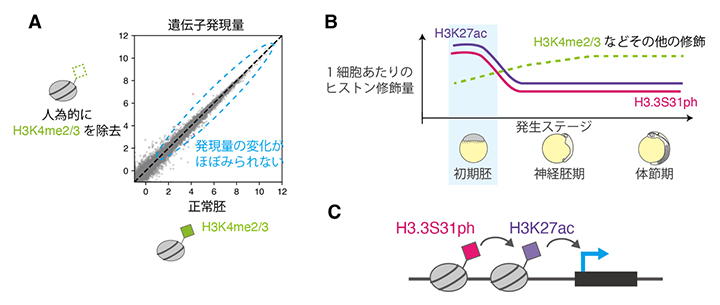
図2 遺伝子活性化におけるその他のヒストン修飾の機能
- (A)遺伝子の発現量を散布図で示す。人為的にH3K4me2/3を除去しても、正常胚と比べて遺伝子発現の変化はほぼ見られない。
- (B)1細胞当たりのヒストン修飾量と発生に伴うその変化。H3K27acとH3.3S31phだけは、初期胚においてその量が増えている。
- (C)H3.3S31phがH3K27acの導入を促進し、その結果一部の遺伝子が活性化される。
今後の期待
本研究から、複数種類のヒストン修飾が協調的に働くことで、初期胚のZGAにおける遺伝子発現開始が正常に起こることが分かりました。興味深いことに、魚類と類似した発生様式を取るショウジョウバエでも関連した報告があるため、本研究が明らかにしたメカニズムは、多くの動物でも保存されていることが予想されます。
一方で、魚類や両生類、ショウジョウバエなどのモデル生物と大きく発生様式が異なる哺乳類では、今回明らかにしたものとは異なるメカニズムで遺伝子が活性化される可能性があります。そのため、哺乳類初期胚の遺伝子発現開始(ZGA)におけるヒストン修飾の機能を今後明らかにすることで、生物全体における初期発生の理解が進展すると期待されます。これにより、初期発生における異常が原因とされる疾患について、その理解と治療法の開発へとつながる可能性があります。
補足説明
- 1.ヒストン修飾、クロマチン
クロマチンは、H2A、H2B、H3、H4の4種類があるヒストンタンパク質が複合体を形成して、その周囲をDNAが巻き付く基本単位(ヌクレオソーム)で存在している。このヌクレオソームでは、各ヒストンのアミノ酸残基の一部が"しっぽ"のように突出している。このアミノ酸残基に付加されたさまざまな化学修飾をヒストン修飾という。アセチル化(ac)、メチル化(me)、リン酸化(ph)などの種類があり、遺伝子発現の活性化・抑制との関連が知られている。 - 2.胚ゲノムの活性化(ZGA)
多くの動物において、受精直後には初期胚ゲノムからの遺伝子発現は起こらず、その代わりに卵子由来のRNAやタンパク質を用いて発生が進行する。その後細胞分裂を経る過程で、あるタイミングから初期胚ゲノムが一斉に活性化され、初期胚ゲノムからの遺伝子発現が開始される。この現象をZGAと呼ぶ。魚類の場合は、受精後約10回程度の細胞分裂を経た後にZGAが起こる。ZGAはZygotic genome activationの略。 - 3.エピゲノム
1個体内における全ての体細胞は同一の設計図であるゲノムを有するにもかかわらず、異なった形態や機能を有している。これは、細胞ごとにそれぞれの遺伝子の発現が制御されているからであり、この制御の分子的実態がDNAメチル化やヒストン修飾といった化学的修飾(エピゲノム)である。いわばゲノムという設計図の各ページ(遺伝子)に付いた付箋のようなもので、エピゲノムという付箋を目印にすることで、適材適所な遺伝子発現が制御されている。 - 4.初期胚におけるエピゲノムの動態
受精直後の初期胚においては、DNAメチル化やヒストン修飾といったエピゲノムのクロマチン上のパターンが動的に激しく変化する。魚類においては、受精直後には大半のヒストン修飾がクロマチン上に存在しないが、ZGAにおける遺伝子発現開始のタイミングから、一斉に各種のヒストン修飾がクロマチン上に蓄積する。 - 5.H3K27ac
ヒストンH3の27番目リジン(K)残基に付加されるアセチル化ヒストン修飾。活性状態にある遺伝子のプロモーターやエンハンサーに集積する。遺伝子発現との因果関係が盛んに研究されている。 - 6.H3K9ac、H4K16ac、H3K14ac
いずれも各種ヒストンのリジン(K)残基に付加されるアセチル化ヒストン修飾。H3K27acを導入する修飾酵素とは別の修飾酵素によって導入される。活性状態にある遺伝子との相関が知られる。 - 7.H3K4me2/3
ヒストンH3の4番目リジン(K)残基に付加されるメチル化ヒストン修飾。活性状態にある遺伝子のプロモーターに集積する。一般的な体細胞では、遺伝子発現との因果関係が知られている。 - 8.H3.3S31ph
ヒストンH3.3の31番目セリン(S)残基に付加されるリン酸化ヒストン修飾。H3K27acの修飾酵素の活性を亢進(こうしん)することが知られている。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業若手研究「テロメアにおけるヘテロクロマチンの機能解析(研究代表者:福嶋悠人)」、同特別研究員奨励費「人為的なエピゲノム操作によるヒストン修飾の世代間伝承機構の解明(研究代表者:福嶋悠人)」、同基盤研究(B)「魚類脂肪組織を対象とした栄養適応の発生生物学的解析(研究代表者:武田洋幸)」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業「全ライフコースおよび次世代におよぶエピジェネティック記憶の研究(研究代表者:武田洋幸)」による助成を受けて行われました。
原論文情報
- Hiroto S Fukushima, Hiroyuki Takeda, "Coordinated action of multiple active histone modifications shapes the zygotic genome activation in teleost embryos", Nature Communications, 10.1038/s41467-025-60246-x
発表者
理化学研究所
生命医科学研究センター 疾患エピゲノム遺伝研究チーム
学振特別研究員PD 福嶋 悠人(フクシマ・ヒロト)
京都産業大学 生命科学部
教授 武田 洋幸(タケダ・ヒロユキ)
発表者のコメント
受精後初めて遺伝子発現が開始される時期にだけヒストン修飾H3K27acの量が他の時期と比べ2~3倍に増えていることを偶然発見し、何か特殊な機能があるのではないかと予想したところから本研究がスタートしました。今後は哺乳類や特殊な発生様式を取る生物にも研究を発展させ、発生におけるヒストン修飾の機能をより広く明らかにすることを目指したいと思います。(福嶋悠人)
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
京都産業大学 広報部
Tel: 075-705-1411
Email: kouhou-bu@star.kyoto-su.ac.jp
