自閉スペクトラム症(Autism Spectrum Disorder:ASD)などの神経発達症や統合失調症などの精神疾患は、いまだに原因が不明です。症状や生い立ちを手掛かりに診断せざるを得ない状況にあり、根本的な治療法も確立されていません。そこに分子生物学的なアプローチで挑む髙田 篤 チームリーダーは、ゲノムデータから発症に関わる新たなメカニズムを発見しました。
ゲノムデータで脳にアプローチする
精神・神経疾患は「精神=心」の病気であり、原因は心の基盤である脳にあると考えられる。例えば内臓の病気であれば、臓器から組織を切り出して病気の原因や性質などを調べる病理診断も可能だが、生きた脳を切り出すことは極めて難しい。それが精神・神経疾患の病態解明や治療法開発が進みにくい理由の一つだ。一方で、近年は分子生物学や分子遺伝学が発展し、病気を分子レベルで理解することが可能になった。精神・神経疾患に対しても、DNAの配列を解析することにより、発症に関わる原因遺伝子の解明が進んでいる。
「2010年代から、エクソーム解析という、ゲノムの中のタンパク質に翻訳される領域(エクソン)の遺伝子配列を網羅的に調べ上げる方法が盛んに行われてきました。その結果、エクソン領域の変異がどのように精神・神経疾患の発症リスクに関わるかが分かってきました」。特定の遺伝子について、その機能を抑えるような遺伝子変異があると発症リスクが上がることも分かってきたという。
髙田 チームリーダーらはさらに研究を進め、二つの成果を発表した。一つは、エクソンだけではなく、タンパク質に翻訳されない非コード領域も含めた全ゲノムまで対象を広げたことで、発症リスクに関わる非コード領域の機能の一端を明らかにしたこと。もう一つは、ASDのリスクに関わる遺伝子(ASD関連遺伝子)の一つ、KMT2Cに変異のあるマウスを作製し、意外な知見を得たことだ。
非コード領域の相互作用に注目
ASDは、社会的コミュニケーションの問題や限定的な興味などが見られる神経発達症の一群で、多様な遺伝的要因が関与していることが分かっている。ASD関連遺伝子の特定に当たっては、両親の遺伝子からは検出されず、患者である子の遺伝子からのみ検出される新生の変異(デノボ変異)の研究が進められ、多くの成果を上げてきた。その中で髙田 チームリーダーが注目したのは、プロモーター領域でのデノボ変異が、ASD患者に多く見られるという報告だった。プロモーター領域は遺伝子のすぐ上流にあり、遺伝子発現のスイッチの役割を果たしている。
既知ASD遺伝子のすぐ上流のデノボ変異が特に発症リスクと強く関わるのではないかと予想した髙田 チームリーダーは、ASD患者5,044家系の全ゲノムを解析し、ASD関連遺伝子のすぐ上流にあるプロモーターの変異と、ASD発症の関係を統計的に調べた。しかし、予想に反して明らかな関連は見られなかったのだ。
ところで、ゲノムにはTAD(Topologically Associated Domain)と呼ばれる3次元の構造がある。複数の遺伝子と共にプロモーターなどの非コード領域が立体的に折りたたまれており、近くにある配列同士で物理的に作用し合っている。最近、あるTADのプロモーター領域に異変があると、同じTAD内ではあるが離れた位置にある他の遺伝子の発現を変化させる仕組みが働くことが報告されている(図1)。この仕組みに注目し、ASD関連遺伝子を含むTADと、含まないTADに分けて解析した結果、ASD関連遺伝子を含むTADのプロモーター領域にデノボ変異がある場合に、ASD患者が多いことが分かった。
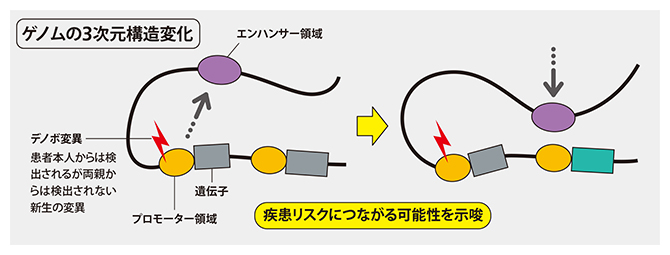
図1 ASDリスクにつながるゲノムの3次元構造(TAD)の変化
プロモーター領域にデノボ変異(赤印)があると、その影響で近くのエンハンサー領域(遺伝子の転写効率を増加させる配列)が移動して別のプロモーター領域に働きかけ、その下流のASD関連遺伝子(緑部分)の発現を促すと考えられる。
さらにASD患者で認められた変異をヒトiPS細胞に導入して実験したところ、TAD内だけでなく、細胞全体で、他のASD関連遺伝子や神経発達に関連する遺伝子の発現変動を誘発していた。「ゲノム全体の解析を進め、さらに詳細なASDの発症メカニズムを明らかにしていきたい」と研究を継続している。
モデル動物の行動でも検証
ASDの病態理解を深めるため、モデル動物での検証を進めた。まず、ASD関連遺伝子のKMT2Cに変異のあるマウスを作製。順天堂大学などとの共同研究で、その詳細な解析を実施した。KMT2Cは、遺伝子の発現を変化させる仕組み(クロマチン修飾)に関わる遺伝子で、その機能がASD発症に関わるとされている。このモデルマウスを用いて、初めて出会うほかのマウスに興味を示すかどうかで社会性を評価する試験を実施した。すると野生型マウスは知らないマウスの近くに長く滞在して興味を示していたのに対して、Kmt2c変異マウスは興味を示さなかった。これらにより、ASDの疾患モデルとして妥当だと確かめられた。
次に、KMT2Cの変異が広範囲な遺伝子の転写制御に影響しているかどうかを確かめるため、生後11週の変異マウスの脳内の遺伝子発現を網羅的に解析。変異マウスの脳では、統計的に有意に発現が上昇している遺伝子群と低下している遺伝子群が認められた(図2)。これらの変動遺伝子にASD関連遺伝子が含まれているかどうかを評価したところ、こちらでもやや意外な結果が観察された。
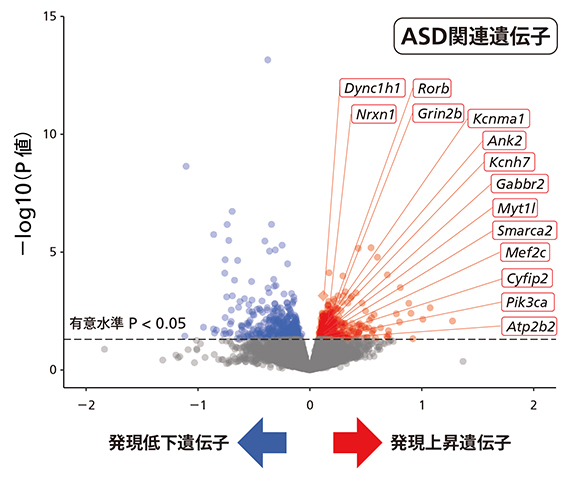
図2 Kmt2c変異マウスの脳における遺伝子発現の変化
生後11週のKmt2c変異マウスの脳で組織や細胞で発現している転写産物(RNA)を網羅的に解析するトランスクリプトーム解析を実施。有意に発現が上昇していた遺伝子群(赤)と発現が低下していた遺伝子群(青)があった。特に発現が上昇していた遺伝子群には偶然以上の確率でASD関連遺伝子(枠線で示す遺伝子)が含まれていた。
「変異によってKmt2cの制御機能が低下することで、ASD関連遺伝子の発現が低下するのではないかと想定していました。しかし、発現が上昇している遺伝子群の方にASD関連遺伝子が多く含まれていることは意外でした。直接的なターゲットだけではなく、間接的な影響が及ぶ遺伝子群まで見ていくことの大切さを認識しました」
精神科医としての思いが研究の原動力
近年はASDをはじめとした精神・神経疾患に関する大規模なゲノムデータを入手できるようになったが、まだ多くのゲノム領域が手つかずだ。
「これまでの研究で、限定的な領域だけを調べるのではなく、大規模かつ包括的なゲノム研究を進める必要があると分かりました。数十年後、がんをはじめとした多くの身体疾患の分子メカニズムがほぼ完全に解明されたとしても、原因臓器を直接分子レベルで調べることが困難な精神・神経疾患はそうはならない可能性が高いと思います。だからこそやりがいがあるので、若い研究者にチャレンジしてほしいですね」
この研究に生涯をかけたいと話す髙田 チームリーダーは、理研着任前に精神科医として診療に当たってきた経験を持つ。「精神・神経疾患は薬によって症状が改善することもありますが、まだ根本的な治療法はありません。症状によるつらさに加えて、病気に対する偏見などにより患者さんやご家族の人生にも影響することがあります。そのような状況で苦しむ患者さんを見てきただけに、根本的な治療法につながる成果を生み出していきたい。それが私が研究を続けている目的です」
(取材・構成:牛島 美笛/撮影:相澤 正。/制作協力:サイテック・コミュニケーションズ)
関連リンク
- 2024年3月26日プレスリリース「自閉スペクトラム症の新たなモデルマウスを開発」
- 2024年1月27日プレスリリース「ゲノム変異における『バタフライエフェクト」
この記事の評価を5段階でご回答ください

