指定難病「特発性間質性肺炎」の一種、特発性肺線維症(IPF)は、肺が線維化して呼吸困難になる病気です。老化や炎症でも発症することが分かっていますが、病態の解明や治療法の開発は進んでいません。茂呂 和世 チームリーダーは、自然免疫と病気の関係を調べる中で開発したモデルマウスが重要なカギを握ることを発見し、IPFの発症に自然免疫が関わっていることを明らかにしました。
治療法のない肺疾患の原因を探る
生物には、外から侵入してきた病原体などから自らを守る仕組み「免疫」が備わっている。それを担う免疫細胞は体にとって良い働きをする"正義の味方"と考えられがちだが、病気の原因になるなど"悪役"にも豹変する。免疫が過剰に反応して自分自身を傷つけてしまうアレルギーは、その最たるものだ。
IPFも、免疫が関わっていることが徐々に明らかになってきた病気の一つだ。肺の奥にある「肺胞」と呼ばれる小さな袋が集まった部分の壁(肺胞壁)が厚く硬くなり、呼吸が困難になる進行性の病気で、現時点では有効な治療法はなく、予後も良くない。
IPFを発症するリスク因子には、喫煙や化学物質など外的なものと、炎症や加齢による肺機能の低下といった内的なものがある。外的因子は肺胞の上皮細胞のDNAを傷つけることで、線維芽細胞からコラーゲンが過剰につくられ、肺胞壁が線維化すると考えられている。このメカニズムに基づき、肺の上皮細胞のDNA障害を誘導する薬を投与して肺線維症を起こさせたモデルマウスが研究に用いられてきた。しかし、このモデルマウスでは薬の効果が切れると肺の線維化が治まり実験が継続できない上、薬で症状を起こしているので内的因子の影響は調べることができない。
このような状況の中、茂呂 チームリーダーらは免疫細胞の一種「ILC2(2型自然リンパ球)」がIPFの発症に関係していることを見いだした。
アレルギー発症の実験が思わぬ結果に
ILC2は、茂呂 チームリーダーが大学院生だった2010年に発見し、以来アレルギー発症との関わりなどを研究してきた免疫細胞だ。
免疫には、もともと備わっている自然免疫と、ウイルスなど一度感染したことがある抗原の情報を記憶して働く獲得免疫の2種類がある。自然免疫で働くILC2は「上皮細胞が攻撃された」という情報をキャッチすると、敵が誰であるかに関係なく攻撃する。茂呂 チームリーダーらは、ILC2の働きがIFNγ(インターフェロンガンマ)という物質によって強く抑制されることを2016年に報告している。
今回は、外的因子の関与を除くため獲得免疫系の細胞を欠損させたRag2欠損マウスに、さらにIFNγに対する受容体を欠損させた遺伝子二重欠損(ダブルノックアウト)マウス(Ifngr1-/-Rag2-/-マウス)を作製し、内的因子だけでILC2が活性化し、アレルギーを発症するかどうか調べられるようにした。すると、加齢に伴いマウスの様子に思いもかけない変化が生じたのだという。
ある日、テクニカルスタッフの一人が「歳をとったマウスの肺が白くなっている」と気付いた。この発見をきっかけに、大瀧 夏子 研究生(慶應義塾大学大学院 医学研究科 博士課程 大学院生、取材当時)らが臨床的な特徴などと照らし合わせて詳細に調べてみると、なんとそのマウスがIPFを発症していることが確認されたのだ。このマウスは、薬や外的因子なしにIPFを発症する初めてのモデル動物となった。
「張り切り過ぎ」の自然免疫が病気を引き起こす
ILC2が活性化したIfngr1-/-Rag2-/-マウスは、10週齢くらいまでは健康だが、15週齢くらいになるとILC2が増加し始め、20週齢くらいになると肺胞壁の線維化が進んで呼吸困難になる(図1)。また、活性化したILC2が線維芽細胞のコラーゲン産生を誘導し、線維芽細胞がILC2を活性化するIL-33という物質も産生することから、ILC2と線維芽細胞が互いに活性化し合い、それが外的刺激なしに線維症が進行し続ける原因となる可能性が浮かび上がった(図2)。
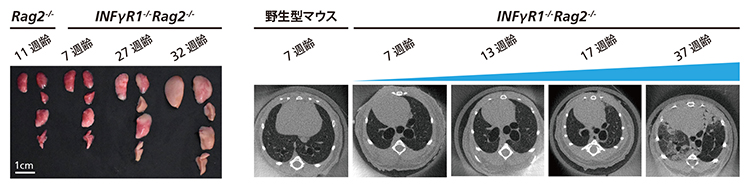
図1 ILC2を活性化したマウス
ダブルノックアウトによりILC2が活性化したIfngr1-/-Rag2-/-マウスの肺(左の写真)は高齢になるに従って白くなっていく。CT画像(右の5枚)でも17週齢くらいから白い部分が増えて線維化が進む。体重減少やコラーゲン量増加なども認められ、ヒトの臨床で使われる診断基準に照らしてもIPFを発症していることが分かる。
この研究成果は、喫煙と並ぶIPFのリスク因子、「加齢」による発症メカニズム解明につながる。さらには新しい治療法や治療薬開発に発展することも期待できる。
ILC2は、寄生虫やアレルゲン(アレルギーの原因物質)が体内に入り込んだときに「張り切り過ぎてしまう性質」があり、IPFにおいても傷ついた上皮細胞を必死になって修復しようとした結果、コラーゲンをつくらせ過ぎて肺胞壁の線維化を引き起こす(図2)。「そんなところに哀れみを感じてしまうのですが、現代人のほとんどを悩ませているアレルギーとの関わりも大きい免疫細胞でもあるので、今後もILC2が関わるあらゆる病気について研究していきます」
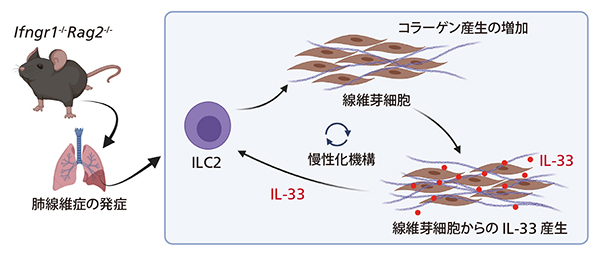
図2 IPF発症のメカニズム
ダブルノックアウトマウス(Ifngr1-/-Rag2-/-マウス)では、ILC2が活性化し、線維芽細胞からのコラーゲン産生を誘導し線維化が引き起こされる。また線維芽細胞はIL-33を発現することで、ILC2の活性化を助長する。
臨床医と共に歩む道
自然免疫システムについての基礎研究を行う研究室でありながら、実際の医療現場との距離は極めて近い。自然免疫と関わりが深いアレルギーや自己免疫疾患について幅広く展開する研究テーマのどれにも臨床医が参加しており、必要に応じて「実際の患者さんではそうはならない」といった意見をくれる。臨床医が研究室に来るだけでなく、研究チームのメンバーが病院で行われる症例検討のカンファレンスに参加させてもらうこともある。
「臨床の現場でどうやって診断されているのかを見て、ヒトとマウスの組織学的な違いなども学んだ上で研究できることが研究室の強みです。私たちはマウスを使った基礎的な研究をしていますが、その先にはヒトに続く道があることを臨床の医師たちが示してくれるので、間違った方向に向かっていないという自信があります」と、最後にとびきりの笑顔を見せた。
(取材・構成:牛島 美笛/撮影:相澤 正。/制作協力:サイテック・コミュニケーションズ)
関連リンク
- 2023年12月14日プレスリリース「特発性肺線維症の病態解明につながる新たなモデルマウスの開発」
この記事の評価を5段階でご回答ください

