「Gタンパク質共役型受容体(GPCR)」は、がん性疼痛や気管支ぜんそくなど多くの疾患に関わるタンパク質です。これまでGPCRを標的に多くの薬が開発されてきましたが、最近、限界を迎え、従来の方法では活性の高い薬が見つかりにくくなっています。そこで注目されているのが、既存薬と共に働いて、その効果を増強する「アロステリック調節薬」です。今回、今井 駿輔 上級研究員は、アロステリック調節薬の作用メカニズムを解明しました。
アロステリック調節薬への期待
GPCRは細胞膜に存在する受容体の一種で、細胞外から来たホルモンなどのシグナル因子が結合すると、その情報を細胞内へ伝える働きをしている。この情報伝達の際に、細胞内のGタンパク質に結合して活性化させることが名前の由来となっている。
ヒトは800種類以上のGPCRを持つと考えられており、それぞれがさまざまな生理機能に関わっている。その働きの増強/阻害によって、病気になった体を正常な状態に戻す効果が期待できることから、GPCRを標的に数多くの薬が開発されてきた。こうした薬のほとんどは、GPCRの細胞外側にある「結合ポケット」と呼ばれるくぼみに結合して作用する。しかし最近では、GPCRの活性をうまく引き出すような薬剤を新たに見つけるのが難しくなってきている。
「また、このような既存薬がGPCRの結合ポケットに結合しても、GPCRの活性化が完全には起きていないらしいことが分かってきました。代わりに、結合ポケットとは異なる部位に結合して、既存薬の作用を増強する『アロステリック調節薬』が注目されているのです」
従来の薬の限界を打ち破る新たな医薬品候補として期待されるアロステリック調節薬だが、その作用のメカニズムは不明な点が多く、理論的な創薬につながっていない。そこで今井 上級研究員は、アロステリック調節薬によるGPCRの構造変化の解明から、そのメカニズムに迫ろうと考えた。
オピオイド受容体で結合部位を明らかに
今回の研究対象には、GPCRの一つ、μ(ミュー)オピオイド受容体(MOR)を用いた(図1)。MORは痛みを抑制するシグナルを出す作用があり、鎮痛薬(モルヒネ)の標的でもある。研究チームはこれまで、溶液NMR法を用いて、MORが不活性化型、部分活性化型、完全活性化型という三つの構造を行き来する状態にあり、その比率が活性を規定することを突き止めていた。
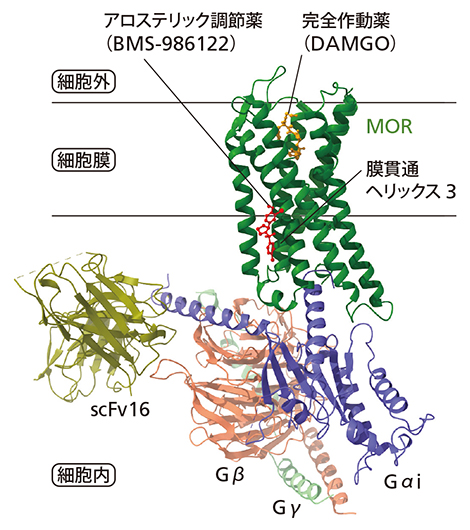
図1 今回明らかにしたμオピオイド受容体(MOR)の3次元構造(クライオ電子顕微鏡構造)
MORはGPCRの一つで、この仲間に特有の細胞膜内を7回貫通するヘリックス構造(緑)が見られる。図では完全動作薬が結合している部位(結合ポケット)に、通常、細胞外から来たシグナル因子が結合し、細胞内に情報を伝える。その際に細胞内のGタンパク質(Gαi、Gβ、Gγの3量体タンパク質)と結合して活性化する。scFv16は構造を安定化させるために加えた抗体。
「最も高い薬効を示す既存薬が単独で結合しても、活性を最も高める完全活性化型構造の存在比は低いままであることが分かりました。しかし、アロステリック調節薬が結合すると、MORが完全活性化型の構造を取る割合が増えるのです」
三つの構造の存在比はどのように操られているのだろうか。この謎を解く強力なツールとなったのが、嶋田 一夫 チームリーダーを研究代表者とする日本医療研究開発機構(AMED)のRNA創薬プロジェクト※により研究チームに導入された、超高磁場 NMR装置だ。「活性を発現している生理的な条件下でタンパク質をそのまま観測できる溶液核磁気共鳴法(溶液NMR法)から得られる動的な構造の情報を、タンパク質全体の構造を観ることのできるクライオ電子顕微鏡(クライオ電顕)の立体構造情報と組み合わせて、MORの"構造の変化"に迫りました」
クライオ電顕の観察から、アロステリック調節薬が結合したとき、MORの全体的な構造は大きく変わらないものの、MORの細胞膜内領域(膜貫通ヘリックス)を構成する二つのアミノ酸の間のクライオ電顕密度マップにわずかな変化があることが分かった。これは何を意味するのか。
- ※次世代治療・診断実現のための創薬基盤技術開発事業(RNA標的創薬技術)
タンパク質の動きを捉えるNMR法
NMR法では、磁場の中に置いた試料に電磁波を照射し、そこから放出される電磁波をNMRシグナルとして検出する。NMRシグナルからは、どの部位がどのくらいの時間スケールで運動しているかという情報も得られる。これを溶液試料に対して行うのが溶液NMR法だ。
溶液NMR法を用いると、MORを構成するアミノ酸のうち、283番目のメチオニン(M283)のNMRシグナルから、MORが取る三つの構造を見分けることができる。それぞれの構造に対応するNMRシグナルの強さを見ることで、溶液中でどの構造の存在比が高いかが分かる(図2)。
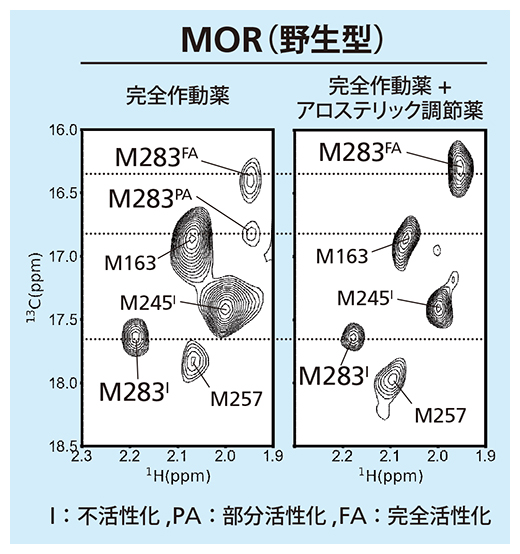
図2 MORの溶液NMR法による解析
MORが取る互いに異なる構造を反映するM283のシグナルは、2次元スペクトル上で三つの位置に観察され、それぞれ不活性化型(M283I)、部分活性化型(M283PA)、完全活性化型(M283FA)に対応する。シグナルの強度は、その構造の存在比を示す。完全作動薬単独と、完全作動薬+アロステリック調節薬のスペクトルを比較すると、アロステリック調節薬の付加により部分活性化型(M283PA)のシグナルが消えて完全活性化型(M283FA)のシグナルが増強した。
MORの完全活性化型とは、構造的には膜貫通ヘリックスの細胞質側が「開いて」細胞内のGタンパク質が結合しやすくなった状態だ。M283のNMRシグナルは、この膜貫通ヘリックスの開閉状態を反映している。では、アロステリック調節薬はどのように完全活性化型の割合を増やすのだろうか。
その機構として、クライオ電顕ではわずかな変化としてしか捉えられていなかったアミノ酸、アルギニン(R167)とチロシン(Y254)に着目し、MORが活性を発現している状態を直接観測できる溶液NMRで調べた。すると、アロステリック調節薬がMORに結合すると、R167とY254の相互作用が強まり、結果的に膜貫通ヘリックスが開いた状態で安定化されることが分かった。
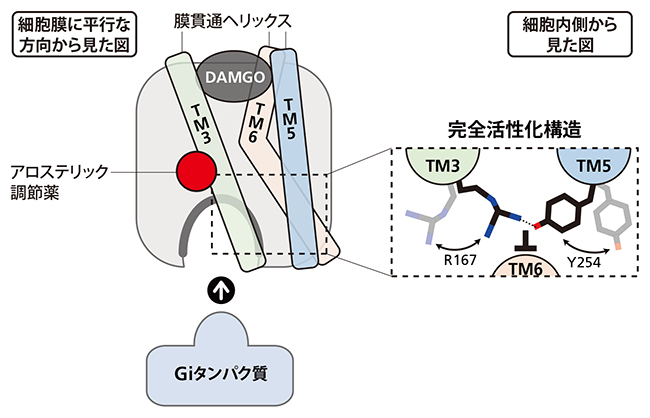
図3 アロステリック調節薬でMORの活性が上がる仕組み
アロステリック調節薬(赤丸)は膜貫通ヘリックス(TM)の一つTM3を押し込む。これによりMORを構成するアミノ酸のうちTM3に存在する167番目のアルギニン(R167)とTM5に存在する254番目のチロシン(Y254)が接近して互いに引き合い、TM6が閉じるのを邪魔する。TM6が開いている時間が延びることで、完全活性化構造の存在割合が上がり、MORの活性も上がる。
NMRで「動きを捉える生物学」の発展に貢献を
アルギニン(R167)とチロシン(Y254)は、MOR以外のGPCRにも広く共通するアミノ酸だ。今回の知見は、GPCR一般についてアロステリック調節薬を設計する際に重要なヒントになると期待できる。
今井 上級研究員自身は、「私は東京大学の薬学部の頃に嶋田 教授(当時)の研究室で、NMRを使った『動きを捉える生物学』を始め、その対象の一つがGPCRでした。タンパク質にはその機能に動きが必須であるものが多いことが分かってきたので、NMRの特徴を生かして生物学の発展に貢献したい」と語る。このような貢献が、創薬につながることに期待したい。
(撮影:相澤 正。/制作協力:サイテック・コミュニケーションズ)
関連リンク
- 2024年5月13日プレスリリース「アロステリック調節薬が構造平衡を変えて効く仕組み」
この記事の評価を5段階でご回答ください

