2009年10月14日
独立行政法人 理化学研究所
微生物の環境適応センサータンパク質の構造を解明
-光、熱、酸素、ストレスなどの環境変化への応答機構を発見-
ポイント
- センサードメインとリン酸化反応の触媒ドメインとの接触有無がスイッチ機能
- 環境の変化をリン酸化に変換する生体シグナル変換機構を提唱
- ヒトへの副作用のない新しい抗菌剤開発に期待
要旨
独立行政法人理化学研究所(野依良治理事長)は、微生物の環境適応センサータンパク質の構造を、世界で初めて明らかにしました。これは放射光科学総合研究センター、城生体金属科学研究室の城宜嗣主任研究員、山田斉爾基礎科学特別研究員、杉本宏専任研究員らによる成果です。
微生物は、光、熱、酸素、ストレス、栄養状態などがめまぐるしく変化する環境を感知し、その変化に適応して生きています。この環境変化の感知は、「二成分情報伝達系」と呼ぶセンサーシステムを使って行われています。二成分情報伝達系は、ヒスチジンキナーゼとレスポンスレギュレーターと呼ぶ2つのタンパク質からなるセンサーシステムで、環境変化をリン酸化という生体シグナルに置き換えています。ヒスチジンキナーゼは、ドメインと呼ぶパーツが、いくつかつながっているタンパク質で、これまでそれぞれのドメインの形は明らかになっていました。しかし、タンパク質全体の構造が不明であったために、「環境変化の感知をどのようにリン酸化反応に変換するのか?」という肝心の問題は、未解決のままでした。
研究グループは、大型放射光施設SPring-8※1を用いたX線結晶構造解析により、微生物のヒスチジンキナーゼに、レスポンスレギュレーターが結合した構造を解明することに成功しました。この結合した形から、ヒスチジンキナーゼを構成している環境変化を感知するセンサードメインと、リン酸化反応を行う触媒ドメインとの接触の有無が、「環境変化→リン酸化」という情報変換のスイッチのオン/オフになっていることを、世界で初めて明らかにしました。二成分情報伝達系は、ヒトには存在しないものの、病原菌が生存するために重要なシステムで、植物のホルモン(エチレン)作用でも重要な役割をしています。このため、今回の構造解析で得た知見は、新しい抗菌剤や植物の生育調節剤の創出など、人間の生活に大きな影響を及ぼすと期待されます。
本研究成果は、米国の科学雑誌『Structure』(10月14日号)に掲載されます。
背景
細菌やカビなどの微生物、さらに高等植物は、「二成分情報伝達系」と呼ぶセンサーシステムを備えています(図1)。この二成分情報伝達系は、微生物が光、熱、酸素、ストレス、栄養、金属イオンなど、めまぐるしく変化するさまざまな外部環境を鋭敏に感知し、その変化に適応して生存していくために、欠かせないシステムです。二成分情報伝達系は、「ヒスチジンキナーゼ」と「レスポンスレギュレーター」と呼ぶ2種類のタンパク質からできています。ヒスチジンキナーゼは、環境変化を感じ取るセンサードメイン、リン酸化反応を行う触媒ドメインや、二量化ドメインという3種のパーツで構成されています。このヒスチジンキナーゼは、センサードメイン部で環境変化を感じ取ると、触媒ドメインが生体エネルギーの基となるATP(アデノシン三リン酸)を使って、二量化ドメインにあるヒスチジンというアミノ酸にリン酸基を結合させます(リン酸化)。レスポンスレギュレーターは、さらにそのリン酸基をヒスチジンキナーゼから受取り、環境変化に適応できるようなタンパク質の発現や活性の調節を行っています。すなわち、二成分情報伝達系は、環境変化をリン酸化という、生体シグナルに変換する役割を担っています。
今までに、何十種類というヒスチジンキナーゼが発見されていますが、感知すべき環境変化が多種多様であるために、それらのセンサードメインは、それぞれ異なる構造をしています。しかし、興味深いことに、触媒ドメイン、二量化ドメインさらにレスポンスレギュレーターの基本構造は同一なため、「環境変化→リン酸化」の生体シグナル変換の機構は普遍的です。ヒスチジンキナーゼの、3つのドメインそれぞれの立体構造は明らかにされていましたが、全ドメインがつながった全体構造や、レスポンスレギュレーターとの複合体の構造は分からず、環境変化の感知がリン酸化反応のスイッチをどのようにオン/オフするのか?という疑問が残されていました。
2006年に研究グループは、好熱性細菌Thermotoga maritima※2のヒスチジンキナーゼとレスポンスレギュレーター複合体の全体構造を、SPring-8のX線小角散乱とX線結晶構造解析の2つの手法を駆使し、明らかにしました。しかし、当時のX線データはまだ4.5Åと分解能が低かったために、大まかな分子の外形しか見ることができず、生体シグナル変換のスイッチオン/オフのメカニズムまでは、説明することができませんでした。
研究手法と成果
研究グループは、2006年に解析したタンパク質試料の調製方法をさらに最適化することで結晶構造解析の高分解能化 (3.8Å)を達成すると同時に、セレン、水銀といった重原子でタンパク質分子に目印をつけ、全体構造の中での各ドメインの位置を正確に決めました(図2A)。一方、各ドメインの詳細な構造を、高分解能(1.6~1.9Å)のX線結晶構造解析で決定しました。この解析結果と重原子の目印を頼りに、全体構造に当てはめていくことで、“詳細な”全体構造を明らかにしました(図2B)。
これらの解析結果から、ヒスチジンキナーゼ2分子が二量体※3を形成し、そこに2分子のレスポンスレギュレーターが結合している構造が分かりました。この複合体の高分解能構造解析に成功したのは、世界初のことです。さらに、この研究最大の発見は、センサードメインのループ領域と触媒ドメインの一部分が相互作用し、βシート※4を形成している構造を観察したことです(図3)。
このセンサードメインのループ領域は、根粒菌※5の酸素センサータンパク質FixLに、酸素が取り込まれた際に引き起こす構造変化の部位の状態と一致していました。酸素センサータンパク質FixLも、二成分情報伝達系に属し、酸素濃度を感知して窒素固定を制御しているヒスチジンキナーゼです。このセンサードメインの構造は、当研究グループが約10年前に明らかにしています(Journal of Molecular Biology,2000)。今回、研究グループが観察したセンサードメインのループ領域が、触媒ドメインの一部分と相互作用している構造は、センサードメインが触媒ドメインの動きをロックしている、いわばシグナル変換が“スイッチオフ”の状態になっているといえます。一方、センサードメインが、外部環境の変化を感知すると、このロックが外れ“スイッチオン”となり、触媒ドメインは少し離れたところにある二量化ドメインまで移動可能となり、そこにあるヒスチジンをリン酸化できるようになります。研究グループは、このような「環境変化→リン酸化」の生体シグナル変換のメカニズムを提唱しました(図4)。
今後の期待
私たちの身近に生育している大腸菌には、実に30種類もの「二成分情報伝達系」のセンサーシステムが存在しています。このことからも、二成分情報伝達系は、微生物が生きていくために欠かせない環境適応システムであることが理解できます。実は、病原菌が、私たちの身体に入り込み感染する時も、この「二成分情報伝達系」が使われています。一方で、このヒスチジンキナーゼや類似タンパク質は、現在のところヒトを含む脊椎動物にはまったく見つかっていません。この事実を反映して、このヒスチジンキナーゼを標的として、薬剤開発を行っている近畿大学などの研究グループが、いくつかあります。従って、今回、研究グループが明らかにした立体構造を基に、二成分情報伝達系に特異的に作用し、その制御メカニズムを停止するような薬を作ることができると、ヒトへの副作用がないまったく新しいタイプの抗菌薬剤となることになります。
また、植物ホルモンであるエチレンの受容体タンパク質も、二成分情報伝達系のヒスチジンキナーゼです。例えば、青いバナナや固いキウイを成熟させるために、エチレンガスで処理する手法は広く活用されています。リンゴは、活発にエチレンを生成するため、青菜をリンゴと一緒に冷蔵庫で保存すると、すぐにしおれてしまいます。このように、エチレンは、植物の成熟・老化に関連する重要なホルモンで、紅葉や落葉にも関係しているといわれています。切り花を長持ちさせるために、銀の化合物を添加した水を与えるのは、エチレン受容体の機能を阻害するためです。今回の研究成果は、微生物の二成分情報伝達系を対象としていますが、その生体シグナル変換機構の普遍性を考えると、さらに研究を進めることで、高等植物の生育を制御できることが可能になると考えています。
発表者
理化学研究所
放射光科学総合研究センター 利用技術開拓研究部門 城生体金属科学研究室
主任研究員 城 宜嗣(しろ よしつぐ)
Tel: 0791-58-2817 / Fax: 0791-58-2818
お問い合わせ先
播磨研究所 研究推進部 企画課Tel: 0791-58-0900 / Fax: 0791-58-0800
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.大型放射光施設SPring-8
兵庫県の播磨科学公園都市にある、世界最高の放射光を生み出す理化学研究所の施設。SPring-8の名前はSuper Photon ring-8 GeVに由来。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げた時に発生する、細く強力な電磁波のこと。SPring-8ではこの放射光を用いて、ナノテクノロジー、バイオテクノロジーや産業利用まで幅広い研究を行っている。 - 2.好熱性細菌 Thermotoga maritima
活火山付近の海底堆積物中に生息する超好熱性細菌。80℃という最適成育温度を持つ。そのタンパク質は高い安定性を持ち、結晶化もしやすいことから構造解析などの実験のサンプルとして用いられる。 - 3.二量体
2つの分子やサブユニット(単量体)が、物理的・化学的な力によりまとまった分子。二量体を形成することを、二量体化という。同一分子の二量体をホモ二量体、異種分子による二量体をヘテロ二量体という。このケースにおけるヒスチジンキナーゼは、ホモ二量体。 - 4.βシート
タンパク質の二次構造の1つ。いくつかの隣り合ったペプチド鎖が、水素結合により平行に連なることで形成される平面構造。 - 5.根粒菌
マメ科植物の根に根粒を形成して共生する細菌。根粒菌は大気中の窒素をアンモニアへ変換し、植物に窒素源として供給する。植物からは光合成産物を供給してもらうことで、共生関係が成り立っている。
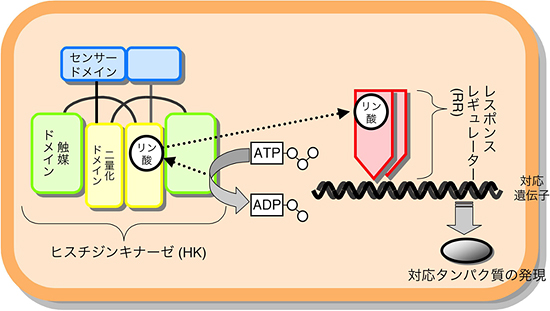
図1 微生物の環境適応システム「二成分情報伝達系」模式図
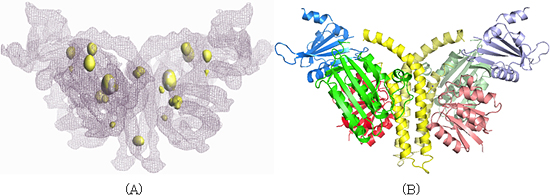
図2 ヒスチジンキナーゼとレスポンスレギュレーターの複合体構造
(A) 紫色の網目が分子全体の電子密度図、黄色の球がセレン原子の位置を示す。
(B) 全体構造のリボンモデル。
青:センサードメイン 黄:二量化ドメイン 緑:触媒ドメイン
赤:レスポンスレギュレーター
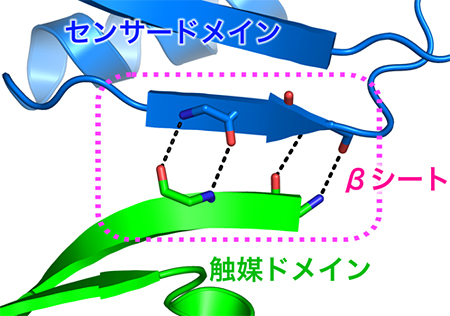
図3 センサードメインと触媒ドメインの間で形成するβシート
青で示すセンサードメインと緑色で示す触媒ドメインが水素結合(点線)し、ドメイン間βシート(点線で囲った部分)を形成している。
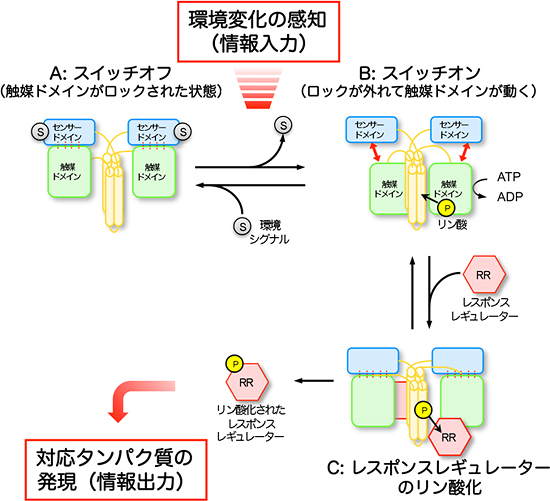
図4 ヒスチジンキナーゼが環境変化感知をリン酸化反応に変換するメカニズムの模式図
