2011年10月27日
独立行政法人 理化学研究所
ヒトZIP13が二量体を形成して亜鉛トランスポーター機能を発揮
-亜鉛代謝異常に起因する疾患解明と治療方法開発に貢献-
ポイント
- 亜鉛トランスポーターの輸送メカニズムの解明に道
- ヒトZIP13は細胞内亜鉛濃度の上昇に寄与
- 細胞内情報伝達を制御する「亜鉛シグナル」の実体解明が前進
要旨
独立行政法人理化学研究所(野依良治理事長)は、細胞内の亜鉛濃度を精密に制御する亜鉛トランスポーター※1の1つ「ZIP13」が、亜鉛の輸送機能に必要と予想される二量体※2を形成していることを発見しました。これは、理研免疫・アレルギー科学総合研究センター(谷口克センター長)サイトカイン制御研究グループの深田俊幸上級研究員、平野俊夫グループディレクター、生命分子システム基盤研究領域の横山茂之領域長と、大阪大学大学院生命機能研究科の賓範浩連携大学院生らの研究グループによる成果です。
生命活動に必要な微量元素である亜鉛は、濃度が一定値を下回ると、成長遅延、骨代謝障害、免疫不全などさまざまな病気をもたらします。体内の亜鉛濃度は、濃度を上昇または下降させる機能を持つ亜鉛トランスポーターという膜タンパク質によって制御されていますが、その分子形態と亜鉛輸送のメカニズムはほとんど解明されていません。2008年に研究グループは、亜鉛トランスポーターの1つZIP13がマウスの結合組織の発生に関与すること、その制御に関わるBMP/TGF-β※3の情報伝達に極めて重要であること、さらにこのことがヒトにも同様であることを見いだしました。しかし、ZIP13タンパク質そのものの特徴はまだ解明されていませんでした。今回、精製したヒトZIP13タンパク質とヒトZIP13を発現させた細胞株を用いた生化学的な実験によって、ヒトZIP13タンパク質が細胞内で亜鉛濃度の上昇に関わる亜鉛トランスポーターであること、さらにヒトZIP13タンパク質が亜鉛の輸送機能を担うと予測される二量体を形成することを発見しました。
今回の発見と精製ヒトZIP13タンパク質などの材料は、まだ明らかになっていない哺乳類の亜鉛トランスポーターの立体構造解析、亜鉛輸送メカニズムの解明、亜鉛トランスポーターの機能不全が原因となる疾患の治療法の開発、さらには細胞内情報伝達を制御する「亜鉛シグナル」の実体の解明を大きく前進させる成果です。
本研究の一部は2007年から始まった文部科学省大規模研究開発事業「ターゲットタンパク研究プログラム」の一環として行ったものであり、本研究成果は米国の科学雑誌『The Journal of Biological Chemistry』(11月18日号)に掲載されるのに先立ち、オンライン版(11月11日付け:日本時間11月12日)に掲載されます。
背景
亜鉛は生命活動に必須な微量元素の1つで、その代謝異常は糖尿病や味覚異常、皮膚疾患、生殖機能低下、免疫不全などの原因となることが知られています。細胞の亜鉛の濃度は、その輸送体である亜鉛トランスポーターによって制御されており、細胞内に存在する亜鉛は、細胞内情報の伝達制御に重要な役割を果たしていると考えられています。例えば、亜鉛トランスポーターZIP6は転写因子Snail※4の関わる細胞運動を制御し※5、また、Toll-like receptor※6からのシグナルが、亜鉛トランスポーターの発現を変化させることで細胞内の亜鉛濃度を変え、免疫応答に重要な樹状細胞の機能を制御していることが分かっています※5。
2008年に研究グループは、哺乳類における亜鉛の恒常性の意義を追求するために、当時まだ亜鉛トランスポーターとしての役割が未知であったZIP13を欠損させたマウス(ZIP13ノックアウトマウス※7)を作製し、マウスにおけるその役割について検討しました。その結果、ZIP13ノックアウトマウスは成長遅延を示し、骨、歯、皮膚などの硬組織や結合組織にも異常が見つかりました(図1)。また、ZIP13は、骨、歯、血管などの組織の形成に作用するBMP(Bone Morphogenetic Protein)や、さまざまな細胞の増殖や分化、胚発生、結合組織の形成、骨形成などに作用するTGF-β(Transforming growth factor-β)の情報伝達制御に関わることも分かりました。さらに、このZIP13ノックアウトマウスと高い相関性を示す、新しいタイプのエーラスダンロス症候群患者※8を見いだし(図1)、ZIP13のN末端から2番目の細胞膜貫通ドメイン※9内の変異を病原性機能喪失型変異として同定しました。このことから、マウスにおいてZIP13が結合組織の発生とBMP/TGF-βの情報伝達に極めて重要であり、ヒトにおいても同様の役割のあることが示されました。
しかし、亜鉛輸送機能をはじめとするヒトZIP13タンパク質そのものの性質については未知の部分が多く、まだよく分かっていません。そこで研究グループは、詳細な生化学的解析によってヒトZIP13タンパク質の特徴の解明に挑みました。
研究手法と成果
ヒトZIP13タンパク質の機能と細胞内のどこに局在しているかを解明するために、ヒトZIP13タンパク質を分子構造分析シミュレーションソフト、生化学実験、共焦点顕微鏡観察によって解析しました。その結果、ヒトZIP13タンパク質はゴルジ体に局在する8回の細胞膜貫通ドメインを持つ亜鉛トランスポーターであることが分かりました。
次に、ヒトZIP13のゴルジ体における配置を検討するために、タンパク質分解酵素によってヒトZIP13タンパク質がどのように分解されるかを解析しました。その結果、ヒトZIP13のN末端とC末端がゴルジ体の内側に存在すること、さらにZIP13の細胞質側領域にタンパク質分解酵素によって分解を受けるような「比較的長い親水性領域」が存在することが分かりました。このアミノ酸配列は他の亜鉛トランスポーターにはなくヒトZIP13タンパク質に特徴的であり、この領域をInt-L2(Intracellular loop2)と命名しました。
次に、ZIP13の複合体の構造を解明するために、Native-PAGE※10やタンパク質架橋剤で処理したサンプルを用いたSDS-PAGE※10などにより、精製したヒトZIP13タンパク質やヒトZIP13タンパク質を発現させた細胞株を解析したところ、ヒトZIP13タンパク質は二量体の構造を形成していることを確認しました(図2A)。さらに、異なる標識を付けたZIP13タンパク質を用いて、この二量体がZIP13どうしで構成されていることを確認し、ヒトZIP13が単一分子の二量体を形成していることが分かりました。
ヒトZIP13タンパク質の亜鉛イオンの輸送能力を精査するために、細胞質の亜鉛濃度に比例して発現が上昇するMT1(Metallothionein 1)遺伝子と、亜鉛特異的な検出試薬であるFluoZin-3を用いて、細胞質の亜鉛濃度の変化を検討しました。その結果、ヒトZIP13を発現させた細胞で、MT1遺伝子の有意な発現上昇とFluoZin-3蛍光強度の上昇(図2B)を確認しました、このことから、ヒトZIP13は細胞内亜鉛濃度の上昇に大きく寄与していることが分かりました。
以上の結果から、ヒトZIP13タンパク質は、8回の細胞膜貫通ドメインから構成され、そのN末端とC末端の両方がゴルジ体の内側に配置され、細胞質側に特徴的な親水性領域を有する膜タンパク質であること、さらに、ZIP13は二量体を形成し、細胞質の亜鉛濃度の上昇に寄与する細胞内亜鉛トランスポーターであることが明らかになりました(図2C)。
今後の期待
今回の発見と開発した実験材料は、亜鉛トランスポーターによる亜鉛輸送のメカニズムの解明、亜鉛トランスポーターの構造解析、亜鉛トランスポーターや亜鉛代謝異常に起因する疾患の解明と治療方法開発に貢献することが期待できます。さらに、亜鉛がどのように細胞の中で振る舞っているのか、細胞内のシグナル分子として機能する「亜鉛シグナル」の実体の解明に大きく貢献することが期待できます。
原論文情報
- Bum-Ho Bin, Toshiyuki Fukada, Toshiaki Hosaka, Satoru Yamasaki, Wakana Ohashi, Shintaro Hojyo, Tomohiro Miyai, Keigo Nishida, Shigeyuki Yokoyama, Toshio Hirano.“Biochemical characterization of human ZIP13 protein: a homo-dimerized zinc transporter involved in the Spondylocheiro dysplastic Ehlers-Danlos syndrome”. Journal of Biological Chemistry, 2011, Vol. 286, page 40255-40265 doi: 10.1074/jbc.M111.256784
発表者
理化学研究所
免疫・アレルギー科学総合研究センター
サイトカイン制御研究グループ
上級研究員 深田 俊幸(ふかだ としゆき)
Tel: 045-503-7075 / Fax: 045-503-7054
お問い合わせ先
横浜研究推進部企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.亜鉛トランスポーター
生体内の亜鉛の恒常性維持を担う亜鉛の輸送体であり、その構造的特徴からZIPとZnTトランスポーターに分類される。参考文献:Fukada and Kambe, Metallomics 2011 (Tutorial Review) - 2.二量体
2つの同種または異種の分子が物理的または化学的な力によってまとまってできた複合体。多くの膜タンパク質において、複合体を形成して機能を発揮していることが報告されている。今回発見したZIP13の場合は、2つのZIP13タンパク質どうしが会合している。 - 3.BMP/TGF-β
TGF-β:Transforming growth factor-β(TGF-β)は、細胞増殖、細胞分化、胚発生、結合組織の形成、骨形成などに広域な生物学的現象に作用する増殖因子。
BMP:Bone Morphogenetic Protein(BMP)はTGF-βファミリーに属する増殖因子で、骨、歯、血管等の組織の形成に重要に作用する。 - 4.Snail
Snailはzinc-finger型転写因子の1つで、ショウジョウバエより中胚葉形成に必須の分子として単離され、上皮間葉移行を誘導する代表的な分子として認識されている。 - 5.参考文献
Fukada, J.Biol.Ionrg.Chem. 2011 (Review) Yamashita, Nature 2004 Kitamura, Nat. Immunol. 2006 - 6.Toll-like receptor
動物細胞に表面にある受容体タンパク質で、様々な病原体を認識して自然免疫機能において重要な働きをする。Toll-like receptorを介したシグナル伝達が自然免疫機能の誘起に必要である。 - 7.ノックアウトマウス
特定の遺伝子を人為的に欠損させたマウス。特定の遺伝子の個体や細胞における機能の解明に用いる。 - 8.エーラスダンロス症候群
結合組織を形成するコラーゲンの異常によって、皮膚の異常な伸展や脆弱性の亢進、血管が弱くなることによる出血、関節の異常な可動性亢進などが見られる遺伝性疾患。深田らが2008年に報告した新しいタイプのエーラスダンロス症候群 (図1)は、現在は「Spondylocheiro dysplastic form of Ehlers-Danlos syndrome (SCD-EDS)」と呼称されている。 参考文献:Fukada, PLoS One 2008 - 9.細胞膜貫通ドメイン
細胞膜やゴルジ体などの細胞内構造体に局在する膜タンパク質が持つ、膜構造を貫通する領域 - 10.Native-PAGEとSDS-PAGE
Native-PAGE(Native-Poly-Acrylamide Gel Electrophoresis)は、タンパク質を変性させない状態での電気泳動。タンパク質の構造や複合体形成が泳動状態に反映される。 SDS-PAGE(Sodium Dodecyl Sulfate-Poly-Acrylamide Gel Electrophoresis)は、SDSの変性作用と還元剤によるタンパク質内のジスルフィド結合の切断により、タンパク質の分子量に反映した電気泳動像が得られる。
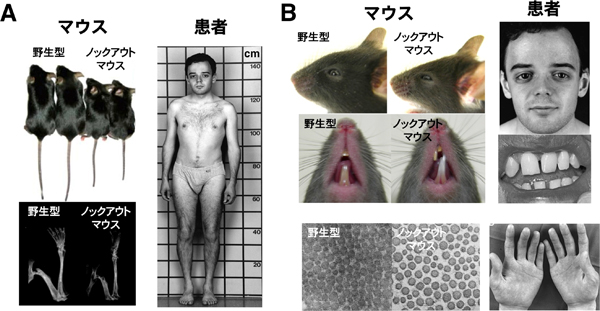
図1 ZIP13ノックアウトマウスとエーラスダンロス症候群患者
- A: ZIP13ノックアウトマウス(生後5週齢)とエーラスダンロス症候群患者(当時22歳)のそれぞれにおける成長遅延、長骨の萎縮と骨密度の低下。
- B: ZIP13ノックアウトマウスとエーラスダンロス症候群患者は、眼瞼裂斜下、歯科形成異常、コラーゲン減少をともなう皮膚の脆弱化を呈する。
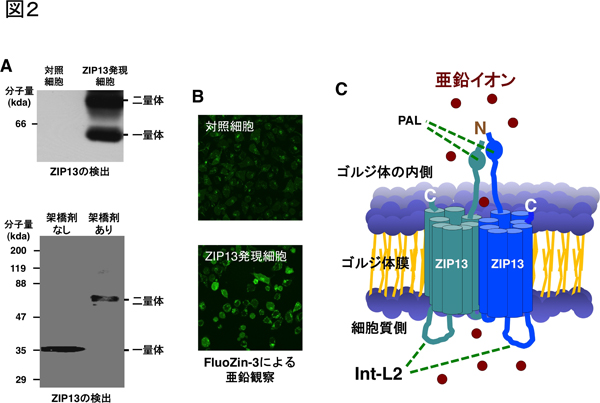
図2 ヒトZIP13タンパク質は二量体を形成する亜鉛トランスポーターである
- A: Native-PAGEによって、ヒトZIP13タンパク質の二量体の分子量に相当するバンドを検出(上段)。タンパク質架橋剤とSDS-PAGEによるヒトZIP13タンパク質の二量体の検出(下段)。
- B: ヒトZIP13の過剰発現により、細胞内亜鉛濃度の上昇が亜鉛検出試薬FluoZin-3によって緑蛍光色の発光として観察される。
- C: ヒトZIP13はゴルジ体の内側にN末端とC末端を配置し、細胞質側にヒトZIP13に特徴的な環状配列「Int-L2」を持つ、二量体を形成する細胞内亜鉛トランスポーターである。
N:N末端、C:C末端、PAL:ZIPファミリー亜鉛トランスポーターに特有なプロリン-アラニン-ロイシン配列
