ポイント
- 腸管ではヘルパーT細胞がキラー様T細胞に変化する
- ヘルパーT細胞には細胞機能プログラムを再び書き直す能力がある
- 人為的なT細胞分化誘導法による新たな免疫疾患の治療法開発に期待
要旨
理化学研究所(野依良治理事長)は、食物や細菌に常にさらされている腸内環境では、免疫応答の司令塔として重要なヘルパーT細胞[1]が、異物を認識して破壊するキラーT細胞[2]と同様の機能を持つキラー様T細胞へと機能変化できることを解明しました。これは、理研免疫・アレルギー科学総合研究センター(谷口克センター長)免疫転写制御研究グループの谷内一郎グループディレクターと米国のラホイヤアレルギー・免疫研究所(La Jolla Institute for Allergy & Immunology:LIAI)のヒルデ シェルートル(Hilde Cheroutre)教授(免疫・アレルギー科学総合研究センター 環境応答制御研究ユニット ユニットリーダー兼務)らの共同研究グループによる成果です。
病原体から身体を守る免疫反応で重要な働きをするT細胞は、大きくヘルパーT細胞とキラーT細胞に分類されます。これら2種類のT細胞は、胸腺[3]で共通な前駆細胞からそれぞれ分化します。最近の研究から、ヘルパーT細胞は、病原体の種類や周りの免疫細胞との関係により細胞の機能を変化できる柔軟性(分化可塑性[4])を持つことが明らかになってきました。しかし、これまでの通説では、胸腺での前駆細胞からヘルパー/キラーT細胞への運命決定は不可逆的であり、いったん胸腺でヘルパーT細胞に運命決定された細胞は、その後キラー様T細胞には変化しないと考えられてきました。
共同研究グループは、腸管で働くT細胞の種類とその機能、分化経路について詳細に解析しました。その結果、一部のヘルパーT細胞がキラーT細胞と同様の機能を持つキラー様T細胞に機能変化していることを見いだしました。さらに、その機能変化に必要な遺伝子発現の制御機構を解明しました。
この成果は、免疫細胞が環境に対応して機能変化して免疫応答を調節していることを明らかにしたものであり、免疫応答の仕組みに関する従来の通説を覆す新たな視点といえます。今後、人為的な免疫応答の制御や、ヘルパーT細胞とキラーT細胞の機能を併せ持つ新しいT細胞を作り出せる可能性があり、免疫疾患の新たな治療法の開発につながると期待できます。本研究成果は、米国の科学雑誌『Nature Immunology』に掲載されるに先立ち、オンライン版(1月20日付け:日本時間1月21日)に掲載されます。
背景
病原体による感染症から身体を守り、がん細胞を駆逐するなどの重要な働きを担う免疫応答には、それを調節する司令塔の「T細胞」があります。T細胞は、大きく「ヘルパーT細胞」と「キラーT細胞」に分けられ、これらのT細胞は、CD4とCD8と呼ばれる細胞表面マーカーの発現パターンにより、簡単に見分けることができます。ヘルパーT細胞は、CD4だけを発現(CD4+CD8-)し、キラーT細胞はCD8だけを発現(CD4-CD8+)します。また、ヘルパーT細胞とキラーT細胞は共通の祖先である前駆細胞を持ち、胸腺で分化・成熟します。この前駆細胞は、CD4とCD8を共に発現していることからDP胸腺細胞(CD4+CD8+)と呼ばれます。つまり、DP胸腺細胞はヘルパーT細胞になるか、キラーT細胞になるか運命選択を行い、ヘルパーT細胞に決定された場合はCD8の発現を消失しCD4+CD8-の顔をしたヘルパーT細胞に、キラーに決定された場合はCD4の発現を消失してCD4-CD8+の顔をしたキラーT細胞に分化します。しかし、DP胸腺細胞がどのようにしてヘルパー/キラーT細胞へそれぞれ分化するのか分かっておらず、その遺伝子発現の制御機構は長い間不明のままでした。
異なる機能を持つ細胞(例えばヘルパーT細胞とキラーT細胞)では、ゲノム情報からそれぞれの細胞になるために必要な特定の遺伝子の発現を調節することで、異なる機能を獲得します。遺伝子発現を調節(転写調節)する核内タンパク質は、「転写因子[5]」と呼ばれます。DP胸腺細胞のような前駆細胞は、転写因子によって特定の遺伝子群の発現を制御するプログラムを作動させ、どの細胞に分化していくかの運命を決定します。これまで谷内グループディレクターらは、2002年にキラーT細胞への分化に重要なRunx転写因子を同定し(Taniuchi et al. Cell 111, 621-633,2002)、2008年にはヘルパーT細胞への分化に重要なThPOK転写因子[6]の発現を調節する重要な分子メカニズムを解明(Setoguchi et al. Science 319:816-819, 2008)してきています(図1)。
これまで、DP胸腺細胞からのヘルパー/キラーT細胞への運命決定は不可逆的であり、いったん決定された運命はその後2度と変更できないと考えられてきました。しかし、最近の研究成果から、ヘルパーT細胞には柔軟な分化能(分化可塑性)があり、あるタイプのヘルパーT細胞から別のタイプのヘルパーT細胞に機能変化できることが分かっています。また、別の研究から、腸管の上皮細胞の間に入り込んでいる上皮細胞間リンパ球(Intra Epithelial Lymphocytes : IEL)[7]と呼ばれる特殊なT細胞群には、CD4とCD8を共に発現しているCD4+CD8+ IEL細胞の存在が知られていました。しかし、このCD4+CD8+ IEL細胞の機能や分化経路は不明でした。
シェルートル教授らは、正常のマウスの脾臓(ひぞう)からヘルパーT細胞を分離し、T細胞を持たない別の免疫不全状態のマウス(免疫不全レシピエントマウス[8])に移入すると、移入したヘルパーT細胞の一部が腸ではCD8を発現してCD4+CD8+という別の顔を示すIEL細胞に変化していることを見いだしていました。このことは、ヘルパーT細胞に運命決定された細胞がキラーT細胞に変化する可能性を示唆します。そこで理研の研究グループは、シェルートル教授とともに、胸腺で最初にヘルパーT細胞になるのに必要なThPOK転写因子とCD4+CD8+ IEL細胞に着目し、共同研究を開始しました。
研究手法と成果
(1)キラーT様細胞へ機能変化するにはThPOK転写因子の発現消失が必要
ヘルパーT細胞の分化の引き金となるThPOK転写因子は、ヘルパーT細胞の目印としてCD4以上に重要で、ヘルパーT細胞がその機能を発揮するために必須のタンパク質です。共同研究グループは、まずThPOK転写因子の発現について調べました。Thpok転写因子の発現の様子を観察するために、緑色蛍光タンパク質(Green Fluorescence Protein:GFP)をThpok遺伝子内に組み込んだトランスジェニックマウス[9](ThPOK-GFPマウス)を作製しました。
ThPOK-GFPマウスの脾臓から分離精製したヘルパーT細胞を免疫不全レシピエントマウスに移入したところ、腸管に移動してCD4+CD8+ヘと変化したIEL細胞ではThPOK-GFPの発現は消失していました。このことは、キラーT細胞の特徴であるCD8を発現しているだけでなく、ヘルパーT細胞であるために必要なThPOK転写因子の発現を失っていることを示します。つまり、マーカーとしての細胞の顔だけでなく、転写因子の発現消失という遺伝子発現プログラムも変化していることを示唆します。そこで、CD4+CD8+IEL細胞の詳細な遺伝子発現パターンと試験管内での細胞機能を調べました。その結果、この細胞はキラーT細胞の特徴となる多くの遺伝子を発現しており、さらにキラーT細胞としての機能を持つことが判明しました。つまり、腸管に移動したヘルパーT細胞の一部はキラーT細胞と同様の機能を持つCD4+CD8+のキラー様T細胞に変化できることが分かりました。
次に、ThPOKの発現消失は単なる偶然の一致なのか、キラー様T細胞への変化に重要な出来事なのかを確かめるためThPOK転写因子を常に発現するようにしたヘルパーT細胞を作製し、免疫不全レシピエントマウスに移入したところ、CD4+CD8+細胞は出現しなくなり、またキラーT細胞に特徴的な他の遺伝子の発現も見られませんでした。この結果から、ヘルパーT細胞からCD4+CD8+のキラー様T細胞ヘの変化にはThPOK転写因子の発現消失が必要であることが分かりました。
(2)ThPOK転写因子の発現消失のメカニズム
次にThPOK転写因子の発現がどのようにして消失するかについて調べました。理研の研究グループは、胸腺内でキラーT細胞への運命決定が起こる時に、ThPOK転写因子を作り出す遺伝子(Thpok遺伝子)内にある遺伝子の発現を負に制御するサイレンサー[10]が働いて、ThPOK転写因子が発現しないように調節しているメカニズムを発見していました注1。つまり、このサイレンサーが機能を発揮し、ThPOK転写因子の発現を妨げることで、胸腺内ではDP前駆細胞からヘルパーT細胞への分化経路が遮断されて、キラーT細胞への運命決定が起こります。
このことから共同研究グループは、腸管でおこるヘルパーT細胞からキラーT細胞ヘの変化の際にも、胸線内と同じメカニズム働くか調べることにしました。その為にはこのサイレンサーを持たないヘルパーT細胞を用いた実験を行う必要があります。そこで、共同研究グループは、遺伝子操作によって新しい遺伝子変異マウスを作製しました。このマウスを用いると、一旦ヘルパーT細胞を取り出した後に、試験管内でサイレンサー領域除去し、人為的にサイレンサーを除いたヘルパーT細胞を作ることが出来ます。このヘルパーT細胞を免疫不全レシピエントマウスに移入した実験の結果、CD8+を発現するキラー様T細胞の出現が激減したことから(図2)、ThPOK転写因子の発現消失にはサイレンサー領域が重要であることが分かりました。つまり、胸腺でのキラーT細胞への運命決定と同じメカニズムで、腸管でのヘルパーT細胞からキラー様T細胞へ変化していることを突き止めました。
注1:2008年2月8日プレス発表
(3)正常マウス体内でのヘルパーT細胞の運命の追跡
以上の結果は、T細胞を持たない免疫不全レシピエントマウスに、別のマウスから取り出した細胞を移入するという実験手法で得られたものです。この実験だけでは、ヘルパーT細胞からキラー様T細胞への変化は免疫細胞がないという特殊な環境下でおこる特殊な出来事なのか、健康な正常マウスでも通常に起こることなのか分かりません。そこで、正常マウスで、いったんヘルパー細胞になった細胞が、その後どのような分化運命をたどるのか調べることにしました。実際には、胸腺内のヘルパーT細胞に、細胞分裂などを経て別の細胞など(ヘルパーT細胞の子孫)になっても消えない黄色蛍光タンパク質(YFP)で印をつけることが可能なマウスを作製し、ヘルパーT細胞の子孫の細胞を追跡しました(Fate mapping法)。実験の結果、正常マウスの腸に存在するCD4+CD8+キラー様T細胞は、いったんThPOK転写因子を発現してヘルパーT細胞になった細胞の子孫から生じたと分かりました(図3)。
以上の結果は腸のような特別な環境下ではヘルパーT細胞からCD4+CD8+のキラー様T細胞が発生することを示すものです。最近の研究では、腸の中にいる細菌の種類により腸内のヘルパーT細胞のタイプが異なることが分かってきています。そこで腸を無菌状態にしたマウスを調べたところ、CD4+CD8+のキラー様T細胞は見つかりませんでした。このことから、CD4+CD8+のキラー様T細胞の分化には腸内細菌から発せられる情報が必要であることが分かりました。
今回の研究ではCD4+CD8+のキラー様T細胞の分化を強く誘導する単一の腸内細菌は同定できなかったことから、複数の腸内細菌が関与している可能性があります。腸内細菌をはじめ、どのような環境刺激により、CD4+CD8+のキラー様T細胞ヘの変化が誘導されるのか?またCD4+CD8+のキラー様T細胞が実際の免疫応答とその制御においてどのように機能するのか?という疑問は今後の研究により明らかにすべき課題です。
今後の期待
今回、ヘルパーT細胞は、キラー様T細胞へ機能変化するという予想外の秘められた潜在能力を持つことが明らかになりました。さらに、機能変化過程がThPOK転写因子の発現消失によるものだったことから、この過程では細胞の性質をコントロールする根本的なプログラムが書き換えられていることが分かりました。つまり、腸管のような環境下のヘルパーT細胞は、細胞機能プログラムを再び書き直す能力を有していることが分かりました。このような細胞機能プログラムの書き換えはリプログラミングと呼ばれ、人為的にiPS細胞を作製する際に見られる現象と類似のものと捉えることができます。
免疫系は、多様な環境の変化に対応する高い適応性が要求される高次生命機能です。これまでは多様な免疫細胞が血流にのって動き回ることで免疫応答や炎症の局面で入れ替わるという動的な側面が柔軟な対応力の主因と思われていました。しかし、今回、これまで注目されていなかったヘルパーT細胞の柔軟な分化可塑性が明らかになりました。この成果は、免疫系の環境適応能力の研究に新たな視点をもたらすと考えられます。
今後、ヘルパーT細胞の柔軟な機能変化の基盤となる機構を解明していくことで、人為的に免疫応答を制御する方法の開発や、ヘルパーT細胞とキラーT細胞の機能を併せ持つ新しいT細胞を作り出すことが可能になるかも知れません。このような人為的なT細胞分化誘導法の開発は、免疫疾患の新たな治療法の開発につながると期待できます。
原論文情報
- Daniel Mucida, Mohammad Mushtaq Husain, Sawako Muroi, Femke van Wijk,Ryo Shinnakasu,Yoshinori Naoe, Bernardo Sgarbi Reis, Yujun Huang, Florence Lambolez,Michael Docherty,Antoine Attinger, Jr-Wen Shui, Gisen Kim, Christopher J Lena, ShinyaSakaguchi, Chizuko Miyamoto,Peng Wang, Koji Atarashi, Yunji Park, Toshinori Nakayama, Kenya Honda,Wilfried Ellmeier,Mitchell Kronenberg, Ichiro Taniuchi & Hilde Cheroutre. "Transcriptional reprogramming of mature CD4+ helper T cells generates distinct MHC class II--restricted cytotoxic T lymphocytes." Nature Immunology,2013. doi: 10.1038/ni.2523
発表者
理化学研究所
免疫・アレルギー科学総合研究センター 免疫転写制御研究グループ
グループディレクター 谷内 一郎(たにうち いちろう)
お問い合わせ先
横浜研究推進部 企画課
Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.ヘルパーT細胞
免疫応答に関与するリンパ球「T細胞」の1つ。抗原の情報をB細胞へ伝えて抗体の産生を誘導したり、免疫応答を誘導する液性因子を放出することにより、免疫反応の司令塔として働くT細胞。 - 2.キラーT細胞
免疫細胞の一種で細胞傷害性T細胞とも呼ばれる。ウイルス感染細胞やがん細胞など宿主にとって異物となる細胞を認識して破壊する。 - 3.胸腺
T細胞がつくられる臓器で心臓の上に位置している。骨髄から移動してきた前駆細胞が、胸腺の中でT細胞へと分化、成熟する。 - 4.分化可塑性
細胞に保持されている分化能を表現する言葉。受精卵や胚性幹細胞のような多分化能を持つ細胞は多様な細胞に分化することができることから、可塑性が高い細胞といえる。より狭義には、ある特定の細胞に分化が方向づけられたような細胞に、それまで有していた他の細胞になる能力がどれほど維持されているか、ということを表現する時に使用される場合が多い。 - 5.転写因子
遺伝子の発現を調節するタンパク質。DNA上に存在する遺伝子の発現を制御する領域に結合し、DNAを鋳型としてRNAが産生(転写)される時期や量を調節する。 - 6.ThPOK転写因子
2005年に発見された胸腺内でのヘルパーT細胞へ分化するために必須の転写因子。DNA上に存在する遺伝子の発現を制御する領域に結合し、DNAを鋳型としてRNAが産生(転写)される時期や量を調節する。遺伝子発現制御は、いくつかの遺伝子の発現が連鎖的に起こるが、その中でも分化誘導の引き金となるスイッチをオンにする役割を果たす分子を「マスター転写因子」と呼ぶ。ヘルパーT細胞の分化においてはThPOK転写因子が「マスター転写因子」として働き、ヘルパーT細胞の機能発現の根幹的な遺伝情報の発現制御を行うと考えられている。 - 7.上皮細胞間リンパ球(Intra Epithelial Lymphocytes : IEL)
身体の中で外部環境と接する上皮細胞の間に入り込むように存在するリンパ球のこと。例えば、腸管上皮の間には複数の種類のT細胞が存在している。 - 8.免疫不全レシピエントマウス
免疫細胞の分化や機能をマウスの体内の中で調べる実験を行うときに、免疫細胞を移植、あるいは移入する方法が用いられる。この際、遺伝子異常のためリンパ球が発生せず、免疫不全状態になったマウスを受け手(レシピエント)として用いると、移入した細胞を簡単に同定できる。 - 9.トランスジェニックマウス
遺伝子操作により、目的の分子の発現を人為的に制御したマウスの総称。多くの場合、DNA断片を受精卵に注入することで作製される。今回の研究ではES細胞での相同組み替えを利用して作製したノックイントランスジェニックを使用。 - 10.サイレンサー
ゲノムDNAのなかで遺伝子情報を担わず、遺伝子の発現を調節する領域を制御領域という。制御領域の機能として、遺伝子の発現を正に制御する機能をもつものはエンハンサー、負に制御する機能をもつものはサイレンサーと呼ぶ。
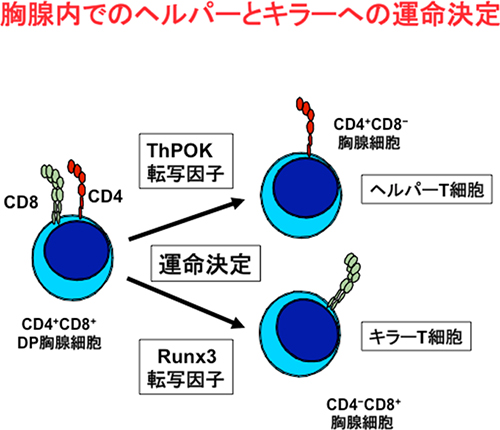
図1 胸腺内でのヘルパーとキラーヘの運命決定とThPOK転写因子とRunx3転写因子の発現の関係
ヘルパーT細胞、キラーT細胞への分化運命決定にはそれぞれThPOK転写因子、Runx3転写因子の発現が必須。
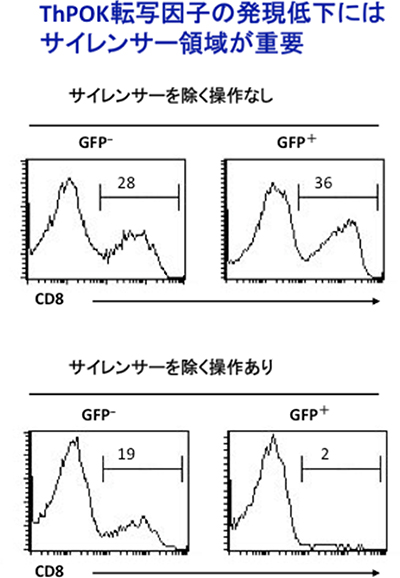
図2 腸管におけるサイレンサーによるCD4+CD8+細胞への分化の影響
ThPOK遺伝子内のサイレンサーを除く操作をしたヘルパーT細胞(下段GFP+細胞)では、CD8を発現するCD4+CD8+のキラー様T細胞の出現が激減していることから、ヘルパーT細胞からキラーT細胞へ変化にThPOK転写因子の発現低下が必須と分かる。
GFP-細胞は、サイレンサーを除かれていない細胞を示す。
図中の数値は、CD4+細胞群でのCD8を発現するCD4+CD8+キラー様T細胞の割合(%)を示す。
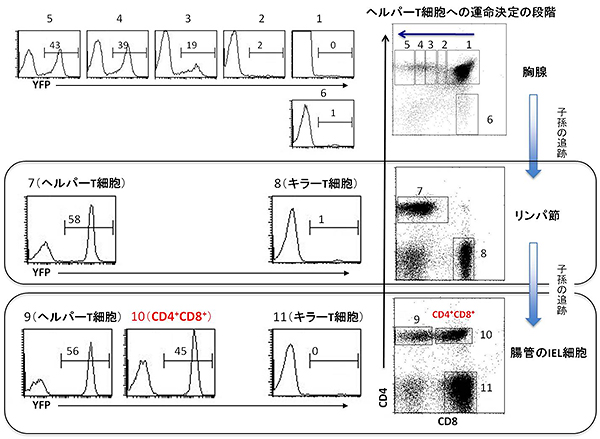
図3 Fate mapping法によるヘルパーT細胞のその後の追跡
Fate mapping法により、細胞分裂後でも消えないYFPという印をヘルパーT細胞に刻印し、このYFPの発現を追うことで、ヘルパーT細胞の子孫の追跡を行った。
図のグラフ中の数値は、それぞれの細胞群でのYFPを発現している細胞の割合(%)。
- 上段(胸線):DP胸腺細胞からヘルパーT細胞への分化に従い、YFPの発現が増加する(図中1から5に向かう方向)。キラーT細胞になった細胞ではYFPの発現はほとんど見られない(図中6)。
- 中段(リンパ節):YFPの発現により、胸線でヘルパーT細胞だった細胞は、リンパ節でもヘルパーT細胞のままであることが分かる(図中7)。キラーT細胞になった細胞にはYFPの発現は見られない(図中8)。
- 下段(腸管):キラー様T細胞であるCD4+CD8+細胞群(図中10)は、ヘルパーT細胞(図中9)と同様にYFPを発現しているため、ヘルパーT細胞の子孫と分かる。キラーT細胞にはYFPの発現は見られない(図中11)。
