ポイント
- 乳児難治てんかんの原因遺伝子産物「Nav1.1」の脳内分布を詳細に解析
- てんかん発症の主要な引き金となる抑制性神経細胞の種類を特定
- 興奮性神経細胞のNav1.1を半減させると突然死が抑制されることを発見
要旨
理化学研究所(理研、野依良治理事長)は、精神発達障害を伴う乳児難治てんかんのモデルマウスにおいて発症の主要な引き金となる抑制性神経細胞の一種を特定し、さらに興奮性神経細胞での原因遺伝子産物であるナトリウムチャネル「Nav1.1」タンパク質の半減がてんかんに伴う突然死を抑制する効果があることを発見しました。これは、理研脳科学総合研究センター(利根川進センター長)神経遺伝研究チームの山川和弘チームリーダーと荻原郁夫研究員、行動遺伝学技術開発チーム、および国立遺伝学研究所、群馬大学、熊本大学、米国ハーバード大学などによる共同研究グループの成果です。
乳児重症ミオクロニーてんかん[1]は、生後1年以内に熱誘起性のけいれん発作で発症し、自閉症や知的障害の合併に加えてしばしば突然死を引き起こします。約8割の患者から電位依存性ナトリウムチャネル遺伝子[2]の1つであるSCN1Aの変異が見いだされています。共同研究グループはこれまでに、SCN1A遺伝子が作るタンパク質「Nav1.1」が、神経細胞の興奮を抑える抑制性神経細胞の一種であるパルブアルブミン(PV)陽性抑制性神経細胞[3]で多く発現していることや、SCN1A遺伝子を変異させたマウスはてんかんを発症すること、自閉症に似た社会性行動の異常と記憶学習障害を示すことなどを報告しています 。
今回、共同研究グループは、マウスにおいて特定の神経細胞種のみでSCN1A遺伝子を欠損させてNav1.1の脳内分布を詳細に調べるとともに、てんかん発作、運動失調、突然死などの症状についてそれらのマウスで比較しました。その結果、全ての細胞でSCN1A遺伝子を欠損させた場合よりも抑制性神経細胞だけで欠損させた場合のほうがより早期で頻回な突然死を引き起こすこと、加えて興奮性神経細胞でSCN1A遺伝子を欠損させると致死性が大きく改善することが分かりました。さらにPV陽性抑制性神経細胞では、わずかなNav1.1の欠損が自発性てんかんを引き起こすに十分であることを初めて発見しました。これらの成果は、乳児難治てんかんの発症機構の解明、有効で副作用の少ない治療法の開発につながるものです。
本研究は、文部科学省「脳科学研究戦略推進プログラム」の事業として実施され、その成果は科学雑誌『Human Molecular Genetics』12月号に掲載されるに先立ちオンライン版(英国時間8月6日16:00:日本時間8月7日00:00)に掲載されます。
背景
てんかんは、脳神経回路の過剰興奮によって引き起こされる発作を特徴とし、全人口の1%以上が発症する頻度の高い神経疾患です。てんかんには多くの種類があり、その過半数が遺伝的要因によると考えられています。実際に、これまで多数のてんかん原因遺伝子が同定され、そのうちの20個余りの遺伝子が神経細胞の興奮を制御するイオンチャネル[2]タンパク質をコードしています。
電位依存性ナトリウムチャネルのαサブユニット1型タンパク質「Nav1.1」を作るSCN1A遺伝子は、てんかん原因遺伝子の1つとして知られています。重篤で難治なてんかんを生後1年未満で発症し、さらに自閉症に似た症状や知的障害などの精神発達障害や運動失調などを伴う乳児重症ミオクロニーてんかんでは、患者の約8割にSCN1A遺伝子の機能喪失変異が見つかっています。また、SCN1A遺伝子変異は熱性けいれんプラスなど他のてんかんや、知的障害、自閉症のケースにも広く見いだされてきています。
共同研究グループは以前に、野生型(正常)マウスにおいてNav1.1が抑制性神経細胞の一種であるパルブアルブミン(PV)陽性抑制性神経細胞で強く発現すること、患者で見いだされたSCN1A遺伝子のナンセンス変異[4]を導入したマウスがてんかん発作を示すこと、さらに当該マウスではNav1.1の量が半分になっており抑制性神経細胞の機能不全が見られることを明らかにし、最近では当該マウスが自閉症に似た社会性行動の異常と記憶学習障害を示すことを報告しています注)。
今回、共同研究グループは、マウスを用いて興奮性神経細胞や抑制性神経細胞、さらにその一部のPV陽性抑制性神経細胞などにおいてSCN1A遺伝子を欠損させることにより、Nav1.1の脳内分布を詳細に明らかにするとともに、それぞれの神経細胞種においてNav1.1がてんかん発作、運動失調、突然死などの発症に果たす役割を詳細に調べました。
注)2007年5月30日プレスリリース
2012年9月27日プレスリリース
研究手法と成果
共同研究グループは、コンディショナルノックアウト[5]という手法で、SCN1A遺伝子をマウスの特定の神経細胞種で欠損させ、免疫組織学的手法[6]により詳細にNav1.1の脳内分布を調べるとともに、てんかん発作、運動失調、突然死などの症状についてそれらのマウスで詳細に観察しました。
乳児重症ミオクロニーてんかんの状態を模して作成した全ての神経細胞においてNav1.1を半減させたマウスは、生後2週間頃からてんかん性けいれん発作を頻発し、約2割のマウスが生後1カ月までに発作に伴う突然死を起こしました。また、抑制性神経細胞だけに発現するVgat[7]遺伝子を利用して抑制性神経細胞だけでNav1.1を半減させたマウスは、重篤なてんかん発作を示すとともに全ての神経細胞においてNav1.1を半減させたマウスより高い致死性を示し、生後1カ月までに全てのマウスが突然死しました。(図1)。このことは、Nav1.1が半減されなかった何らかの神経細胞が、症状をさらに悪化させる働きを持つことを示します。
主に興奮性神経細胞に発現するEmx1[8]遺伝子を利用して興奮性神経細胞だけでNav1.1を半減もしくは欠損させたマウスでは、てんかん発作や発作に伴う突然死は見られませんでした(図2)。しかし、抑制性神経細胞だけでNav1.1を半減させたマウスで、興奮性神経細胞のNav1.1も半減させると、重篤であったマウスの致死性が大きく改善し、生後1カ月を過ぎても約半数が生き残りました(図3)。この結果は、抑制性神経細胞だけでNav1.1を半減させたマウスにおいて、症状を更に悪化させていた細胞は、Nav1.1を持つ興奮性神経細胞であったことを示しています。
次に、PV遺伝子を利用してPV陽性抑制性神経細胞だけでNav1.1を半減させたマウスを作製したところ、乳児重症ミオクロニーてんかんに似た自発性てんかん発作が見られました。さらにNav1.1を完全に欠損させたマウスでは、生後1カ月までに発作に伴う突然死と歩行不良による栄養失調で全てのマウスが死滅しました(図4)。また、PV陽性抑制性神経細胞だけでNav1.1発現量がごくわずかに低下するだけでも、自発性てんかん発作を発症するに十分なことが分かりました(図5)。この結果は、PV陽性抑制性神経細胞におけるNav1.1の減少と、それによる機能低下が乳児重症ミオクロニーてんかんの発症の根幹に関与していることを示すものです。
共同研究グループは、特定の神経細胞でNav1.1を欠損させたマウスと野生型(正常)マウスの脳組織を注意深く比較し、Nav1.1の脳内分布を観察しました。その結果、野生型マウスにおいてNav1.1はPV陽性抑制性神経細胞の軸索に高濃度に発現することに加え(図6)、一部の興奮性神経細胞(内側嗅内皮質-海馬投射細胞、一部の大脳皮質錐体細胞、視床-大脳皮質投射細胞)に低-中濃度で発現していること、海馬の興奮性神経細胞(CA1/CA3錐体細胞、歯状回顆粒細胞)には発現が見られないことなどを明らかにしました(図7)。
Nav1.1の脳内分布については、世界の複数のグループが相互に異なる報告をして混乱した状況が続いていましたが、本研究はそのような状況に対して一定の決着をつけるものとなりました。Nav1.1のような疾患の原因となる遺伝子産物の組織内分布を正確に理解することは、疾患を理解する上でも不可欠であり、これらの知見はその意味でも非常に重要な意義を持ちます。
今後の期待
今回、Nav1.1が、PV陽性抑制性神経細胞に高濃度に発現することの確認に加え、一部の特定の興奮性神経細胞にも発現すること、さらにモデルマウスにおける興奮性神経細胞と抑制性神経細胞でのNav1.1発現の半減が発症に対してそれぞれ相反する効果を有することを初めて示しました。これらは、有効で副作用の少ない治療法を開発するためには抑制性神経細胞、とりわけPV陽性抑制性神経細胞に治療のターゲットを絞るべきであることを示しています。
今後、研究グループはこれらのモデルを用いて知的障害や自閉症の発症メカニズムの解明にも取り組み、有効な治療法の開発を目指します。
原論文情報
- Ikuo Ogiwara, Takuji Iwasato, Hiroyuki Miyamoto, Ryohei Iwata, Tetsushi Yamagata, Emi Mazaki, Yuchio Yanagawa, Nobuaki Tamamaki, Takao K. Hensch, Shigeyoshi Itohara, and Kazuhiro Yamakawa. Nav1.1 haploinsufficiency in excitatory neurons ameliorates seizure-associated sudden death in a mouse model of Dravet syndrome. Human Molecular Genetics, volume 22, doi:10.1093/hmg/ddt331
発表者
理化学研究所
脳科学総合研究センター 神経遺伝研究チーム
チームリーダー 山川 和弘 (やまかわ かずひろ)
お問い合わせ先
脳科学研究推進室
Tel: 048-467-9757 / Fax: 048-467-4914
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
脳科学研究戦略推進プログラムについてのお問い合わせ
文部科学省
脳科学研究戦略推進プログラム 事務局
Tel: 03-5282-5145
srpbs [at] nips.ac.jp(※[at]は@に置き換えてください。)
補足説明
- 1.乳児重症ミオクロニーてんかん
突然に意識が喪失し全身が硬直する強直間代発作と突発的な筋の収縮を起こすミオクロニー発作、精神発達障害を特徴とする重篤なてんかん。ドラベ症候群とも呼ばれる。3万~4万人に1人が発症する。出生後、一見正常に発達するが、2~10カ月ころに熱誘起性のけいれん発作で発症する。発作は時に群発、重積状態となる。1~4歳頃にはミオクロニー発作が出現し、時に非定型欠神発作、複雑部分発作などを示す。初期には正常な精神運動発達を示すが徐々に遅れ、中等度から重度の精神遅滞および自閉症に似た行動を示すようになる。ほとんどが散発性。現行の抗てんかん薬でわずかに発作を軽減できる程度で、精神遅滞および自閉症をも対象とした真に有効な治療法はない。 - 2.電位依存性ナトリウムチャネル遺伝子、イオンチャネル
イオンチャネルは細胞膜上にイオンが通る穴を形成し、ナトリウムやカリウムなどのイオンを選択的に行き来させることで細胞の興奮や抑制を制御する重要な働きをする。神経細胞膜上には、ナトリウムチャネル、カリウムチャネル、カルシウムチャネルなどさまざまなイオンチャネルが存在し、神経細胞の興奮、抑制などをつかさどっている。特に電位依存性ナトリウムチャネルは、神経細胞の興奮に主要な働きをする。ナトリウムチャネルはポア(イオンが通る穴)を形成する主要サブユニットであるαサブユニットと、その開閉などを制御するβサブユニットから構成され、αサブユニットは1~9型(Nav1.1~Nav1.9)までが同定されている。αサブユニットは、組織、器官によって発現部位が異なり、例えばNav1.1、Nav1.2、Nav1.3、Nav1.6型の4種は脳に、Nav1.4は骨格筋に、Nav1.5は心臓に発現している。βサブユニットはβ1~β4までの4種が知られている。 SCN1AはNav1.1を作る遺伝子として知られている。 - 3.パルブアルブミン(PV)陽性抑制性神経細胞
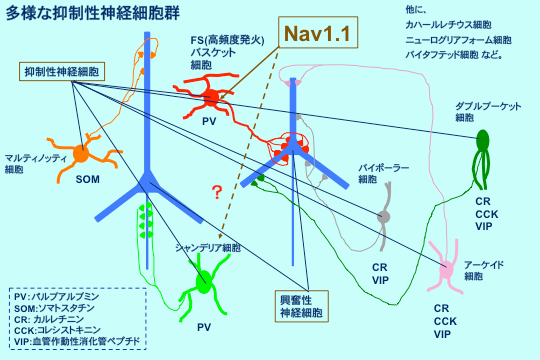
神経細胞は、興奮性神経細胞と抑制性神経細胞に大きく2つに分けられ、双方が制御し合うことによって脳全体で適切な情報伝達が行われている。神経細胞のうちおよそ8割が興奮性、2割が抑制性の細胞であり、抑制性神経細胞はさらに多様な種類の細胞で構成されている。パルブアルブミン陽性抑制性神経細胞は、パルブアルブミン(PV)というカルシウム結合タンパクを発現する、抑制性神経細胞の約4割を占める細胞で、多くがバスケット細胞、一部シャンデリア細胞などで構成される。PV陽性バスケット細胞は高頻度に発火する細胞で、軸索を興奮性神経細胞の細胞体に投射し、その興奮を強力に抑制している。2007年に理研神経遺伝研究チームは、ナトリウムチャネルαサブユニットNav1.1がPV陽性高頻度発火バスケット細胞の軸索と細胞体で特に多く発現していることを免疫組織染色により見いだした(Ogiwara et al., J Neurosci 27: 5903-5914, 2007)。シャンデリア細胞などでのNav1.1発現の有無は確認できていない。
- 4.ナンセンス変異
遺伝子の塩基配列中のアミノ酸に対応するコドンをストップコドン(対応するアミノ酸が無いコドン)に変化させる突然変異。タンパク質の合成はそこで停止するため、不完全なタンパク質が合成される。もしくは、mRNAが不安定となって分解される結果、タンパク質は合成されない。 - 5.コンディショナルノックアウト
特定の遺伝子の発現配列の下流にCreリコンビナーゼなどのDNA組み替え酵素の遺伝子をつないだ遺伝子配列を人工的に導入したマウスと、当該組み替え酵素が認識して切断する配列(loxPなど)で挟まれた目標遺伝子を持つマウスを掛け合わせることで、特定の種類の細胞だけで目標の遺伝子を除去することができる。この手法により作成したマウスをコンディショナルノックアウトマウスと呼ぶ。 - 6.免疫組織学的手法
マウスの脳などの組織切片に対して、特定のタンパク質に対する抗体を反応させ、さらにそれらの抗体に対して色素などを結合させて可視化し、当該タンパク質の組織内分布を調べる方法。 - 7.Vgat
Vesicular GABA Transporter(小胞性GABAトランスポーター)の略。抑制性神経細胞の主要な神経伝達物質であるγ-アミノ酪酸(GABA)とグリシンを神経終末のシナプス小胞に移送する機能を持つタンパク質で、全ての抑制性神経細胞に特異的に発現する。この Vgat遺伝子の発現配列の制御下でCreリコンビナーゼを発現するマウスは、本研究の共同研究者である行動遺伝学技術開発チームの糸原重美チームリーダーと岩里 琢治研究員(現:国立遺伝学研究所教授)によって作成された。 - 8.Emx1
大脳皮質、海馬、嗅球の興奮性神経細胞とグリアで発現し、発生分化を制御する転写因子Empty spiracles homeobox 1の略/遺伝子名である。このEmx1遺伝子の発現配列の制御下でCreリコンビナーゼを発現するマウスは、糸原重美チームリーダー、岩里 琢治研究員(現:国立遺伝学研究所教授)に開発された。
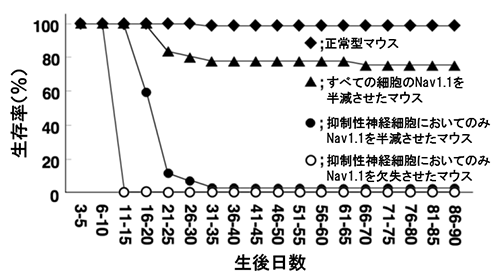
図1 抑制性神経細胞でNav1.1を半減・欠失させたマウスの生存率
抑制性神経細胞のみにおいてNav1.1を半減させたマウスは、てんかん発作を起こし、その後1か月以内に突然死する。生存率は、全ての細胞においてNav1.1を半減させたマウスよりも著しく低い。
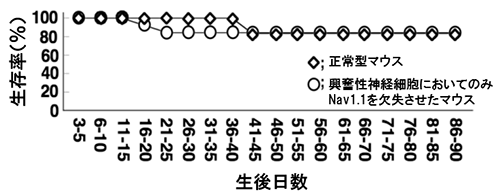
図2 興奮性神経細胞でNav1.1を欠失させたマウスの生存率
興奮性神経細胞のみにおいてNav1.1を除いたマウスは、てんかんも突然死もなく、一見正常に発達する。
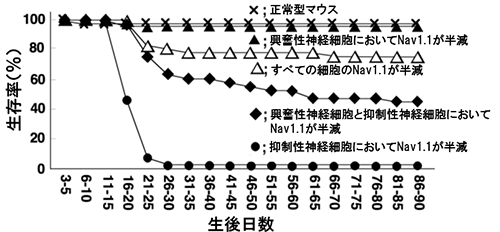
図3 抑制性神経細胞、興奮性神経細胞を半減させたマウスの生存率
抑制性神経細胞のみにおいてNav1.1を半減させたマウスの生存率は、興奮性神経細胞におけるNav1.1も半減させることによって、改善/上昇する。
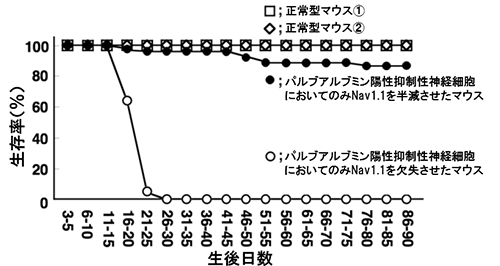
図4 PV陽性抑制性細胞でNav1.1を半減・欠失させたマウスの生存率
パルブアルブミン陽性細胞においてのみNav1.1を半減させたマウスは、てんかんを起こし、突然死も散見される。また、パルブアルブミン陽性細胞においてのみNav1.1を完全に除いたマウスは、発作と歩行不良により、生後1カ月以内に死滅する。
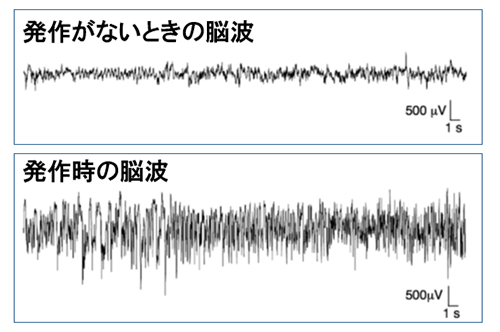
図5 PV陽性抑制性神経細胞でNav1.1を減らしたときのマウスの脳波
PV陽性抑制性神経細胞のみでごくわずかにNav1.1発現量を減らすだけで、マウスはてんかんを起こす。
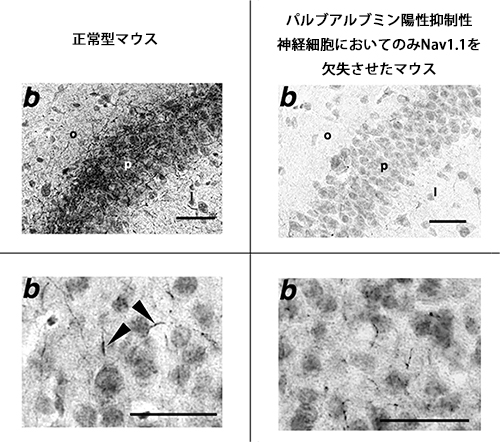
図6 Nav1.1は、正常型マウス脳において、PV陽性抑制性神経細胞軸索に強く発現する
(上段)正常型マウスの海馬で認められる抑制性神経細胞軸索でのNav1.1発現は(左上)、PV陽性抑制性神経細胞においてのみNav1.1を欠失させたマウスで消失している(右上)。(下段)正常型マウスの大脳皮質第II/III層で認められるPV陽性抑制性神経細胞軸索起始部でのNav1.1発現は(左下、矢印)、PV陽性抑制性神経細胞においてのみNav1.1を欠失させたマウスで消失している(右下)。Nav1.1がPV陽性抑制性神経細胞軸索に強く発現していることが分かる。
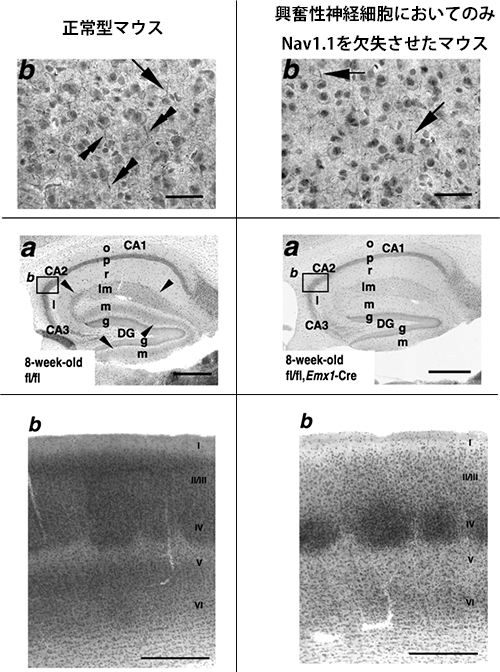
図7 Nav1.1は、正常型マウス脳において、興奮性神経細胞の一部(内側嗅内皮質-海馬 投射細胞、一部の大脳皮質錐体細胞、視床-大脳皮質投射細胞)に発現している
(上段)正常型マウスの大脳皮質第V, VI層では(左上)、Nav1.1発現がパルブアルブミン陽性抑制性神経細胞の軸索起始部(矢印)と一部の錐体神経細胞の軸索起始部に認められる(二重矢頭)。一方、興奮性神経細胞においてのみNav1.1を欠失させたマウスでは(右上)、Nav1.1発現がパルブアルブミン陽性抑制性神経細胞の軸索起始部では残存しているが(矢印)、錐体神経細胞の軸索起始部では消失している。(中段)正常型マウスの海馬では(左中)、Nav1.1発現が抑制性神経細胞軸索と内側嗅内皮質から海馬に投射される貫通線維(矢頭)に認められる。一方、興奮性神経細胞においてのみNav1.1を欠失させたマウスでは(右中)、Nav1.1発現が抑制性神経細胞軸索では残存しているが、貫通線維では消失している。(下段)正常型マウスの体性感覚野バレル皮質では(左下)、Nav1.1発現が第II/III IV, V, VI層に認められる。一方、興奮性神経細胞においてのみNav1.1を欠失させたマウスでは(右下)、Nav1.1発現が第II/IIIとV層では消失し、視床から大脳皮質に投射されて第IVとVI層に広がる線維では残存している。Nav1.1が興奮性神経細胞の一部(一部の大脳皮質錐体細胞、内側嗅内皮質-海馬投射細胞、視床-大脳皮質投射細胞)で発現しているが、海馬の興奮性神経細胞では発現していないことが分かる。
