2014年9月9日
理化学研究所
カルシウムチャネルの新しいアロステリック阻害メカニズム
-トランスグルタミナーゼがIP3受容体チャネルの働きを止めることを発見-
ポイント
- トランスグルタミナーゼがIP3受容体のアロステリック変化を阻害
- アロステリック変化の阻害はオートファジー(自食作用)にも関与
- 脳の難病「ハンチントン病」にこのメカニズムが関与する可能性を示唆
要旨
理化学研究所(理研、野依良治理事長)は、脳の働きに必要なカルシウムチャネル[1]「IP3受容体」[2]を制御する新しいアロステリック機構[3]を発見し、その阻害メカニズムを解明しました。これは、理研脳科学総合研究センター(利根川進センター長)発生神経生物研究チームの御子柴克彦チームリーダー、濱田耕造研究員らの研究チームの成果です。
IP3受容体は小胞体の膜上に局在するタンパク質で、神経伝達や記憶・学習を担っています。IP3受容体は4つ組み合わさって中心部にカルシウムイオンを1つだけ通す小さなイオン透過口を形成し、カルシウムチャネルとして働きます。脳の神経細胞やグリア細胞に信号が伝わると細胞膜からIP3(イノシトール三リン酸)[2]が切り出され、細胞内に遊離してIP3受容体に結合します。IP3が結合するとカルシウムチャネルにアロステリック変化が生じ、小胞体からカルシウムイオンが細胞内に放出され、記憶・学習や細胞機能に必要なさまざまな生化学反応が起こります。しかし、このアロステリック変化の制御メカニズムの多くは未解明のままでした。
研究チームは、IP3受容体に作用してアロステリック変化を阻害する酵素を探索しました。その結果、タンパク質のグルタミン残基とリジン残基の架橋反応[4]を触媒する「トランスグルタミナーゼ[5]」を同定しました。この酵素は炎症やストレスで誘導され、血液の凝固や皮膚の角質化などの生理機能を担います。このなかで神経細胞やグリア細胞に存在する2型トランスグルタミナーゼが、1型IP3受容体の2,746番目のグルタミン残基と隣接したサブユニット[6]を架橋しアロステリック変化を阻害することが分かりました。さらに、この制御がオートファジー(自食作用)[7]に関与することも明らかにしました。
トランスグルタミナーゼはアルツハイマー病やハンチントン病など神経変性疾患の脳で活性化されることが知られています。研究チームはハンチントン病患者のリンパ球やモデルマウスなどを用いた実験で、このアロステリック阻害メカニズムがハンチントン病に関与する可能性を見いだしました。認知症の原因となる神経変性疾患ではカルシウムシグナルやオートファジーの制御異常の報告があり、今回の成果は、認知症の発症メカニズムの理解に役立つと期待できます。
本研究は、科学技術振興機構(JST)「カルシウム振動プロジェクト」(平成13年1月1日から平成23日3月31日)の一環として行われ、成果は、米国科学アカデミー紀要『Proceedings of the National Academy of Sciences of the United States of America』オンライン版に9月8日の週に掲載されます。
背景
私たちが箸(はし)でごはんをつかむとき、指を添える「力点」と実際にごはんをつかむ「作用点」は離れています。脳の中のタンパク質にもこれと似た原理が使われています。
小胞体の膜上に局在し、記憶や学習に重要な役割を果たすタンパク質であるIP3受容体は、力点にIP3分子が付くと遠く離れた作用点にイオンを通す穴を開け、カルシウムチャネルとして働きます(図1A)。これを「アロステリック(allosteric)変化」と呼びます。「allo」は「異なる」を、「steric」は「立体的」を意味し、この原理はタンパク質の遠隔操作で活躍します。
箸の場合、1本ではだめで2本ないと困りますが、IP3受容体も1つでは機能せず、4つ集まってはじめて1つのカルシウムチャネルとして働きます。IP3受容体チャネルは4つのサブユニットが会合し、中心にカルシウムイオンを1つだけ通す小さなイオン透過口を形成します(図1B)。
アロステリック変化は、サブユニットの配置変化やサブユニット内の構造変化で起きます。この変化は素早く、かつ繰り返されます。脳内では、神経細胞やグリア細胞(神経系を構築する細胞のうち、神経細胞ではない細胞の総称)に信号が伝わると細胞膜からIP3(イノシトール三リン酸)が切り出され、細胞内に遊離してIP3受容体に結合します。IP3が結合するとカルシウムチャネルにアロステリック変化が生じ、小胞体からカルシウムイオンを細胞内に放出し、記憶・学習や細胞機能に必要なさまざまな生化学反応を起こします。IP3受容体のアロステリック変化に不具合が生じると、細胞や脳の機能に問題が起こると考えられますが、具体例は見つかっていませんでした。
IP3受容体のアミノ末端付近にはIP3結合部位、カルボキシル末端付近にはチャネル部位が位置し、その他の巨大な領域は調節部位と呼ばれます。この調節部位にはカルシウムイオン、ATP(アデノシン三リン酸)、リン酸基のような分子や、ユビキチン、アルツハイマー病やハンチントン病の原因となるプレセニリンやハンチンチン、また神経細胞の維持や細胞死に関わるチトクロームcやベクリン、Bcl2ファミリータンパク質などが結合します。しかし、どのようにIP3受容体のアロステリック変化が制御されているかについては、未解明のままでした。
研究手法と成果
IP3受容体のアロステリック変化の制御メカニズムを調べるには、4つのサブユニットが会合した状態を容易かつ正確に検出できる方法が必要です。しかし、脳の1型IP3受容体の1つのサブユニットは2,749個のアミノ酸からなり、分子量は313kDaもあります。サブユニットが4つ会合すると1,253kDaという巨大な受容体チャネルを形成するため、一般的なポリアクリルアミドゲル電気泳動[8]では分析できません。そのため、研究チームは1%のアガロースゲルと水平型泳動装置を用い、サブユニットの会合状態を分析できる新しいアガロース電気泳動を確立しました。
アガロース電気泳動を用いてIP3受容体のサブユニットの会合状態を調節する因子を探したところ、カルシウムイオンで活性化されIP3受容体に働く酵素を見いだし、それが「トランスグルタミナーゼ」であることが示唆されました。そこで、神経細胞やグリア細胞に存在する2型トランスグルタミナーゼをsiRNA(低分子2本鎖RNA)[9]で除去したHeLa細胞などを用いて、トランスグルタミナーゼがIP3受容体の制御に関与するかどうかを実験的に確かめました。その結果、HeLa細胞でIP3受容体のチャネル機能が活性化しており、2型トランスグルタミナーゼがIP3受容体を制御している証拠が得られました。また、この制御はオートファジー(自食作用)の調節にも関与していました。
トランスグルタミナーゼは、タンパク質のグルタミン残基とリジン残基の架橋反応を触媒する酵素です。そこで、トランスグルタミナーゼがIP3受容体を架橋する部位を、IP3受容体の限定分解とマススペクトロメトリー、さらに点変異体の作成により詳細に調べました。その結果、IP3受容体のカルボキシル末端に位置するグルタミン残基とプロリン残基からなる特別なアミノ酸配列の中にある2,746番目のグルタミン残基が特異的に修飾されることが明らかとなりました。限定分解の結果から、このグルタミン残基が隣のサブユニットのリジン残基に架橋することが確認され、これがIP3結合部位とチャネル部位の両者から遠く離れたアロステリック部位であることが分かりました。カルシウムイオン、ATP、リン酸基、ユビキチン、ハンチンチン、チトクロームc、Bcl2は架橋部の近くに結合するため、サブユニットの配置変化を伴うアロステリック変化に関与すると考えられました。
次に、トランスグルタミナーゼがどのようにIP3受容体の機能を調節するか調べました(図2A)。純度の高い精製トランスグルタミナーゼを37℃で30分間、IP3受容体に作用させたところ、わずか34ナノモラー(nM)でIP3受容体のイオン透過口が閉じた状態でロックされ、カルシウムチャネル活性を著しく阻害することが分かりました(図2B)。この阻害状態では2,746番目のグルタミン残基が隣のサブユニットのリジン残基に架橋されています。一方、この酵素反応中にビオチンペンチルアミンという化合物を加えるとサブユニットは架橋されず(図2C)カルシウムチャネル活性も阻害されませんでした(図2D)。その要因をマススペクトロメトリーで調べたところ、IP3受容体の2,746番目のグルタミン残基にビオチンペンチルアミンが付加されているためでした。
この後、アビジンを混ぜるとアビジン-ビオチン複合体が形成され、再びIP3受容体のカルシウムチャネル活性が阻害されました(図2E)。これは2,746番目のグルタミン残基が隣接サブユニットに架橋された場合(図3左下)と同様に、この付近にアビジン-ビオチン複合体のような大型分子が結合した場合もサブユニット間の配置変化が阻まれてカルシウムチャネル活性が阻害されることを意味します(図3中下)。
IP3受容体から放出されるカルシウムイオンはトランスグルタミナーゼを活性化します。これは負のフィードバックを形成し、細胞内のカルシウムイオン濃度の恒常性維持システムを助けます。しかし、サブユニット間が架橋したり(図3左下)、他の大型分子と架橋したり(図3中下)すると、カルシウムシグナル伝達とそれにより制御されている細胞機能を慢性的に止めてしまいます。トランスグルタミナーゼには、架橋反応を触媒するだけでなく、グルタミン残基の側鎖にある窒素原子を除去してグルタミン酸に変換する反応(脱アミド反応)を触媒する働きもあるため、2,746番目のグルタミン酸を特異的に検出する抗体(E2746抗体)を独自に作成し、これを検証しました(図3右下)。興味深いことに脱アミド化されたIP3受容体は、トランスグルタミナーゼに対し耐性を持ちカルシウム放出活性が上昇しました。これはカルシウムイオン濃度の上昇による細胞死の原因となる可能性があります。
以上の結果から、アロステリック変化を制御するメカニズムには、①サブユニット間の架橋、②他の巨大分子との架橋、③脱アミド化があることが新たに分かりました(図3)。
神経変性疾患のアルツハイマー病やハンチントン病、そしてパーキンソン病の脳細胞でトランスグルタミナーゼが活性化することが知られています。そこで研究チームは、今回見いだしたアロステリック変化の阻害メカニズムがこれらに関与するかについて調べました。ハンチントン病のモデルマウスの一種であるR6/2マウスにおいて、脳のIP3受容体をE2746抗体と精密質量分析機で分析したところ、2,746グルタミン残基の脱アミド化が進んでいました。また、ハンチントン病患者のリンパ球でトランスグルタミナーゼが活性化することから、患者のリンパ球でIP3受容体の機能を調べました。その結果、トランスグルタミナーゼの特異的阻害剤をリンパ球に与えるとIP3受容体のカルシウムチャネル活性が増大することが明らかになりました。これらの結果は、トランスグルタミナーゼによるIP3受容体のアロステリック阻害メカニズムがハンチントン病に関与する可能性を示唆しています。
今後の期待
研究チームは、トランスグルタミナーゼがIP3受容体チャネルの働きを阻害する新しいアロステリック阻害メカニズムを解明しました。酵素やチャネルなどの機能タンパク質は、アロステリック変化を利用し動作するものが多く、この成果はタンパク質の制御メカニズムに新しい枠組みを提供すると期待できます。
認知症の原因となる神経変性疾患では、細胞死が起きる前の初期の段階で、脳機能の低下とカルシウムシグナルやオートファジーの制御異常が共通して見られます。トランスグルタミナーゼによるアロステリック阻害メカニズムはこの初期段階に関与する可能性があり、認知症の発症メカニズムの理解にも役立つと期待できます。
原論文情報
- Kozo Hamada, Akiko Terauchi, Kyoko Nakamura, Takayasu Higo, Nobuyuki Nukina, Nagisa Matsumoto, Chihiro Hisatsune, Takeshi Nakamura, Katsuhiko Mikoshiba. "Aberrant calcium signaling by transglutaminase-mediated posttranslational modification of inositol 1,4,5-trisphosphate receptors"
Proceedings of the National Academy of Sciences of the United States of America, 2014, doi: 10.1073/pnas.1409730111
発表者
理化学研究所
脳科学総合研究センター 発生神経生物研究チーム
チームリーダー 御子柴 克彦(みこしば かつひこ)
研究員 濱田 耕造(はまだ こうぞう)
お問い合わせ先
独立行政法人理化学研究所 脳科学研究推進室
Tel: 048-467-9757 / Fax: 048-462-4914
pr [at] brain.riken.jp([at]は@に置き換えてください。)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.カルシウムチャネル
細胞の膜を貫通する構造でカルシウムイオンを透過する穴(チャネル)を形成するタンパク質。細胞膜の電位やリガンドに依存してチャネルが開くものがある。細胞内の信号として働くカルシウムイオンの濃度を動的に変化させる。 - 2.IP3受容体、IP3(イノシトール三リン酸)
小胞体に局在するカルシウムチャネルで、脊椎動物には3種のアイソフォーム(構造は違うが同じ機能をもつタンパク質)、1型、2型、3型が存在する。IP3はイノシトール1、4、5三リン酸の略で、IP3はIP3受容体に結合してカルシウムイオンを小胞体から放出する。 - 3.アロステリック機構
タンパク質の動作原理の1つで、離れた部位の構造変化を制御するメカニズム。酵素では基質結合部位から離れた部位に別の分子が結合し活性を調節するアロステリック効果がよく知られている。ヘモグロビンの酸素結合の協同性などを説明する原理として今から50年前にフランスの生化学者が提唱した。 - 4.架橋反応
タンパク質などのポリマーの間が共有結合する反応のこと。システイン残基間のジスルフィド結合の形成はタンパク質の架橋反応の代表例で、これは主に非酵素的な酸化によって生じる。 - 5.トランスグルタミナーゼ
タンパク質のグルタミン残基のγカルボキサミド基とリジン残基のεアミノ基を共有結合で架橋する酵素で、ヒトでは9種のアイソザイム(タンパク質としては異なるが、同一反応を触媒する酵素)が存在する。そのうち2型トランスグルタミナーゼは炎症性サイトカインで誘導され、自己免疫性のセリアック病の原因にもなる。 - 6.サブユニット
タンパク質が集まってできた複合体の中の構成単位のこと。通常はポリペプチド鎖で連なった1つのタンパク質分子に相当する。 - 7.オートファジー(自食作用)
タンパク質やミトコンドリアなどの細胞内小器官を、タンパク質分解酵素が充填されたリソソームに運ぶメカニズム。オートファジーの機能が低下すると細胞内に不要な物質が蓄積し、神経変性や慢性炎症などさまざまな疾病の原因になると考えられている。 - 8.電気泳動
タンパク質や核酸(DNAやRNA)など電荷をもつ物質に電圧をかけると移動することを利用した分析方法。タンパク質の場合はアクリルアミド分子を重合させたポリアクリルアミドゲル中を電気泳動させて分子量などの物性を分析する。 - 9.siRNA(低分子2本鎖RNA)
細胞に導入するとRNA干渉を起こし配列特異的に細胞内の遺伝子発現を抑制する。特定のタンパク質のみ迅速かつ特異的に除去することが可能である。
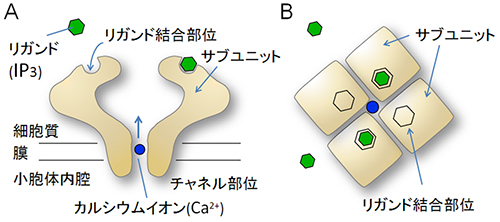
図1 IP3受容体の模式図
- A.IP3受容体を側面から眺めた模式図。緑色で描いたIP3分子は、IP3受容体の上部表面に位置するリガンド結合部位に特異的に結合する。小胞体の膜を貫通するIP受容体は、IP3が結合すると小胞体内腔からカルシウムイオン(Ca2+)を細胞質に放出する。
- B.IP3受容体を上面から眺めた模式図。IP3受容体は4つのサブユニットが会合して中心部にカルシウムイオンを1つだけ通す小さなイオン透過口を形成し、カルシウムチャネルとして働く。IP3が結合するとカルシウムチャネルがアロステリック変化を起こすと考えられている。
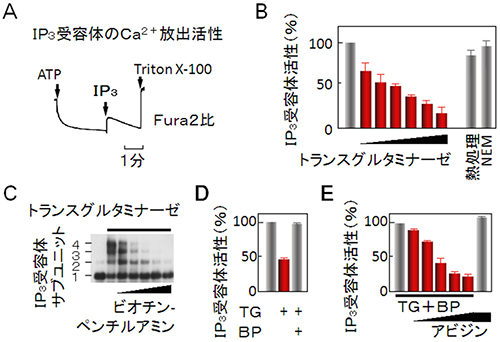
図2 トランスグルタミナーゼによるIP3受容体の架橋と機能阻害
- A.カルシウムイオン(Ca2+)濃度を計測できる化合物「Fura2」を用いたIP3受容体のCa2+放出活性の測定。小脳から調製した粗マイクロソーム画分にATP(アデノシン三リン酸)を混合すると小胞体がCa2+を取り込み、蛍光高度計内に設置したキュベット内のCa2+濃度が低下しFura2比が減少する(左矢印)。IP3を添加するとCa2+濃度上昇が見られ(矢印)、これをIP3受容体のCa2+放出活性とした。非イオン系界面活性剤のTritonX100で小胞体を可溶化し小胞体内腔Ca2+量を確認した。
- B.トランスグルタミナーゼ(TG)は容量依存的にIP3受容体のCa2+放出活性を阻害した(50%効果濃度[EC50]は34ナノモラー[nM])。熱処理かN-エチルマレイミド処理するとTGはIP3受容体を阻害しなかった。
- C.TGによる架橋がビオチンペンチルアミン(BP)により阻害されることをアガロース電気泳動で確認した。
- D.TGによるIP3受容体の機能阻害はBPを共存すると解消された。
- E.BP存在下でTG処理し洗浄後アビジンを添加するとIP3受容体活性が容量依存的に阻害された。TGで前処理しない場合は阻害されなかった(右)。
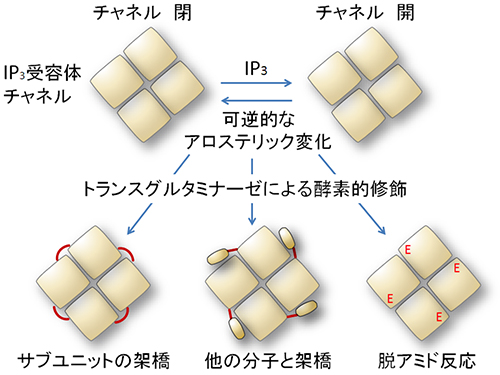
図3 トランスグルタミナーゼによる新しいアロステリック制御メカニズム
イオン透過口(チャネル)の開閉に必要なアロステリック変化には可逆的なサブユニット間の配置変化が重要であることが示された(図上)。トランスグルタミナーゼによるIP3受容体の酵素的修飾は少なくとも3種類存在し、サブユニット間の架橋(図左下)と他の巨大分子との架橋(図中下)によりサブユニット間の配置変化が恒常的に阻害されることが明らかとなった。一方、脱アミノ反応により2,746番のグルタミン残基がグルタミン酸(E)に変換する反応も触媒し(図右下)脱抑制に働くことが分かった。
