要旨
理化学研究所(理研)グローバル研究クラスタ疾患糖鎖研究チームの木塚康彦基礎科学特別研究員、北爪しのぶ副チームリーダー、谷口直之チームリーダーらの共同研究グループ※は、バイセクト糖鎖と呼ばれる糖鎖[1]がアルツハイマー病を進行させることを発見しました。
アルツハイマー病は認知症患者の半数以上を占める疾患で、高齢化が進む現代社会ではその克服が大きな課題の1つとなっています。アルツハイマー病の原因は、アミロイドβ(Aβ)[2]と呼ばれるペプチドが脳に蓄積することにあると考えられていますが、Aβが蓄積していくメカニズムについては不明な点が多く残されています。
共同研究グループは今回、脳に豊富に存在するバイセクト糖鎖に注目しました。バイセクト糖鎖は、タンパク質に糖が鎖状につながった糖鎖の一種で、最近、アルツハイマー病患者の脳で量が増えているという研究結果が報告されています。
共同研究グループは、バイセクト糖鎖を作る酵素「GnT-III[3]」を欠損させたマウスを用い、脳内のAβの蓄積を調べました。その結果、バイセクト糖鎖を持たないマウスでは、Aβの蓄積が激減し、記憶能力の低下も抑えられることが分かりました。AβはBACE1(βセクレターゼ)[4]と呼ばれる酵素によって作られることが知られていますが、共同研究グループは、BACE1がバイセクト糖鎖を持っていること、また、バイセクト糖鎖を欠損させるとBACE1がAβの前駆体タンパク質(APP)と細胞内で異なる分布を示すようになり、その結果Aβの産生を抑制できることを突き止めました。
これらの結果より、バイセクト糖鎖を作る酵素GnT-IIIの阻害剤は新規のアルツハイマー病治療薬となる可能性が示唆されました。現在、国内外の製薬会社がBACE1阻害剤開発を行っているところですが、BACE1はAPP以外にも多様なタンパク質の切断を行っているため、阻害剤が副作用を持つ可能性が指摘されています。BACE1に結合するバイセクト糖鎖を標的にした場合、より副作用の小さい阻害剤となる可能性があります。共同研究グループは現在、理研創薬・医療技術基盤プログラムの協力のもと、GnT-IIIの阻害効果を持つ化合物を大規模探索(ハイスループットスクリーニング[5])によって探索する研究を進めています。
本研究は、欧州の医学専門誌『EMBO Molecular Medicine』オンライン版(1月15日付け:日本時間1月15日)に掲載されます。
※共同研究グループ
理化学研究所 グローバル研究クラスタ システム糖鎖生物学研究グループ 疾患糖鎖研究チーム
チームリーダー 谷口 直之(たにぐち なおゆき)
副チームリーダー 北爪 しのぶ(きたづめ しのぶ)
基礎科学特別研究員 木塚 康彦(きづか やすひこ)
理化学研究所 脳科学総合研究センター 神経蛋白制御研究チーム
チームリーダー 西道 隆臣(さいどう たかおみ)
広島大学大学院 先端物質科学研究科
准教授 中の 三弥子(なかの みやこ)
東京都健康長寿医療センター 研究所
副所長 遠藤 玉夫(えんどう たまお)
神経内科部長 村山 繁雄(むらやま しげお)
背景
アルツハイマー病(Alzheimer’s disease, AD)は、認知症の60%以上を占めており、平成22年時点で日本では約439万人が認知症に罹患しており、軽度認知障害を持つ人も含めるとその数は約819万人になるといわれています注)。アルツハイマー病対策は大きな課題の1つですが、現状では有効な治療薬・予防薬が少ないため、その開発が強く望まれています。
アルツハイマー病では脳内にアミロイドβ(Aβ)と呼ばれるペプチドが長年にわたって徐々に蓄積し、アミロイド斑(老人斑)と呼ばれるAβの凝集体が作られます。Aβは認知症状の現れる前から脳に蓄積し始めます。アルツハイマー病の発症に関して現在最も有力な仮説である「アミロイドカスケード仮説[6]」では、このAβの蓄積が発症の引き金となり、最終的に神経細胞の死や脳の萎縮へつながると考えられています。AβはAβ前駆体タンパク質(APP)が2段階の切断を受けて生じることが分かっていますが、アルツハイマー病を発症していく過程でAβの蓄積量がどのように増えていくかの詳細は分かっていません。
共同研究グループは、糖が鎖状につながった糖鎖と呼ばれるタンパク質の修飾に着目しました。疾患の発症過程では、タンパク質上の糖鎖の形が変わることがしばしば見られ、糖鎖の変化によるタンパク質の機能の変化が疾患の発症や進行に深く関わることが知られています。共同研究グループは特に、脳に豊富に存在するバイセクト糖鎖に注目しました。バイセクト糖鎖は、最近、アルツハイマー病患者の脳でその量が増えているという研究結果が報告されています。そこで、バイセクト糖鎖がアルツハイマー病の発症や進行にどのように関わるのかについて調べました。
注)認知症有病率等調査(厚生労働科学研究 筑波大学 朝田隆教授)より
研究手法と成果
共同研究グループは、マウスを用いてバイセクト糖鎖の役割を調べました。マウスは自然にはアルツハイマー病を発症しませんが、遺伝子組み換えによってAβを溜まりやすくするとアルツハイマー病に似た症状を呈します。これがADモデルマウスです。このADモデルマウスを用い、さらにバイセクト糖鎖を作る酵素「GnT-III」(図1)を遺伝子組み換えによって欠損させ、バイセクト糖鎖を持たないADモデルマウスを作製しました。
このバイセクト糖鎖欠損マウスの脳を見ると、通常のADモデルマウスで見られるアミロイド斑が激減していました(図2)。また、記憶能力を測る試験では、通常のADモデルマウスで見られるような記憶能力の低下がほとんど見られませんでした。これらの結果は、バイセクト糖鎖を欠損させるとAβが蓄積しなくなり、その結果、認知・記憶能力の低下を防げることを示しています。
次に共同研究グループは、バイセクト糖鎖の欠損によってなぜAβの蓄積が抑制できたのか、その原因を調べました。その結果、バイセクト糖鎖を欠損させるとAβの産生量が減少することが明らかになりました。Aβは、APPと呼ばれる前駆体タンパク質が2段階の切断を受けることによって作られ、その2段階の切断は、BACE1(βセクレターゼ)、γセクレターゼという2つの酵素が行います(図3)。解析によって、その2つの酵素のうちBACE1の上にバイセクト糖鎖が存在していること、そのバイセクト糖鎖が無くなるとBACE1によるAPPの切断が起こりにくくなることが分かりました。さらに詳細に解析した結果、バイセクト糖鎖を欠損させるとBACE1の細胞内の分布(局在)が変化し、APPと離れた場所に分布することが分かりました(図4)。このことから、バイセクト糖鎖を欠損させたマウスでAβが蓄積しないのは、BACE1の分布の変化によって作られるAβの量が少ないためだと考えられました。
また共同研究グループは、アルツハイマー病の患者で、BACE1上のバイセクト糖鎖の量が増えていることも明らかにしました。これらの結果から、アルツハイマー病の発症過程においては、バイセクト糖鎖で修飾されるBACE1が増え、BACE1とAPPが細胞内で同じ場所に存在するようになるとAβの産生が増し、それが病気を進行させる一因になっていることが分かりました。
今後の期待
現在、アルツハイマー病の有効な治療薬・予防薬は少なく、さまざまな薬の開発が進められていますが開発途上にあります。中でもAβ産生酵素であるBACE1の阻害剤は有望な治療薬候補として期待され、実際にいくつかのBACE1阻害剤が臨床試験に入っています。ところが、BACE1の阻害剤には副作用の懸念があります。BACE1を欠損させたマウスは確かにAβを産生しませんが、多くは生後まもなく死亡し、生き残ったマウスも網膜や筋肉、髄鞘(ずいしょう)などに異常が見られます。BACE1はAPP以外にも多様なタンパク質の切断を行っており、その切断が生体にとって重要な機能を持つため、BACE1の欠損マウスはこのような重篤な異常を示すと考えられています。
一方、バイセクト糖鎖の欠損マウスでは、こうした重篤な異常は見られませんでした。実際に、共同研究グループがAPP以外のタンパク質のBACE1による切断を調べたところ、バイセクト糖鎖欠損マウスでは正しく切断されていることが分かりました。このことは、バイセクト糖鎖を阻害するとBACE1によるAβの産生を防ぐことができ、かつBACE1が持つ他の機能は妨げないことを示唆しています。これらから、バイセクト糖鎖を作る酵素GnT-IIIの阻害剤は、BACE1阻害剤よりも副作用の少ない治療薬候補になりうると考えられます。
共同研究グループは現在、理研創薬・医療技術基盤プログラムと共同で、GnT-III阻害剤の探索を行っています。一般に糖鎖の合成阻害剤の大規模な探索(ハイスループットスクリーニング)はこれまでほとんどなされていませんでしたが、共同研究グループは最近、新たにそのためのシステムを確立しました。これにより今後、糖鎖をターゲットにした新しいアルツハイマー病の治療薬候補の開発が期待できます。
原論文情報
- Yasuhiko Kizuka, Shinobu Kitazume, Reiko Fujinawa, Takashi Saito, Nobuhisa Iwata, Takaomi C. Saido, Miyako Nakano,Yoshiki Yamaguchi, Yasuhiro Hashimoto, Matthias Staufenbiel, Hiroyuki Hatsuta, Shigeo Murayama, Hiroshi Manya, Tamao Endo, Naoyuki Taniguchi, "An aberrant sugar modification of BACE1 blocks its lysosomal targeting in Alzheimer’s disease", EMBO Molecular Medicine, doi:10.15252/emmm.201404438
発表者
理化学研究所
グローバル研究クラスタ 理研-マックスプランク連携研究センター システム糖鎖生物学研究グループ 疾患糖鎖研究チーム
グループディレクター(兼チームリーダー) 谷口 直之(たにぐち なおゆき)
副チームリーダー 北爪 しのぶ(きたづめ しのぶ)
基礎科学特別研究員 木塚 康彦(きづか やすひこ)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.糖鎖
グルコース(ブドウ糖)などの糖が鎖状につながった物質。遊離の状態で存在するものもあれば、タンパク質や脂質に結合した状態のものもある。 - 2.アミロイドβ(Aβ)
アルツハイマー病発症の原因と考えられているペプチドで、凝集しやすい性質を持つ。長さの異なる数種類のAβがあり、凝集性が異なる。APPと呼ばれる前駆体タンパク質が2段階の切断を受けることによって作られる。 - 3.GnT-III
糖鎖を合成する酵素(糖転移酵素)の1つ。N-アセチルグルコサミン(GlcNAc)転移酵素IIIとも呼ばれ、バイセクト糖鎖を細胞内で合成する。アルツハイマー病患者の脳で、GnT-IIIの発現が上昇していることが最近報告されている。 - 4.BACE1(βセクレターゼ)
APPからAβが作られる際に1段階目の切断を行う酵素。BACE1の阻害剤はアルツハイマー病治療薬候補として現在臨床試験中。BACE1欠損マウスは致死性などの重篤な異常を示す。 - 5.ハイスループットスクリーニング
多くの化合物を含むライブラリから目的の活性を持つ化合物を探索すること。 - 6.アミロイドカスケード仮説
Aβの蓄積がアルツハイマー病発症の引き金になるとする有力な仮説。遺伝性のアルツハイマー病がAβ産生に関わる遺伝子(APP、γセクレターゼ)の変異によって引き起こされること、Aβの蓄積は神経原線維変化など他の異常が見られる前から進行していること、などの事実に基づいている。
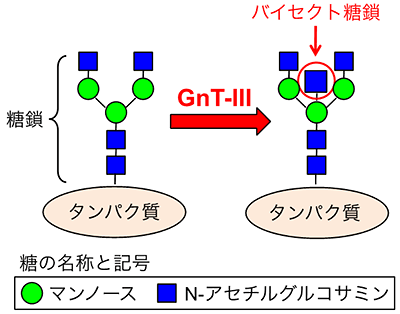
図1 バイセクト糖鎖はGnT-IIIと呼ばれる酵素によってタンパク質の上に作られる
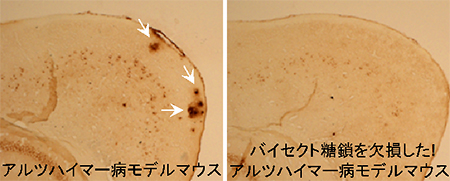
図2 マウス脳におけるアミロイドβの染色像
- (左) アルツハイマー病モデルマウス
- (右) バイセクト糖鎖を欠損させたアルツハイマー病モデルマウス
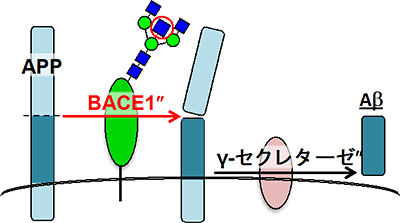
図3 Aβの産生過程
Aβは前駆体となるAPPが、BACE1とγセクレターゼによって2段階の切断を受けることにより作られる。BACE1はバイセクト糖鎖を持っており、この糖鎖がなくなるとBACE1によるAPPの切断が起こりにくくなる。
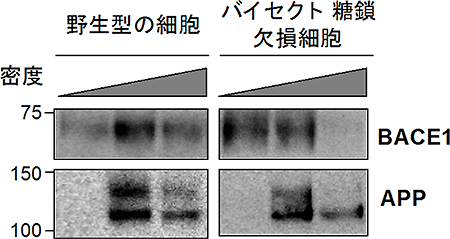
図4 BACE1の細胞内分布の変化
通常の細胞とバイセクト糖鎖を欠損する細胞の内容物を密度によって分離した。APPの分布はバイセクト糖鎖の有無で変わらないが、BACE1の分布はバイセクト糖鎖の欠損によって密度の軽い画分に移行している。
