要旨
理化学研究所(理研)脳科学総合研究センター発生神経生物研究チームの御子柴克彦チームリーダー、久恒智博研究員らの研究チーム※は、マウスを使った実験により、細胞内の小胞体[1]に存在し、酸化還元により制御を受けるタンパク質「ERp44」が血圧制御に重要な役割を果たすことを発見しました。
分泌タンパク質や細胞膜タンパク質は、小胞体上のリボソームで合成された後、小胞体内腔に入って正しく折り畳まれ、正常な立体構造となったタンパク質だけがゴルジ体を通り最終目的地に到達します。しかし、細胞がさまざまなストレスを受けてこの品質管理機構が破綻すると、小胞体内腔で異常な立体構造のタンパク質が蓄積し、神経変性疾患などさまざまな病気の発症につながると考えられています。小胞体には、数多くの分子シャペロン[2]やタンパク質修飾酵素(糖鎖付加やジスルフィド結合[3]形成などをする酵素)が存在し、タンパク質の正常な立体構造や多量体[4]の形成を調節しています。
ERp44は小胞体に存在し、酸化還元により活性制御を受けるタンパク質の1つです。これまで培養細胞を用いた実験で、ERp44がさまざまなタンパク質の多量体形成や分泌を小胞体内腔で調節し、分泌タンパク質の品質管理に関わることが報告されていました。しかし、ERp44が生体内でどのような働きをするかはほとんど明らかになっていませんでした。研究チームは、ERp44の役割を明らかにするため、ERp44を欠損させたマウスを作成し、調べました。その結果、ERp44欠損マウスでは、血圧を上げる作用を持つアンジオテンシンII[5]の安定性が野生型マウスに比べて減少し、濃度が低下して低血圧を示しました。さらに詳しく調べた結果、野生型マウスでは、ロイシンアミノペプチダーゼ(LAP)[6]の1つで、アンジオテンシンIIを分解する「ERAP1(小胞体アミノペプチダーゼ1)」が、小胞体内腔でERp44とジスルフィド結合し、小胞体内腔に留まっていました。一方、ERp44欠損マウスでは、ERp44がないためERAP1が小胞体内腔に留まることができずに細胞外に多量に分泌され、その結果、血中のアンジオテンシンIIが分解され低血圧を起こすことが明らかになりました。また、症状の1つに血圧の急速な低下を示す敗血症[7]のモデル実験では、ERp44とERAP1の結合が増加し、血圧低下を抑制することが分かりました。
この結果は、小胞体内腔に存在するERp44がERAP1の細胞の内外における局在を調節することでアンジオテンシン濃度を制御し、血圧を調節することを示唆しています。今後、ヒトの血圧に、小胞体内腔の酸化還元状態やERp44-ERAP1相互作用がどのように関わるか明らかにすることで、それらを基盤とした血圧治療法に結びつくと期待できます。
本研究は、米国の科学雑誌『Molecular Cell』(6月18日号)に掲載されるのに先立ち、オンライン版(5月7日付け:日本時間5月8日)に掲載されます。
※研究チーム
理化学研究所 脳科学総合研究センター
発生神経生物研究チーム
チームリーダー 御子柴 克彦(みこしば かつひこ)
研究員 久恒 智博(ひさつね ちひろ)
テクニカルスタッフ 戎井 悦子(えびすい えつこ)
テクニカルスタッフ 小川 直子(おがわ なおこ)
テクニカルスタッフ 鈴木 昭夫(すずき あきお)
生体物質分析支援ユニット
支援ユニットリーダー 俣賀 宣子(またが のぶこ)
テクニカルスタッフ 臼井 正哉(うすい まさや)
北海道大学 医学系研究科 医学専攻 解剖学講座
准教授 岩永 ひろみ(いわなが ひろみ)
背景
分泌タンパク質や細胞膜タンパク質は、細胞内小器官の1つである小胞体上のリボソームで合成された後、小胞体、ゴルジ体を通って分泌経路に入り目的地にたどり着きます。小胞体内腔では、分子シャペロンやタンパク質修飾酵素(糖鎖付加やジスルフィド結合形成などをする酵素)の働きでタンパク質が設計通りに折り畳まれ、正常な立体構造や多量体を形成したタンパク質だけがゴルジ体に輸送されます。外界からのさまざまなストレスによりこの分子機構が破綻すると、小胞体内腔に異常な構造のタンパク質が蓄積し、パーキンソン病やハンチントン病などの神経変性疾患をはじめ、さまざまな病気の発症につながると考えられています。
ERp44は、小胞体に存在し、酸化還元により活性制御を受けるタンパク質の1つです。標的タンパク質のジスルフィド結合を還元的に開裂する活性を持つチオレドキシン[8]に似た立体構造をもっています。これまで培養細胞を用いた研究では、ERp44が分子間のジスルフィド結合を介して、脂肪酸の燃焼や細胞内への糖の取り込みを促進するアディポネクチン[9]や抗体の多量体形成、酸化還元酵素の細胞外への分泌などを制御していることが示されていました。しかし、生体内でどのような働きをするのかはほとんど明らかになっていませんでした。
そこで研究チームは、ERp44を欠損させたマウスを作成し、どのような表現型が生じるか調べました。
研究手法と成果
ERp44欠損マウスは、出生直後に尿が少なく、また腎臓の遠位尿細管の肥大がみられました。これらの表現型が血液中のアンジオテンシンIIの原料となるアンジオテンシノーゲン[10]欠損マウスの表現型に類似していたため、ERp44欠損マウスの血圧を測定したところ、野生型マウスに比べて低血圧でした(図1A)。そこでERp44欠損マウスの血液中のアンジオテンシンII濃度を測定したところ、野生型に比べて低下していました(図1B)。またERp44欠損マウスの血清は、野生型マウスに比べてアンジオテンシンIIを試験管内でより速く分解することを発見しました(図1C)。
次に、ERp44欠損マウスの血液中アンジオテンシンII濃度がなぜ減少しているのかを調べました。ERp44欠損マウスの血液検査を行ったところ、ロイシンアミノペプチダーゼ(LAP)の活性が異常に上昇していました(図2A)。研究チームは、「ERp44がないため、LAP活性を持つ酵素が小胞体から細胞外に多量に放出され、その酵素によって過度に血中のアンジオテンシンIIが分解され濃度が低下するのではないか」という仮説を立てました。そこで、ERp44をマウスの肝臓から取り出し、質量分析法を用いてERp44に結合している分子を解析しました。その結果、LAP活性を持ちアンジオテンシンIIを分解する「ERAP1(小胞体アミノペプチダーゼ1)」が、酸化還元状態に依存的にERp44に結合することが分りました(図2B)。
さらに、野生型マウスの細胞では新しく合成されたERAP1が細胞内に留まるのに対し、ERp44欠損マウスの細胞では細胞内から培養液中に速やかに分泌されました(図3A)。また、ERp44欠損マウスの血清からERAP1を抗ERAP1抗体により除去したところ、アンジオテンシンIIの分解速度が野生型マウスの血清と比較して差がなくなりました(図3B)。このことから、ERp44欠損マウスでは、合成されたERAP1が細胞内に留まることができずに、血液中に分泌され、アンジオテンシンIIを分解してしまうために、低血圧を示している可能性が示唆されました。
敗血症は細菌が血液中に侵入しておこる全身性の感染症ですが、その症状の1つに血圧の急速な低下があります。研究チームは、マウスを用いてERp44とERAP1の結合が敗血症の発症時にどのように変化するかを解析しました。その結果、敗血症の発症時にERp44とERAP1の結合が増加することが分かりました(図4A)。また、ERp44を通常の半分の量しか持たないERp44のヘテロマウスは、敗血症時に細胞内の小胞体に留めることのできるERAP1の量が減少し、その結果ERAP1が血液中に多く分泌されて野生型マウスよりも血圧低下の程度が大きくなることを発見しました(図4B)。
これらの結果から研究チームは、小胞体内腔に存在するERp44が小胞体内腔の酸化還元状態に応じてERAP1の細胞内外の局在を制御しており、この制御の結果血液中に分泌されたERAP1がアンジオテンシンIIを分解し、血圧の調節を行う機構が存在するというモデルを提唱しました(図5)。
今後の期待
今回の研究から、小胞体内腔の酸化還元状態がERp44とERAP1の結合に影響すること、また、その結果として血液中のERAP1の量が変化してアンジオテンシンIIの濃度が変化し、血圧に影響を与えることが示唆されました。小胞体内腔の酸化還元環境は、活性酸素種[11]、小胞体内腔カルシウムの低下など、さまざまなストレスに影響されることが示されています。このため、これらの要因と血圧変化との関係をERp44-ERAP1相互作用に着目して解明できる可能性があります。また、ERp44の結合タンパク質として新たに同定したERAP1は、免疫の抗原提示[12]に関係することが知られており、そのヒト遺伝子多型[13]は高血圧だけでなく、強直性脊椎炎[14]や乾癬(かんせん)[15]といった疾患との関係があることが報告されています。今後はこれらの疾患が、小胞体内腔の酸化還元環境や細胞内外のERAP1の量と関わりがあるのかどうかを明らかにすることで、それらを基盤にした治療法の確立につながると期待できます。
原論文情報
- Chihiro Hisatsune, Etsuko Ebisui, Masaya Usui, Naoko Ogawa, Akio Suzuki, Nobuko Mataga, Hiromi Takahashi-Iwanaga, and Katsuhiko Mikoshiba, "ERp44 exerts redox-dependent control of blood pressure at the ER", Molecular Cell, doi: 10.1016/j.molcel.2015.04.008
発表者
理化学研究所
脳科学総合研究センター 発生神経生物研究チーム
チームリーダー 御子柴 克彦(みこしば かつひこ)
研究員 久恒 智博(ひさつね ちひろ)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.小胞体
真核生物の細胞小器官の1つ。タンパク質の合成や品質管理の場、細胞内カルシウム貯蔵庫として働く。 - 2.分子シャペロン
タンパク質の正常な折り畳みを助ける働きを持つタンパク質の総称。 - 3.ジスルフィド結合
2つのチオール基(-SH)間が酸化されてできる共有結合で、-S-S-結合と表される。一般にタンパク質のシステイン残基のチオール基同士で形成される。 - 4.多量体
小さな同じ分子が多数結合してできる巨大な分子。 - 5.アンジオテンシンII
8つのアミノ酸から成るポリぺプチド。血圧の上昇作用を持つ。 - 6.ロイシンアミノペプチダーゼ(LAP)
LAPはleucine aminopeptidaseの略。タンパク質のアミノ酸鎖をアミノ末端から順次加水分解する酵素。 - 7.敗血症
細菌が血液中に侵入しておこる全身性の感染症。 - 8.チオレドキシン
標的タンパク質のジスルフィド結合(S-S結合)を還元開裂させる活性を持つタンパク質の1つ。 - 9.アディポネクチン
脂肪細胞から分泌され、脂肪酸の燃焼や糖の取り込みを促進する分泌タンパク質。 - 10.アンジオテンシノーゲン
アンジオテンシンIIの原料。主に肝臓で作られる。腎臓から分泌される分解酵素のレニンによりアンジオテンシンIが作られ、さらにアンギオテンシン変換酵素により分解されてアンジオテンシンIIが作られる。 - 11.活性酸素種
酸素分子に由来する反応性に富む一群の分子群の総称。 - 12.抗原提示
細胞内外の異物を分解し、その一部を細胞の表面に提示してリンパ球に異物の侵入を知らせる機構。 - 13.遺伝子多型
遺伝子を構成しているDNAの配列の個体差。 - 14.強直性脊椎炎
背骨や骨盤を中心に全身の腱や靱帯に炎症が起こり、運動制限を起こす病気。 - 15.乾癬(かんせん)
皮膚が角化する慢性疾患。
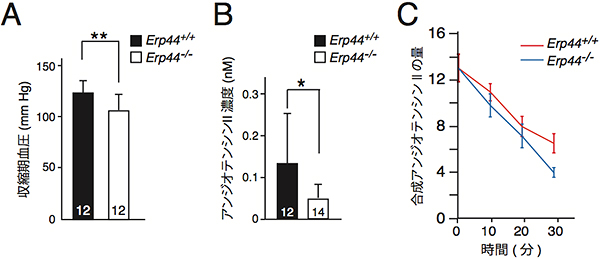
図1 ERp44欠損マウスの血圧、アンジオテンシンII濃度・分解の測定結果
- A: 野生型(Erp44+/+)とERp44欠損マウス(Erp44-/-)の血圧。野生型マウスに比べてERp44欠損マウスのほうが低血圧を示した。
- B: 野生型(Erp44+/+)とERp44欠損マウス(Erp44-/-)の血液中のアンジオテンシンIIの濃度。野生型に比べてERp44欠損マウスのほうが低下している。
- C: 野生型(Erp44+/+,赤ライン)とERp44欠損マウス(Erp44-/-、青ライン)の血清を用いた合成アンジオテンシンIIの分解の様子。野生型マウスに比べてERp44欠損マウスのほうがより速く分解している。
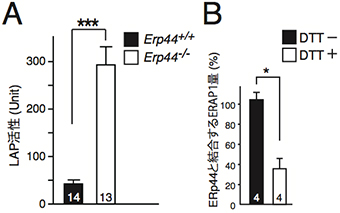
図2 ERp44欠損マウスの血液中のLAP活性(A)とERp44—ERAP1結合量の測定結果(B)
- A: 野生型(Erp44+/+)とERp44欠損マウス(Erp44-/-)の血液中のLAP活性。ERp44欠損マウスではLAPの活性が異常に上昇している。
- B: 酸化還元剤「ジチオトレイトール(DTT)」を用いてERp44とERAP1の結合量を測定した。DTT存在下では、ERp44とERAP1の結合量は低下する。
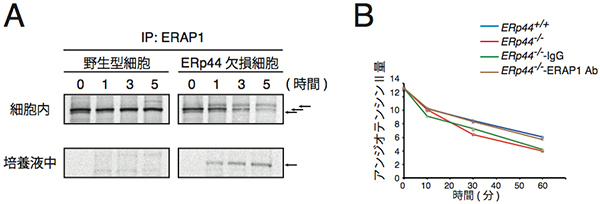
図3 ERAP1の細胞内での動態(A)とERAP1を除去した血清のアンジオテンシンIIの分解(B)
- A: 35S同位体でラベルしたERAP1の細胞内での動態の観察結果。野生型マウスの細胞のERAP1の量は5時間経っても減少せずに、細胞内に検出された。一方、ERp44欠損マウスの細胞内のERAP1の量は時間経過とともに減少し、培養液中に検出された。矢印は分泌過程で糖鎖修飾を受けて異なる分子量を持ったERAP1。
- B: ERp44欠損マウスの血清からERAP1を除去する(茶ライン)と野生型マウスの血清(青ライン)を用いた合成アンジオテンシンの分解速度と同じになる。
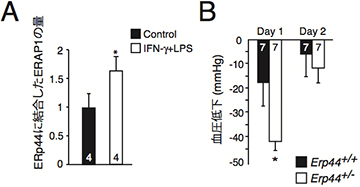
図4 敗血症時のERp44とERAP1の結合と血圧低下への影響
- A: 敗血症(IFNg+LPS)誘導時にERp44とERAP1結合が増加していることが分かる。
- B: 野生型(Erp44+/+)とERp44ヘテロ欠損マウス(Erp44-/-)における敗血症における血圧変化。各棒グラフの数はマウスの数。ERp44ヘテロ欠損マウスは野生型マウスよりも血圧低下の程度が大きい。
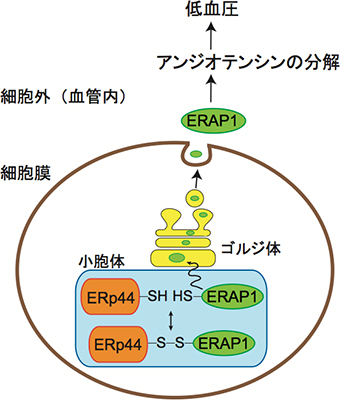
図5 ERp44による血圧制御機構のモデル図
ERp44は、ERAP1とジスルフィド結合(S-S結合)を介して結合し、ERAP1を小胞体に留める。ジスルフィド結合が還元されてERp44との結合がなくなるとERAP1は細胞外に放出されて、アンジオテンシンIIを分解して血圧に影響する。つまり、ERp44は酸化還元によりERAP1の細胞内と細胞外の局在を決定し血圧を調節する。
