2015年9月15日
理化学研究所
生理学研究所
基礎生物学研究所
革新的技術による脳機能ネットワークの全容解明プロジェクト
生きた霊長類の脳内で神経細胞の「スパイン」を観察
-学習や記憶を司る脳内神経ネットワークの解明へ-
要旨
理化学研究所脳科学総合研究センター高次脳機能分子解析チームの山森哲雄チームリーダー、定金理研究員、生理学研究所の伊佐正教授らの共同研究グループ※は、新世界ザル[1]であるマーモセットの大脳皮質において、2光子顕微鏡を用いてスパインと呼ばれる神経細胞の微細形態を生体内で可視化する手法を開発しました。
大脳皮質の神経細胞は、他の神経細胞群との情報伝達を行うために複雑な形態を持っています。その構成要素の一つである樹状突起には「スパイン」と呼ばれる微細な突起構造があります。神経細胞間のスパイン結合の度合いの変化は、個体の学習や記憶の基盤であると考えられています。したがって、生体内のスパインを直接観察する手法は、学習や記憶に伴って生じる神経細胞ネットワークの変化や、その基盤となる分子メカニズムを調べるためにあたって極めて重要です。しかし、スパインを生体内で可視化する手法は主にマウスでの研究に限られており、ヒトに近い霊長類での研究には適用されてきませんでした。本研究では、新世界ザルであるマーモセットにおいて、スパインを生体内で可視化する手法を開発することに取り組みました。
共同研究グループは、遺伝子発現を増幅させるTet-Offシステム[2]を用いることで強い発現を促し、Thy1Sプロモーター[3]が乗ったウイルスベクター[4]の濃度を適正なレベルまで調節したことで、マーモセットの脳内の神経細胞に緑色蛍光タンパク質(GFP)を「強く」「まばらに」発現させ、生体内のスパインを経時的に観察することに成功しました。これは霊長類の脳においては世界で初めての報告です。今後、霊長類の大脳皮質が関与する、学習過程における神経細胞ネットワークの変化や分子メカニズムを解明が期待できます。
本研究は、文部科学省『革新的技術による脳機能ネットワークの全容解明プロジェクト』(平成27年度から日本医療研究開発機構へ移管)の一環として行われました。成果は、米国の科学雑誌『eNeuro』に掲載されるのに先立ち、オンライン版(8月27日付け:日本時間8月28日)に公開されました。
※共同研究グループ
理化学研究所脳科学総合研究センター 高次脳機能分子解析チーム
チームリーダー 山森 哲雄(やまもり てつお)
研究員 定金 理(さだかね おさむ)
研究員 渡我部 昭哉(わたかべ あきや)
研究員 高司 雅史(たかじ まさふみ)
研究員 大塚 正成(おおつか まさなり)
*上記5名の前所属は自然科学研究機構 基礎生物学研究所 脳生物学研究部門
自然科学研究機構 生理学研究所
認知行動発達機構研究部門
教授 伊佐 正(いさ ただし)
研究員 笠井 昌俊(かさい まさとし)
生体恒常機能発達機構研究部門
教授 鍋倉 淳一(なべくら じゅんいち)
助教 加藤 剛(かとう つよし)
自治医科大学 分子病態治療研究センター 遺伝子治療研究部
教授 小澤 敬也(おざわ けいや)
(現 東京大学医科学研究所 医科学研究所附属病院 病院長)
准教授 水上 浩明(みずがみ ひろあき)
(現 自治医科大学 分子病態治療研究センター 遺伝子治療研究部 教授)
国立精神神経センター 微細構造研究部
研究員 佐々木 哲也(ささき てつや)
金沢大学 医薬保健研究域
附属脳・肝インターフェースメディシン研究センター 分子神経科学部門
教授 河崎 洋志(かわさき ひろし)
背景
大脳皮質の神経細胞は、他の神経細胞群との情報伝達を行うために複雑な形態を持っています。具体的には、細胞体、樹状突起、軸索の3つの部分から構成されます。このうち、細胞体は遺伝子を格納し、樹状突起と軸索は他の神経細胞との情報伝達のための導線として働きます。樹状突起の形態をさらに細かく見ると、主に興奮性の神経細胞同士が結合する部分に「スパイン」と呼ばれる微細な突起構造が存在します。
神経細胞のネットワークの中で、神経細胞間の結合の度合いが変化することが、個体の学習や記憶の基盤であると考えられています。そして、樹状突起上にあるスパインの変化は、興奮性神経細胞間の結合強度の変化を反映していると考えられます。そのため、スパインの形態やその変化を生体内で直接観察する手法は、学習や記憶に伴って生じる神経細胞ネットワークの変化や、その基盤となる分子メカニズムを調べるにあたって極めて重要です。生体内でスパインを可視化する手法は、マウスを用いた研究で発展して来ました。現状では、トランスジェニックマウス[5]を用いてGFPを特定の種類の大脳皮質神経細胞に発現させ、それを2光子顕微鏡[6]で観察することで、マウスの大脳皮質神経細胞の樹状突起やスパインを可視化することが可能になっています。
しかしこれまで、スパインを生体内で可視化する手法を、霊長類の脳に適用した例は報告されていませんでした。ヒトの脳機能を理解する上で霊長類を用いた研究は重要な位置を占めています。本研究では、新世界ザルであるマーモセットの大脳皮質でスパインを可視化し、経時的に観察する手法の開発を目指しました。
研究手法と成果
共同研究グループは、ウイルスベクターを用いて蛍光タンパクを「強く」「まばらに」神経細胞に発現させることができれば、マーモセットでもスパインを生体内で可視化できると考えました。具体的には、アデノ随伴ウイルスベクターを用いて、GFPをマーモセットの大脳皮質神経細胞に発現させました。本手法の成功の鍵は、GFPを神経細胞に発現させる発現系の種類の選定と条件設定です。GFPを「強く」発現させるため、共同研究グループはTet-Offシステムを用いました。このシステムは本来、ドキシサイクリンなどの薬剤を用いて標的遺伝子の発現をオン、オフするために使用します。一方で、遺伝子の発現を増幅させることが知られており、それを利用することでGFPを強く発現させることができました。また、「まばらに」発現させるため、Thy1Sプロモーターの乗ったウイルスベクターの濃度を適正なレベルまで調節しました。
上記のウイルスベクターをマーモセットの大脳皮質に注入し、GFPの発現を2光子顕微鏡によって生体内で観察しました。その結果、個々の神経細胞の樹状突起と、樹状突起上にあるスパインを鮮明に可視化できました(図1)。
さらに、スパインが時間とともにどのように変化するかを調べるため、経時的なイメージングを行いました。前述のとおり、スパインは神経細胞が結合する部位であることから、スパインの変化は神経細胞ネットワークの結合の変化を反映していると考えられます。我々の手法によって、少数のスパイン(平均して1日あたり全体の5%程度)が時間とともに消失したり、新たに生じたりする様を解析することが可能になりました(図2)。
今後の期待
共同研究グループは、霊長類の脳において世界で初めて、生体内のスパインを観察することに成功しました。今後、霊長類の大脳皮質が関与する、学習過程における神経細胞ネットワークの変化や分子メカニズムの解明が期待できます。また、本研究で開発したスパインの可視化手法と、遺伝子の過剰発現や発現抑制の手法を組み合わせることで、霊長類大脳皮質における神経回路の機能的制御機構が解明できる可能性があります。
原論文情報
- Osamu Sadakane, Akiya Watakabe, Masanari Ohtsuka, Masafumi Takaji, Tetsuya Sasaki, Masatoshi Kasai, Tadashi Isa, Go Kato, Junichi Nabekura, Hiroaki Mizukami, Keiya Ozawa, Hiroshi Kawasaki, Tetsuo Yamamori, "In vivo two-photon imaging of dendritic spines in marmoset neocortex", eNeuro, doi: 10.1523/ENEURO.0019-15.2015
発表者
理化学研究所
脳科学総合研究センター 脳機能ネットワークの包括的解明プロジェクト 高次脳機能分子解析チーム
チームリーダー 山森 哲雄(やまもり てつお)
研究員 定金 理(さだかね おさむ)
 山森 哲雄
山森 哲雄
 定金 理
定金 理
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.新世界ザル
広鼻猿類のサルで、南米に生息することから新世界ザル(マーモセットを含む)とも呼ばれる。マーモセットは、近年霊長類のモデル動物としての関心が高まっている。 - 2.Tet-Offシステム
tTAと呼ぶ転写因子とTREと呼ばれるtTAに反応する配列を組み合わせ、両方の遺伝子をウイルスベクターによって細胞に発現させることで、TREの下流につなげた遺伝子の発現を調節することが出来るシステム。本来は、発現させた後、ドキシサイクリン(Dox)投与により、tTAの活性を抑える為に用いるが、本実験では、Doxを加えないで、tTA-TREの遺伝子発現増幅作用(数十倍)のみを利用した。 - 3.Thy1Sプロモーター
共同研究グループの河崎洋志教授(金沢大学)らが開発した、神経細胞に強く発現するThy1遺伝子を改変したプロモーター。マウス大脳皮質の神経細胞に発現させると、一部の神経細胞群にまばらに発現する。 - 4.ウイルスベクター
ウイルスのゲノムを利用して任意の遺伝子を発現させる担体(ベクター)の総称で、通常はウイルスの感染性を無くしたものを用いる。 - 5.トランスジェニックマウス
遺伝子の機能や発現パターンを解析することを目的として、特定の遺伝子を導入したマウス。操作遺伝子のDNA断片を受精卵にマイクロインジェクションで導入して作製する。導入するDNAにより用途は異なるが、マーカーとなるレポーター遺伝子の導入による遺伝子発現制御領域の同定や特定遺伝子を発現する細胞の機能解析に非常に有効な研究手法でマウスは標準的解析手法として用いられている。 - 6.2光子顕微鏡
2光子顕微鏡は、レーザー光を非常に密度高く集光することによって、通常は滅多に起こらない2つの光子が吸収されて物質のエネルギー状態が励起される物理現象を利用している。成体透過性の高い長い波長の光(赤外光)を用いることで、生体組織深部の観察を可能にする顕微鏡。
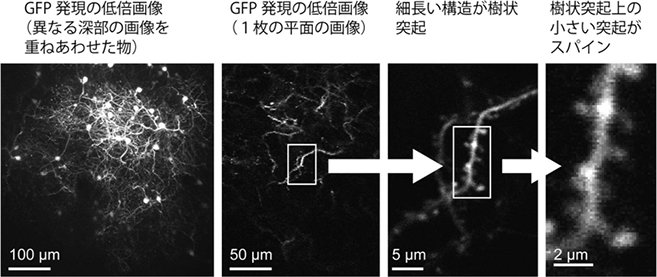
図1 マーモセット大脳皮質のスパイン画像
共同研究グループが開発した手法でマーモセットの大脳皮質のスパインを観察したところ、樹状突起の構造に加えて、樹状突起上の小さな突起であるスパインまで鮮明に可視化できた。
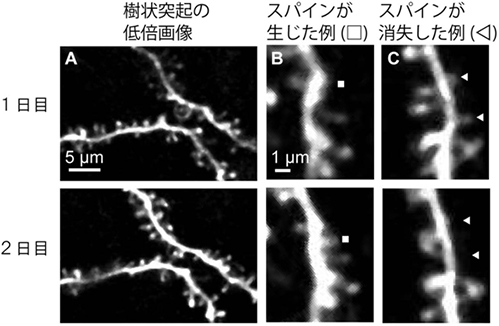
図2 マーモセット大脳皮質のスパインの経時的変化
開発した手法でマーモセット大脳皮質のスパインの経時的なイメージングを行った。1日目と2日目の画像を比較すると図中の□部にはあらたなスパインが発生し、△部ではスパインが消失したことが分かる。
