要旨
理化学研究所(理研)脳科学総合研究センター神経成長機構研究チームの上口裕之チームリーダー、産業技術総合研究所 健康工学研究部門の達吉郎研究部門長らの共同研究チームは、神経突起[1]を光で誘導[2]するための光活性型ペプチド[3]を開発しました。
神経回路を作るために伸長している神経突起は、正しい方向へ旋回を繰り返して最終標的へ到達します。神経突起は細胞外から流入したCa2+からははねのけられる、また小胞体[4]から放出されたCa2+には引き寄せられるといったように、Ca2+供給源の違いを識別して応答しています。しかし、その適切な応答を誘起する仕組みについては明らかにされていませんでした。
共同研究チームは、Ca2+供給源の1つである小胞体からのCa2+を特異的に検出するタンパク質分子「ミオシンVa」を同定しました。そして、Ca2+により活性化されたミオシンVaが、神経細胞で膜小胞[5]を動かし、神経突起の誘導をつかさどることを発見しました。このメカニズムに基づき、ミオシンVa活性化を模倣する光活性型ペプチドを開発し、このペプチドを導入した神経細胞の一部に光を照射することで、神経細胞内の特定部位で膜小胞を動かし、神経突起を任意の方向へ誘導することに成功しました。
本技術は、Ca2+依存性膜輸送という細胞内の普遍的な仕組みの人為的なコントロールを可能にします。今後、光による各種細胞機能の制御技術への応用が考えられます。例えば、神経突起の伸長を人為的にコントロールすることは、脳脊髄の損傷により断裂した神経回路を修復するために必須の医療技術です。本技術は神経回路修復をはじめとした、幅広い医学分野への貢献が期待できます。
本研究は、米国の科学雑誌『Cell Reports』(5月10日号)に掲載されるのに先立ち、オンライン版(4月28日付け:日本時間4月29日)に掲載されます。
背景
細胞質[6]のカルシウムイオン(Ca2+)は通常は低濃度に保たれていますが、細胞に刺激を与えると、細胞外からCa2+が流入したり、細胞内の小胞体からCa2+が放出されたりして、細胞質のCa2+濃度が一過的に上昇します。これらCa2+シグナルは多種多彩な細胞機能を制御し、異なる供給源からのCa2+シグナルは、異なる細胞応答を引き起こすことが知られています。
例えば、神経回路を作るために伸長している神経突起は、正しい方向へ旋回を繰り返して最終標的へ到達します。神経突起は、細胞外から流入したCa2+にははねのけられ、小胞体から放出されたCa2+には引き寄せられます。図1aに示すように、神経突起の片側で小胞体からCa2+が放出されると、Ca2+放出側でのみ膜小胞が先端部方向へ輸送され、神経突起はCa2+ 放出側へ旋回します。
しかし、細胞がCa2+供給源の違いを識別して適切な応答を誘起する仕組みは、明らかになっていませんでした。
研究手法と成果
共同研究チームは、小胞体から細胞質へのCa2+の通り道(Ca2+チャンネル)に結合するタンパク質を網羅的に解析し、ミオシンVaが小胞体由来のCa2+を特異的に検出する分子であることを発見しました。神経突起の内部でミオシンVaは膜小胞を小胞体表面につなぎ止めていますが、Ca2+が放出されるとミオシンVa はCa2+チャンネルから解離し、膜小胞は神経突起の先端部へ運ばれます(図1b)。そして、先端部へ運ばれた膜小胞は神経突起を旋回させます。
共同研究チームは、小胞体のCa2+チャンネルのアミノ酸配列情報に基づき、Ca2+チャンネルとミオシンVaの解離を促すペプチドを設計・作製しました。さらに、光照射で構造が変化するアミノ酸をペプチド内に挿入することで、光照射前は非活性型だが、光照射後にのみミオシンVaの解離を促すペプチドを開発しました(図2)。
この光活性型ペプチドを注入した神経突起の片側に光を照射すると、光照射部位でのみ神経突起先端部への膜小胞輸送が増加し、光照射側へ神経突起が旋回しました(図3)。
以上の研究により、共同研究グループは神経細胞がCa2+供給源を識別する分子メカニズムを明らかにし、このメカニズムに基づいて、細胞膜輸送および神経突起の誘導を人為的にコントロールするための新たなツールを開発しました。
今後の期待
神経突起の伸長を人為的にコントロールすることは、脳脊髄の損傷により断裂した神経回路を修復するために必須の医療技術です。細胞は、膜小胞輸送という普遍的な仕組みを利用して、生理活性分子を特定部位へ供給します。このため膜小胞輸送は、神経突起の伸長・誘導だけでなくシナプスでの情報伝達、さらには、がん細胞の転移などの各種生理的病的な細胞機能にも重要な役割を担います。
このような細胞機能の根幹を担う膜輸送を光で操作するためのツールを開発したことは、神経回路修復だけでなく幅広い医学分野への貢献が期待できます。
原論文情報
- Fumitaka Wada, Asuka Nakata, Yoshiro Tatsu, Noriko Ooashi, Tetsuko Fukuda, Takuji Nabetani, Hiroyuki Kamiguchi, "Myosin Va and Endoplasmic Reticulum Calcium Channel Complex Regulates Membrane Export during Axon Guidance", Cell Reports, doi: 10.1016/j.celrep.2016.04.021
発表者
理化学研究所
脳科学総合研究センター 神経成長機構研究チーム
チームリーダー 上口 裕之 (かみぐち ひろゆき)
 上口 裕之
上口 裕之
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.神経突起
神経細胞から伸びる細長い突起で、シナプスを介して他の細胞へ情報を伝える。 - 2.神経突起の誘導
神経系の発生段階において、神経細胞から伸びる神経突起を適切な方向へ旋回させて標的細胞まで到達させること。 - 3.ペプチド
多種類のアミノ酸が決められた順番でつながった分子。 - 4.小胞体
細胞質に存在する袋状の小器官で、内部に高濃度のCa2+を蓄えており、特定の刺激に応答して細胞質へCa2+を放出する。 - 5.膜小胞
細胞内に存在する膜に包まれた袋状の構造体で、物質の輸送を担う。 - 6.細胞質
形質膜に囲まれた細胞内部で、核以外の領域。
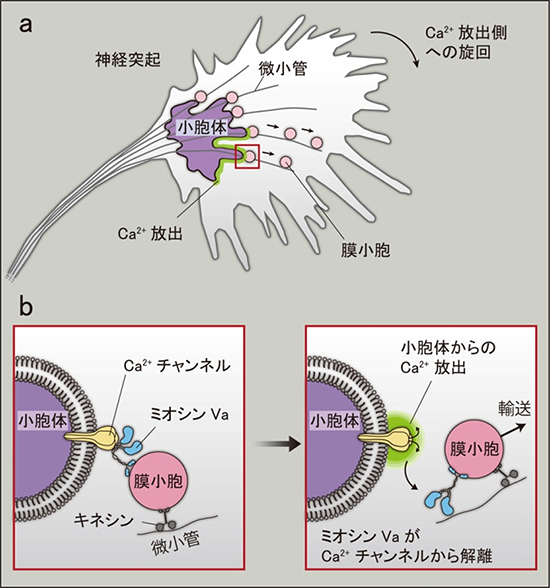
図1 Ca2+シグナルから神経突起旋回へいたる分子経路
a:神経突起の片側で小胞体からCa2+が放出されると(緑色の領域)、Ca2+放出側でのみ膜小胞が先端部へ輸送され(小さな直線の矢印)、神経突起はCa2+放出側へ旋回する(大きな曲線の矢印)。
b:aの赤枠内の拡大図。ミオシンVaは小胞体の表面に膜小胞をつなぎ止めている(左図)。小胞体Ca2+チャンネルからCa2+が放出されると(右図の緑色)、ミオシンVaはCa2+チャンネルから解離する。この結果、つなぎ止めてあった膜小胞は、小胞体から離れて微小管の上を神経突起の先端部方向へ動き出す。
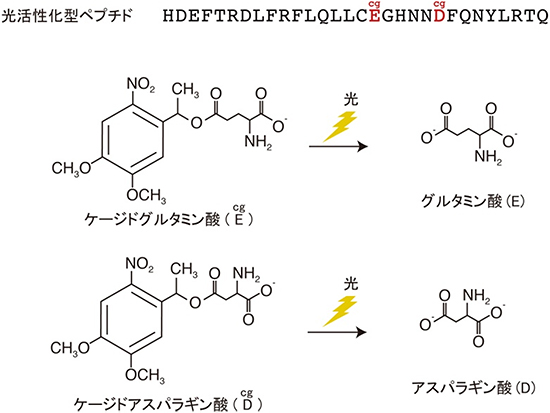
図2 開発した光活性型ペプチドの構造
上のラインは、神経突起を誘導するための光活性型ペプチドのアミノ酸配列を1文字表記で示したもの。配列中に挿入したケージドアミノ酸(赤字)は、光照射により本来のアミノ酸(グルタミン酸およびアスパラギン酸)に変換される。光照射前のケージドアミノ酸を含むペプチドは不活性型であるが、光照射により神経突起誘導活性を獲得する。
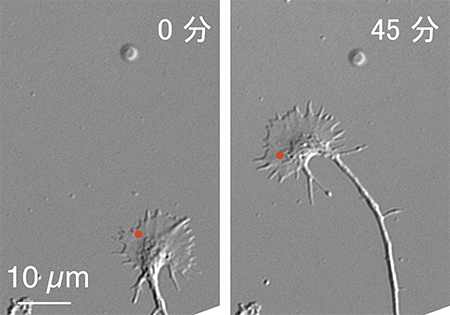
図3 光による神経突起の誘導
光活性型ペプチドを導入した神経突起の片側(赤点)に光を照射し、神経突起の旋回を誘起した。光照射直前(0分)および照射開始45分後の神経突起の顕微鏡写真を示す。スケールバーは、10マイクロメートル(μm、1μmは100万分の1メートル)に相当。
