要旨
理化学研究所(理研)小林脂質生物学研究室の小林俊秀主任研究員(研究当時)、牧野麻美特別研究員(研究当時)、阿部充宏専任研究員(研究当時)、石塚玲子専任研究員(研究当時)、村手源英研究員(研究当時)、岸本拓磨基礎科学特別研究員(研究当時)らの国際共同研究グループ※は、食用キノコのマイタケ[1]に脂質ラフトと呼ばれる動物細胞膜上の脂質構造に結合するタンパク質を発見し「ナカノリ注)」と名付けました。また、ナカノリの存在下ではインフルエンザウイルスの増殖が抑えられることを明らかにしました。
細胞膜上の脂質ラフトは、スフィンゴ脂質[2]とコレステロール[3]を主成分とした領域(脂質ドメイン)で、細胞膜を介した情報伝達、膜輸送、ウイルスやバクテリアの感染において重要な役割を果たしていると考えられています。しかし、その実態はよく分かっていませんでした。
今回、国際共同研究グループは、代表的なスフィンゴ脂質であるスフィンゴミエリン[2]とコレステロールを用いて人工的な脂質ラフトを作製し、結合するタンパク質のスクリーニングを行いました。その結果、マイタケ抽出液から新しいタンパク質を発見し「ナカノリ」と名付けました。
ナカノリには毒性がないため、生きた動物細胞での脂質ラフトの解析が可能になりました。また、超解像顕微鏡[4]、電子顕微鏡による観察で、脂質ラフトのサイズや脂質ラフトに存在するタンパク質の分布が明らかになるとともに、コレステロール代謝異常の患者由来の細胞で、細胞膜の脂質ラフトが正常細胞と異なっていることも分かりました。
さらに、インフルエンザ感染における脂質ラフトの役割について、ナカノリを使って調べました。その結果、インフルエンザウイルスは脂質ラフトの縁から出芽[5]することが分かりました。また、ナカノリ存在下では、培養細胞でのウイルスの増殖が抑えられることが明らかになりました。これまでの抗インフルエンザ薬はウイルスのタンパク質をターゲットとするため、ウイルスの変異によって効果がなくなることが問題となっていました。
本研究は、宿主の脂質ラフトが抗インフルエンザ薬のターゲットと成りうることを示すとともに、脂質ラフトに特異的に結合するナカノリが抗インフルエンザ薬として有用であることを示しています。
本研究は、米国の科学雑誌『The FASEB Journal』オンライン版(8月11日付け)に掲載されました。
注)脂質”ラフト=筏(いかだ)”に結合することを踏まえて民謡木曽節の一節「木曽の中乗り(筏乗り)」からとった。
背景
細胞膜は、脂質とタンパク質の複合体です。細胞膜の構成成分は、細胞膜上でランダムに分布しているのではありません。さまざまな組成の脂質・タンパク質集合体からなる膜の微小領域(ドメイン)が集合して、細胞膜を形作っています。細胞膜上にある脂質ラフトは、スフィンゴ脂質とコレステロールに富んだ、直径20~100ナノメートル(nm、1nmは10億分の1メートル)の微小な脂質ドメインです(図1)。体内では、特定のタンパク質をこのドメインに集めることで、細胞を介した情報伝達、膜輸送、またウイルスや細菌の感染において重要な役割を果たしていると考えられています。しかし、脂質ラフトを標識するよい手段がないため、その実態はよく分かっていませんでした。
脂質ラフトの構造、動態、機能を明らかにするため、国際共同研究グループは脂質ラフトに特異的に結合するタンパク質を探索し、そのタンパク質を使って脂質ラフトを標識するという手法を試みました。
研究手法と成果
国際共同研究グループは、まず、動物細胞の主要なスフィンゴ脂質であるスフィンゴミエリンとコレステロールを用いて人工的な脂質ラフトを作製し、さまざまな細胞(キノコではマイタケ、エリンギ、シイタケ、マツタケ、ブナシメジ)の抽出液を用いて結合タンパク質をスクリーニングしました。その結果、マイタケ抽出液からアミノ酸202個からなる新しいタンパク質を発見しました。さまざまな生化学的、生物物理学的な実験から、このタンパク質がスフィンゴミエリンとコレステロールの複合体にのみ結合し、他の脂質、タンパク質とは結合しないことが明らかになりました。
スフィンゴミエリンとコレステロールの複合体は、脂質ラフトの基本構造だと考えられています。脂質ラフト(ラフトは筏(いかだ)の意味)に特異的に結合することから、国際共同研究グループは、このタンパク質を「ナカノリ(木曽の中乗り、筏乗りの意)」と名付けました。X線回折法[6]および核磁気共鳴(NMR)法[7]による構造解析の結果、ナカノリはアミノ酸配列の類似性のないイソギンチャク由来のスフィンゴミエリン結合毒素(スチコライシン)と同様の立体構造をとっていることが分かりました(図2)。しかしナカノリは、毒性に関わるアミノ末端に余分なアミノ酸が結合しているため、スチコライシンのような細胞毒性を示さないことも判明しました。
続いて、ナカノリを用いて動物細胞での脂質ラフトの分布、動態、機能の解析を行いました。その結果、情報伝達に関わる低分子量Gタンパク質[8]が活性に応じて脂質ラフトに存在すること、また細胞分裂や膜の変形に関わるホスファチジルイノシトール4,5-二リン酸が脂質ラフトに局在することなどが明らかになりました。さらに、コレステロールの先天性代謝異常であるC型ニーマンピック病[9]の患者皮膚細胞では、細胞表面の脂質ラフトの大きさ、動態が健常人の細胞とは異なっていることを見出しました。
また、インフルエンザウイルス、エイズウイルスなどは、脂質ラフトを感染の場としていると考えられています。国際共同研究グループは超解像顕微鏡を用いて、培養したMDCK細胞[10]からインフルエンザウイルスが出芽する様子を観察しました。その結果、ウイルスはナカノリで標識される脂質ラフトの縁から出芽してくることが明らかになりました(図3)。
また、高濃度のナカノリの存在下ではMDCK細胞のインフルエンザウイルス感染が抑えられることが分かりました。感染細胞にナカノリを加えるタイミングを変えて調べたところ、ナカノリはウイルス感染の後期、つまりウイルスの出芽の段階を阻害していることが示されました(図4)。
今後の期待
脂質ラフトは、さまざまな生物現象に重要な役割を果たしていると考えられますが、そのメカニズムはよく分かっていません。ナカノリを用いることで脂質ラフトの構造、動態、機能の理解がさらに進むものと考えられます。
ナカノリの脂質結合部位を特定するなど、さらに解析が進めば、より小分子量の抗ウイルス薬の設計につながると期待できます。脂質ラフトはインフルエンザばかりでなく、エイズウイルスやエボラウイルスの感染においても重要な役割を果たしていると考えられます。共同研究グループは今後、これらのウイルス感染にもナカノリが効果を示すのかなど、研究を進める予定です。
※国際共同研究グループ
理化学研究所
小林脂質生物学研究室
主任研究員(研究当時) 小林 俊秀(こばやし としひで)(現:フランス国立科学研究センター リサーチディレクター、佐甲細胞情報研究室 客員主管研究員)
特別研究員(研究当時) 牧野 麻美(まきの あさみ)(現:佐甲細胞情報研究室 協力研究員)
専任研究員(研究当時) 阿部 充宏(あべ みつひろ)(現:佐甲細胞情報研究室 専任研究員)
専任研究員(研究当時) 石塚 玲子(いしつか れいこ)
研究員(研究当時) 村手 源英(むらて もとひで)(現:佐甲細胞情報研究室 研究員)
基礎科学特別研究員研究員(研究当時)岸本 拓磨(きしもと たくま)(現:杏林大学 助教)
客員研究員 酒井 翔太(さかい しょうた)(現:北海道大学 助教)
協力研究員 嶋田 有紀子(しまだ ゆきこ)(現:LSIメディエンス)
基礎科学特別研究員 稲葉 岳彦(いなば たけひこ)(現:佐甲細胞情報研究室 協力研究員)
客員研究員 フランソワーズ・ユラン-マツダ(Francoise Hullin-Matsuda)(現:フランス国立衛生医学研究所 上級研究員)
専任研究員 ペーター・グライメル(Peter Greimel)(現:脳科学総合研究センター・細胞機能探索技術開発チーム 専任研究員)
佐甲細胞情報研究室
主任研究員 佐甲 靖志(さこう やすし)
協力研究員 チャンギ・ペク(Chan-Gi Pack)
伊藤ナノ医工学研究室
専任研究員 宮武 秀行(みやたけ ひでゆき)
分子ウイルス学特別研究ユニット
ユニットリーダー 間 陽子(あいだ ようこ)
協力研究員 萩原 恭二(はぎわら きょうじ)
大学院生 佐々木 裕(ささき ゆたか)
生命分子解析ユニット
堂前 直(どうまえ なおし)
生命システム研究センター 生体分子構造動態研究チーム
チームリーダー 木川 隆則(きがわ たかのり)
研究員 栃尾 尚哉(とちお なおや)
株式会社雪国まいたけ
研究推進役 西堀 耕三(にしぼり こうぞう)
研究員 倉橋 敦(くらはし あつし)
京都大学物質-細胞統合システム拠点(iCeMS)
教授 楠見 明弘(くすみ あきひろ)
助教 笠井 倫志(かさい りんし)
お茶の水女子大学 基幹研究院自然科学系
教授 小林 哲幸(こばやし てつゆき)
博士課程 田中 秀子(たなか ひでこ)
東京家政大学 環境教育学科
教授 藤森 文啓(ふじもり ふみひろ)
第一三共株式会社 生物医学研究所
副所長 山下 誠(やました まこと)
研究員 久保 淑(くぼ しゅく)
クイーンズランド大学(オーストラリア)
教授 ロバート・G・パートン(Robert G. Parton)
研究員 ニコル・L・シーバー(Nicole L. Schieber)
国立化学研究所(スロベニア)
所長 グレゴール・アンダールー(Gregor Anderluh)
原論文情報
- Makino A, Abe M, Ishitsuka R, Murate M, Kishimoto T, Sakai S, Hullin-Matsuda F, Shimada Y, Inaba T, Miyatake H, Tanaka H, Kurahashi A, Pack Chan-Gi, Kubo S, Schieber NL, Dohmae N, Tochio N, Hagiwara K, Sasaki Y, Aida Y, Fujimori F, Kigawa T, Nishibori K, Parton RG, Kusumi A, Sako Y, Anderluh G, Yamashita M, Kobayashi Te, Greimel P, Kobayashi To, "A novel sphingomyelin/cholesterol domain-specific probe reveals the dynamics of the membrane domains during virus release and in Niemann-Pick type C", The FASEB Journal, doi: 10.1096/fj.201500075R
発表者
理化学研究所
主任研究員研究室 小林脂質生物学研究室
主任研究員(研究当時) 小林 俊秀(こばやし としひで)
(現:フランス国立科学研究センター リサーチディレクター、佐甲細胞情報研究室 客員主管研究員)
特別研究員(研究当時) 牧野 麻美(まきの あさみ)
(現:佐甲細胞情報研究室 協力研究員)
専任研究員(研究当時) 阿部 充宏(あべ みつひろ)
(現:佐甲細胞情報研究室 専任研究員)
専任研究員(研究当時) 石塚 玲子(いしつか れいこ)
研究員(研究当時) 村手 源英(むらて もとひで)
(現:佐甲細胞情報研究室 研究員)
基礎科学特別研究員(研究当時) 岸本 拓磨 (きしもと たくま)
(現:杏林大学 助教)
 小林俊秀主任研究員(研究当時、右から2番目)と研究室メンバー
小林俊秀主任研究員(研究当時、右から2番目)と研究室メンバー
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.マイタケ
担子菌門トンビマイタケ科のキノコ。世界中の温帯に分布し、ブナ科樹木の大木の根株で年輪の中心部に寄生し、白色腐朽を引き起こる木材腐朽菌である。食用としては、旨みが強く、歯切れもよく、生食以外はほとんどの調理法でおいしく食べられる。 - 2.スフィンゴ脂質、スフィンゴミエリン
動物細胞における細胞膜の主要構成脂質。スフィンゴ脂質は糖脂質とスフィンゴミエリンに分類される。スフィンゴミエリンは生理活性脂質であるセラミドやスフィンゴシン1-リン酸の前駆体であるとともに、コレステロールとともに特徴的な脂質ドメイン脂質ラフトを形成する。脂質ラフトは情報伝達や膜輸送、ウイルス感染において重要な役割を果たしていることが示唆されている。 - 3.コレステロール
ステロイドの一種。細胞を構成する脂質成分として脳、神経、胆汁、血液など動物組織一般にみられる。 - 4.超解像顕微鏡
従来の光学顕微鏡が持つ回折限界を超えた分解能を発揮する光学的手法を指す。超解像度の蛍光顕微鏡の開発に関して2014年のノーベル化学賞が与えられている。 - 5.出芽
ウイルスの宿主細胞内での増殖は、吸着、侵入、脱穀、素材の剛税、放出の過程を経る。最後の放出の際に宿主の細胞膜や核膜を破って外に出ることを出芽と呼ぶ。 - 6.X線回折法
物質の結晶を作り、それにX線を照射して回折データを解析することにより、物質の内部構造を調べる方法。タンパク質の構造を原子レベルの分解能で詳細に解明するための最も有力な方法の1つである。 - 7.核磁気共鳴(NMR)法
原子の中には磁石としての性質を示すものがあり、分子に磁場をかけると共鳴を示すことがある。共鳴条件は原子の周囲の環境を鋭敏に反映することから、共鳴条件を解析することによって分子の構造や動きなどの情報を引き出すことができる。 - 8.Gタンパク質
受容体が受けた情報を細胞内に伝達する役割を果たすタンパク質の一種。通常は受容体に情報物質が結合するとその情報がGタンパク質に伝えられ、さらにGタンパク質がチャネルや酵素などの機能を制御するという経路になっている。 - 9.C型ニーマンピック病
遺伝性のコレステロール代謝障害。肝臓や脾臓への脂質蓄積による、腫大・発育障害・知能障害を生じる。ドイツの医師ニーマンとピックによって、20世紀前半に報告された。 - 10.MDCK細胞
イヌ腎臓尿細管上皮細胞由来の細胞株で、インフルエンザウイルスに非常にかかりやすいという特徴がある。
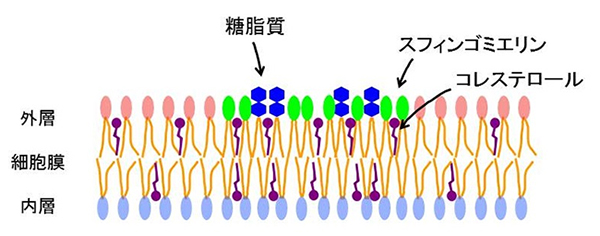
図1 脂質ラフトの模式図
細胞膜とその一部の微小領域である脂質ラフトを表した図。細胞膜はリン脂質で形成される脂質二重膜の形態をとる。外層のピンクや内層の水色の楕円は、リン脂質の親水性部分を示す。親水性部分につながっているオレンジ色線は、リン脂質の疎水性部分を示す。図の中央部分に脂質ラフトを模式的に示す。脂質ラフトでは脂質二重層の外層にスフィンゴ脂質である糖脂質(青の六角形)とスフィンゴミエリン(黄緑色の楕円)が濃縮されている。また脂質ラフトはコレステロールに富んでいる。
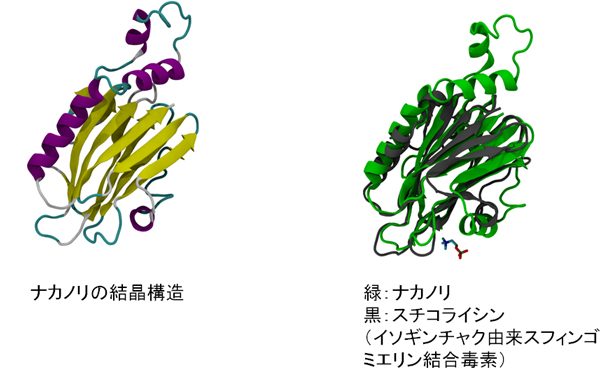
図2 ナカノリとスチコライシンの結晶構造
左は、ナカノリの立体構造。右は、ナカノリの立体構造(緑)とイソギンチャク由来スフィンゴミエリン結合毒素のスチコライシン(黒)の立体構造を重ね合わせた画像。ナカノリとスチコライシンのアミノ酸配列に類似性はないにも関わらず、同様の立体構造をしていることが分かる。ナカノリには毒性に関わるアミノ末端に余分なアミノ酸が結合しているため、細胞毒性を示さない。
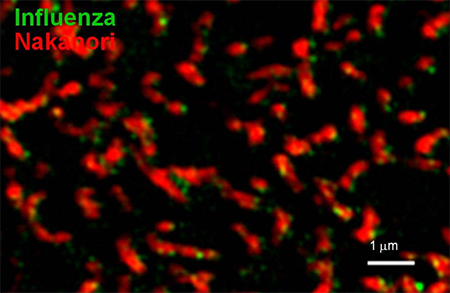
図3 インフルエンザウイルスの出芽
インフルエンザウイルスに感染したMDCK細胞からウイルス(緑)が出芽する様子を捕えた超解像顕微鏡画像。赤は、ナカノリで標識した脂質ラフト。出芽は、ウイルスの宿主細胞内での増殖過程の最後の段階である。
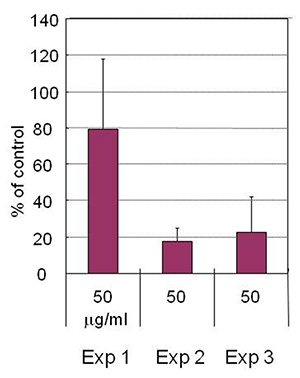
図4 ナカノリのインフルエンザウイルス感染の阻害
インフルエンザウイルス感染細胞に、50μg/mlの濃度のナカノリを時期をずらして加えた場合のウイルス増殖率を示した。Exp 1は感染初期にのみナカノリが共存した場合、Exp 2は感染後期にのみナカノリが共存した場合、Exp 3は感染全期間中にナカノリが共存した場合である。それぞれの増殖率は、コントロールに比べ80%、20%弱、20%強であった。Exp2が最も増殖率が低かったことから、感染後期の出芽の段階をナカノリが阻害していることを示している。
