要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センター分子標的化学研究チームの落合秀紀基礎科学特別研究員、植竹裕太特別研究員、丹羽節副チームリーダー、細谷孝充チームリーダーの研究チームは、カルボン酸に含まれるカルボキシ基[1](-COOH、-C(=O)OH)をホウ素(B)[2]に置換することで、入手が容易なカルボン酸を材料に新しい分子を簡便に合成する手法を開発しました。
カルボン酸は、カルボキシ基を持つ一連の有機化合物の総称です。カルボキシ基は、アミノ酸や脂肪酸などの生体分子をはじめ、さまざまな機能性分子に含まれる基本的な化学構造です。現在市販されている医薬品や農薬などの多くに、カルボン酸が用いられています。これらのカルボン酸のカルボキシ基を別の官能基に置換できれば、既存のカルボン酸を材料に生命科学研究や創薬研究に有用な新しい分子を簡便に合成できると考えられます。しかしカルボキシ基は強固な炭素-炭素結合[3]によってカルボン酸に組み込まれているため、その結合を切断するのは容易ではありません。既存の方法で結合を切断するには150℃以上の高温が必要となり、熱による副反応の影響で目的の分子が十分に得られず、適用できるカルボン酸が限られるといった課題がありました。
今回、研究チームはカルボン酸の自在変換を目指し、カルボキシ基を多彩な反応性を持つことで知られるホウ素に置換することを着想しました。カルボキシ基を直接ホウ素に置換する反応はまだ報告されていませんが、カルボン酸と硫黄(S)を含む分子を反応させて、チオエステル[4]を合成することは容易です。そこで、カルボン酸から変換したチオエステルの炭素-炭素結合を80℃という比較的温和な条件で切断する反応を開発し、この反応を用いることで、段階的にカルボキシ基をホウ素に置換することに成功しました。この手法により、市販されている複数の医薬品のカルボキシ基をホウ素に置換できることも実証しました。
今回開発した手法は、有機合成化学の基本的な技術として、創薬や生命科学、材料科学分野などにおける研究での活用が期待できます。
本研究成果は、ドイツの科学雑誌『Angewandte Chemie International Edition』への掲載に先立ち、オンライン版(1月26日付け:日本時間1月26日)に掲載されました。
本研究は、日本学術振興会 科学研究費補助金 基盤研究C「不活性結合切断反応を鍵とする分子リノベーション技術によるPETプローブ迅速合成」の支援を受けて行われました。
背景
カルボン酸は、カルボキシ基(-COOH、-C(=O)OH)を持つ有機化合物の総称です。カルボキシ基は最も基本的な化学構造の一つであり、私達の身の回りにもさまざまなカルボン酸が存在しています(図1)。例えば生体内には、アミノ酸や脂肪酸のようにカルボキシ基を持つ分子が多数存在します。また、鎮痛剤のアセチルサリチル酸(アスピリン)や高脂血症治療薬のスタチン類など、カルボキシ基を持つ医薬品も数多く利用されています。さらに、プラスチックや接着剤などの原料にもカルボン酸は多用されており、さまざまな化学構造を持つカルボン酸が市販されています。このように入手が容易なさまざまなカルボン酸を新たな分子の材料として利用できれば、新薬などの開発に幅広く応用できると考えられます。
カルボキシ基を他の官能基に置換する化学反応は二酸化炭素(CO2)の発生を伴うことから、「脱炭酸反応[5]」と呼ばれています。しかし、カルボキシ基は強固な炭素-炭素結合でカルボン酸に組み込まれており、その切断は容易ではありません。従来の脱炭酸反応の報告例では、金属触媒を用いることで炭素-炭素結合の切断に成功しています。ただし、反応を進めるためには150℃以上の高温で熱する必要があり、このような厳しい条件下では副反応が起こるため、目的の分子を十分に得ることができず、適用できるカルボン酸が限られるなどの課題があります。そのため、カルボキシ基を自在に変換するための適用範囲の広い化学反応の開発が求められていました。
研究手法と成果
研究チームは、カルボキシ基の自在変換法の開発にあたり、カルボキシ基をホウ素(B)に置換する反応の開発を着想しました(図2)。ホウ素を持つ分子は多彩な反応性を示すことが知られているため、カルボン酸をホウ素化することでさまざまな化学構造に自在に変換できると考えられるためです注)。
まず、より低い温度でカルボキシ基の炭素-炭素結合の切断を行うために、従来の脱炭酸反応とは異なるアプローチとして、室温でも炭素-炭素結合の切断を起こす例が知られている脱カルボニル反応[6]に着目しました。この反応はカルボキシ基(-C(=O)OH)を除去できませんが、カルボニル基(-C(=O)-)には適用できます。そこで、カルボン酸にチオール(R-SH)を反応させることで、一旦チオエステルという硫黄(S)を含む分子に変換しました。これにより、カルボキシ基が硫黄を含むカルボニル基(-C(=O)S-)になります。このチオエステルに対し、ホウ素化試薬と共に、触媒として脱カルボニル反応によく利用されるロジウム錯体[7]を作用させる手法を試みました。
脱カルボニル反応では、除去されたカルボニル基に由来する一酸化炭素が、しばしば触媒の活性を失わせる触媒毒[8]として作用することが知られています。しかしチオエステルを用いる反応では、酢酸カリウムを添加すると、触媒のロジウム錯体がごくわずかな量でも、反応が進むことが分かりました。これは、酢酸カリウムが触媒の活性を保持する役割を果たし、発生した一酸化炭素(CO)によって触媒の活性は損なわれないためと推測されました。その結果、80℃という温和な条件において、最高収率[9]98%という極めて高い効率で、チオエステルをホウ素を持つ分子に変換することに成功しました(図3)。つまり、カルボン酸のチオエステルへの変換と、ロジウム錯体を用いた脱カルボニルホウ素化反応という二つの化学変換を経て、カルボン酸のカルボキシ基をホウ素に置換したことになります。
次に、今回開発したカルボキシ基をホウ素に置換する手法の応用性を実証するため、市販されているカルボキシ基を持ついくつかの医薬品を、ホウ素を持つ分子へ変換することを試みました。その結果、痛風・高尿酸血症治療薬である「プロベネシド」や「フェブキソスタット」、尋常性ざ瘡(ニキビ)の治療薬「アダパレン」、経口糖尿病薬「レパグリニド」を、チオエステルに変換した後、ロジウム触媒を用いた脱カルボニルホウ素化反応を行うことで、カルボキシ基がホウ素に置換した分子を、それぞれ良好な収率(78~86%)で合成できました(図4)。
注)2016年2月1日プレスリリース「薬剤分子の新たな化学変換法」
今後の期待
本手法を利用することで、入手が容易なさまざまなカルボン酸を材料に、簡便に多様な化学構造を持つ分子を合成できるようになります。したがって本手法は、有機合成化学の基本的な技術として、創薬や生命科学、材料科学分野などにおける研究での活用が期待できます。カルボキシ基から置換されたホウ素は多彩な官能基に変換できるため、例えば、医薬品を分子プローブ[10]などへと簡便に変換することが考えられます。
今後、研究チームは、今回の実証実験で用いたモデル分子(芳香族カルボン酸)以外のカルボン酸でも高い収率を実現するなど、本手法のさらなる高度化を進めていきます。新たな化学変換法の開発・活用により、生命現象の理解につながる有用な分子の合成を目指します。
原論文情報
- Hidenori Ochiai, Yuta Uetake, Takashi Niwa, Takamitsu Hosoya, "Rhodium-Catalyzed Decarbonylative Borylation of Aromatic Thioesters for Facile Diversification of Aromatic Carboxylic Acids", Angewandte Chemie International Edition, doi: 10.1002/anie.201611974
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 イメージング基盤・応用グループ 分子標的化学研究チーム
基礎科学特別研究員 落合 秀紀(おちあい ひでのり)
特別研究員 植竹 裕太(うえたけ ゆうた)
副チームリーダー 丹羽 節(にわ たかし)
チームリーダー 細谷 孝充(ほそや たかみつ)
 写真左から、細谷孝充チームリーダー、落合秀紀基礎科学特別研究員、植竹裕太特別研究員、丹羽節副チームリーダー
写真左から、細谷孝充チームリーダー、落合秀紀基礎科学特別研究員、植竹裕太特別研究員、丹羽節副チームリーダー
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.カルボキシ基
「-C(=O)OH」の構造を持つ原子団(官能基)。慣例的に「-COOH」または「-CO2H」と書かれる。水素イオン(H+)を放出して安定な陰イオン(-C(=O)O-:カルボキシラート)になることができる、酸性の官能基である。アルコール(R-OH)やアミン(R-NH2)と脱水縮合することでエステル(R-C(=O)O-R)やアミド(R-C(=O)NH-R)など、さまざまな誘導体に変換できる。なお、以前は「カルボキシル基(carboxyl group)」とも呼ばれたが、IUPAC(国際純正・応用化学連合)が有機化合物の命名法について提唱した1993年の勧告以降、「カルボキシ基(carboxy group)」と呼ばれるようになった。 - 2.ホウ素(B)
周期表の第13族に属する原子番号5の元素。自然界ではホウ砂などの安定な無機化合物として存在しているが、ホウ素を含む有機化合物は多彩な反応をすることが知られている。2010年のノーベル化学賞を受賞した鈴木章博士(北海道大学名誉教授)が開発した「鈴木カップリング」は、ホウ素の反応性を利用した先駆的な例である。 - 3.炭素-炭素結合
二つの炭素原子同士で形成される共有結合。結合に関与する電子の数により、単結合、二重結合、三重結合のいずれかが形成される。カルボキシ基を分子につなぎとめる炭素-炭素結合は単結合だが、これは一般に極めて安定であり、反応性は低い。 - 4.チオエステル
エステル(R-C(=O)O-R)の一つの酸素原子(O)が硫黄原子(S)に置換した構造(R-C(=O)S-R)を持つ化合物の名称。カルボン酸(R-C(=O)OH)とチオール(R-SH)の脱水縮合などにより容易に合成できる。安定性が高く、空気中でも取扱いが容易であるが、金属触媒との反応性が比較的高く、多彩な反応性を示すことが知られている。 - 5.脱炭酸反応
進行に伴い二酸化炭素(CO2)を放出する化学反応。カルボキシ基(-COOH)を変換する際によく利用される。脱炭酸反応では炭素-炭素結合の切断を伴うため、一般に大きなエネルギーを必要とするが、 β-ケト酸(R-C(=O)CH2C(=O)OH)などの一部の分子は、容易に脱炭酸を起こすことが知られている。 - 6.脱カルボニル反応
進行に伴い一酸化炭素(CO)を放出する化学反応。カルボニル基(-C(=O)-)が除去されることから、この名称で呼ばれる。逆に、一酸化炭素を利用してカルボニル基を導入する反応をカルボニル化反応と呼ぶ。いずれの反応も、金属触媒を用いた例が多数報告されている。 - 7.ロジウム錯体
ロジウム(Rh)は原子番号45の元素で、遷移金属の一つ。また、金属原子を中心に、配位結合で複数の小分子(配位子)が集合して形成される一つの分子を金属錯体といい、中心金属がロジウムであれば、ロジウム錯体と呼ばれる。ロジウム錯体はさまざまな化学変換の触媒として利用される。工業的に酢酸を生産するプロセス(モンサント法)が代表例である。 - 8.触媒毒
ロジウム錯体のような金属錯体は、配位結合している小分子(配位子)によって触媒としての性能が大きく変わることがある。ある分子が金属錯体に配位することで、触媒活性を大きく損なう場合、この配位した分子を触媒毒と呼ぶことがある。 - 9.収率
化学合成実験を行った結果、実際に得られた化合物の量を収量と呼ぶ。これに対し、化学反応が完全に進んだと仮定して、反応式から計算された収量を理論収量と呼ぶ。現実の化学実験ではさまざまな理由により、収量は理論収量を下回る場合が多く、収量/理論収量の比である収率を求め、化学反応の効率の尺度とする。 - 10.分子プローブ
分子の生体内での振る舞いを明らかにするために、医薬品などの分子を化学変換し機能を付与したもの。蛍光部位を導入した蛍光プローブや光照射により化学反応性を示す光親和性プローブ、陽電子放射核種を持つPETプローブなど、さまざまな機能を持つ分子プローブが開発されている。
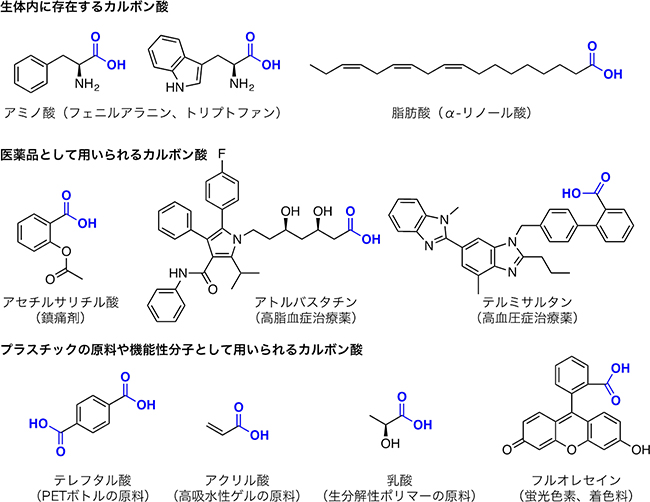
図1 身の回りにあるカルボン酸の例
カルボン酸は、カルボキシ基(-COOH、-C(=O)OH、青字)を持つ有機化合物の総称である。生体内、医薬品、プラスチックの原料や機能性材料など、さまざまなところにみられる基本的な化合物群の一つである。
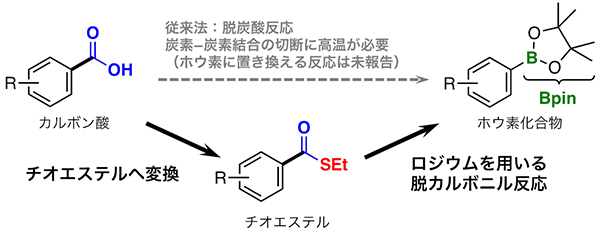
図2 カルボキシ基をホウ素に置換するために強固な炭素-炭素結合を切断する方法
カルボキシ基(-COOH)をホウ素(B)に置換する際に、カルボキシ基を分子につなぎとめている炭素-炭素結合(図中太線の結合)を切断する必要がある。従来は、高温加熱による脱炭酸反応によって切断していた。これに対し、カルボキシ基を一旦チオエステルに変換し、ロジウム(Rh)を用いる脱カルボニル反応を行うことで、より温和な条件で炭素-炭素結合を切断することが可能である。今回は後者の方法を採用し、基質一般性の高いホウ素化反応の開発を狙った。
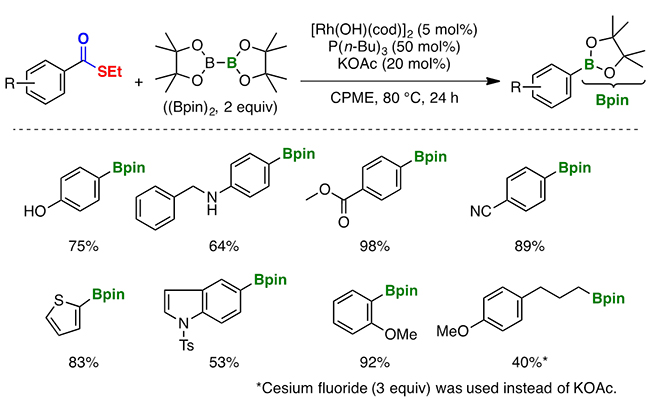
図3 チオエステルの脱カルボニル反応によるホウ素への置換例
今回開発した、チオエステルの脱カルボニル反応によるホウ素への置換反応を、図上の反応式に示した。トリブチルホスフィン(P(n-Bu)3)と酢酸カリウム(KOAc)に加え、ロジウム錯体([Rh(OH)(cod)]2)を触媒として用いることで、チオエステル部位(-COSEt)をホウ素(B)に置換している。反応には、二つのホウ素原子を持つ分子「ビス(ピナコラト)ジボロン、(Bpin)2」を用い、このうち一つのホウ素を含む構造(Bpin)が付加される。80℃で24時間反応させた。
図の点線から下に、代表的な成功例を示す。各数値(%)は収率を示す。さまざまな基質に適用でき、医薬品によくみられるチオフェン(下段左)やインドール(下段左から2番目)を持つ場合や、芳香環に直接接続していない脂肪族カルボン酸(下段右)のカルボキシ基であっても、ホウ素に置換することができる。
なお、脂肪族カルボン酸(下段右)への置換については、酢酸カリウム(KOAc)に替わりフッ化セシウムを用いている。
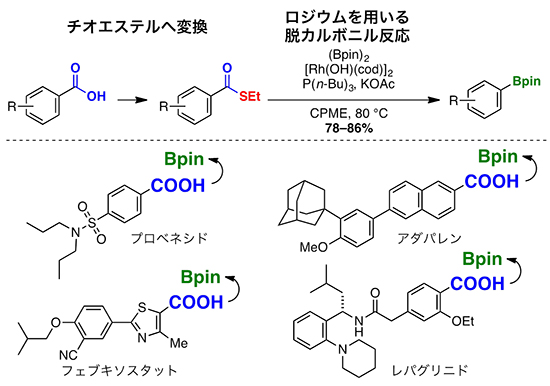
図4 医薬品のカルボキシ基をホウ素に置換した例
開発した手法を、カルボキシ基を持つ市販医薬品に適用し、ホウ素化合物の合成を試みた。図に示す四つの医薬品を、まずチオエステルに変換し、続いてロジウム触媒を用いる脱カルボニル反応を行うことで、各医薬品に対応するホウ素化合物を良好な収率で得ることができた。得られた分子に含まれるホウ素は多彩な反応性を示すことから、今回開発した手法により、医薬品の誘導体を簡便に合成できる。
