理化学研究所(理研)環境資源科学研究センター生体機能触媒研究チームの大岡英史基礎科学特別研究員と中村龍平チームリーダーの研究チームは、化学反応における触媒[1]活性を予測するための理論の拡張に成功しました。
本研究成果は、貴金属元素を使わずに高い活性を示す、新たな触媒材料の開発につながると期待できます。
これまでの触媒理論では、高い活性を持つ触媒を開発する上で、触媒と反応基質[2]の吸着エネルギー[3]を最適化することが重要であると考えられてきました。しかし、現実社会で役立つ触媒を開発するためにどうすればよいかは、平衡状態[4]に着目した従来理論では予測できませんでした。なぜなら、実際に触媒反応を起こすためには熱や電気などのエネルギーを与える必要があり、このことによって触媒は平衡状態でなくなるためです。
今回、研究チームは反応速度論[5]に基づき、エネルギーを与えた環境での触媒活性を予測する理論の構築を試みました。その結果、エネルギー投入量によって、高い活性を得るために最適な吸着エネルギーが大きく異なることを突き止めました。これは、従来理論では活性が低いとされてきた材料でも、現実社会では高い活性を示す可能性があることを意味します。したがって、本理論は、現在産業界で触媒として使われている白金(Pt)などの貴金属材料を、より豊富に存在する銅(Cu)やニッケル(Ni)などの元素で代替することにつながります。
本研究は、米国の科学雑誌『The Journal of Physical Chemistry Letters』オンライン版(10月18日付け:日本時間10月18日)に掲載されます。
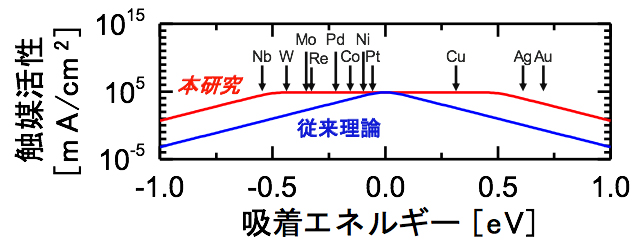
図 本研究による理論的進展
背景
現代の人類社会にとって、触媒は不可欠です。例えば、石油化学製品や化学肥料を合成する化学反応は、触媒によって促進されます。また、燃料電池[6]や水素製造、人工光合成など、次世代のクリーンエネルギー技術にも触媒は欠かせません。
優れた触媒の開発には、活性を予測する触媒理論が重要です。現在は、Paul Sabatierが1911年に提唱した「触媒と基質の結合の強さを表す吸着エネルギーは、大きすぎても小さすぎても良くない」というSabatier則[7]がその役割を担っています。この法則は、触媒と基質の吸着エネルギーが大きすぎると反応が起こりにくく、小さすぎると反応が終わった基質が触媒から離れないことに由来しています。したがって、その中間にある「ほど良い吸着の強さ」を持つ材料こそが優れた触媒だと考えられてきました。
現在では、この吸着エネルギーの最適値を計算化学で求め、そのような値を持つ材料を合成することが最も効率的な触媒探索と考えられています。そして、吸着エネルギーの最適値を求める際には、計算がしやすいという理由で平衡状態に近い条件で計算が行われてきました(図1、細い破線)。しかし、平衡状態では実質的に反応は起こらないため、実際に触媒が使われる環境とは大きく異なります。現実社会では、反応を促進するために熱や電気などのエネルギーを触媒に与えます。これにより初めて、活発な反応が起こるようになります(図1、太い破線)。ここで注意したいのは、与えるエネルギー量の大小で触媒活性が逆転するかもしれないということです。例えば、図1の触媒Aを使う場合には、少ないエネルギーで触媒反応が起こり始めますが、エネルギーを与えても反応速度はあまり大きくなりません。これに対し、触媒Bを使う場合は一度反応が起こり始めると、少しのエネルギーを与えるだけで急激に反応が速くなります。
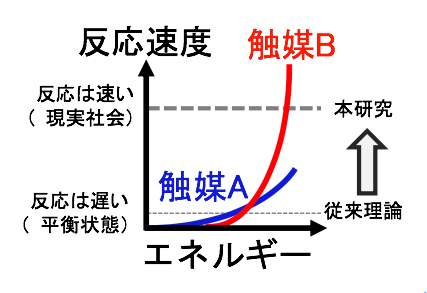
図1 本研究と従来理論の相違
従来理論ではエネルギー投入量が少なく、反応速度が遅い状態で触媒活性を評価してきた(細い破線)。しかし現実社会では、より多くのエネルギーが必要だとしても、反応が速く進む触媒が求められている(太い破線)。例えば、触媒A(青線)は少ないエネルギーで反応を起こすことができるため、従来理論では高く評価されてきた。しかし、この触媒はエネルギーを与えても反応速度が大きくならないため、実用には向かない。それよりも、現実社会では、エネルギーをたくさん与えたときに反応が速く進む触媒B(赤線)のような材料が必要とされている。本研究による理論では、触媒Bのような材料を実現するために必要な吸着エネルギーの条件を明らかにした。
現実社会に必要とされているのは、触媒Bのような高い反応速度が得られる材料です。しかし、従来理論ではエネルギーが少ない平衡状態しか考慮されてこなかったため、触媒Aしか設計できませんでした。より実用的な触媒Bを設計するためには、触媒がどれだけエネルギーに敏感に応答するかを考慮した上で、最適な吸着エネルギーの強さを求める必要があります。
研究手法と成果
研究チームはまず、吸着エネルギーに応じて触媒反応の速さがどのように変化するかを評価するために、反応速度論に基づく計算を行いました。そのモデル反応[8]として、水素酸化反応(H2→2H++2e-)を使いました。水素酸化反応は、燃料電池における水素の燃焼反応として注目されていることに加えて、反応そのものが2段階で単純なため、モデル反応に適しています(図2)。また、水の電気分解によって水素を作る水素発生反応(2H++2e-→H2)も反応機構が類似しているため、本研究で得られた結果は水素発生触媒にも応用可能です。
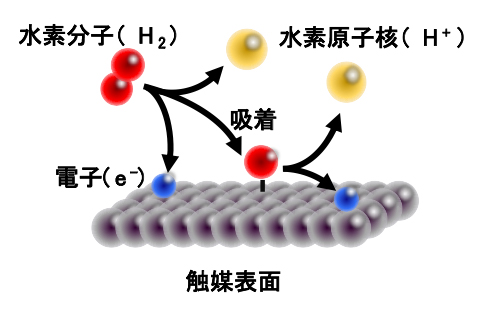
図2 本研究でモデルとして用いた水素酸化反応
まずは水素分子(H2)が分解し、触媒上に一つの水素原子(H)が吸着すると同時に、もう一つの水素原子は電子(e-)と水素原子核(H+)に分解される。第二段階の反応では、吸着した水素原子も水素原子核と電子に分解される。触媒と水素原子の吸着エネルギーにより、水素原子がどれだけ吸着しやすいかが変化し、これが触媒活性を大きく左右する。
反応速度論により、水素酸化反応の触媒活性(反応速度)を表す数式を導き出しました。得られた数式により、反応速度は吸着エネルギー、触媒に与えたエネルギー、そして反応の速度定数[9]から決まる値(K)の3変数から予測できます。Kは吸着水素原子が生成しやすいかどうかを表し、K>1の場合は生成しやすく、K<1の場合は生成しにくくなります。
導出した数式によって水素酸化反応の触媒活性を予測すると、図3のような吸着エネルギーと反応速度の関係性を表した図が得られました。この関係性は吸着水素原子のできやすさ(Kの値)によって変化しますが、どちらの場合もエネルギーを与えることによって、触媒活性が青い線(平衡状態)から赤い線(実際の反応環境)に向かって変化します。赤い線が青い線の上側にあるのは、エネルギーを与えることによって触媒が活性化し、反応が速くなるためです。ここで重要なのは、赤い線と青い線では頂点の場所が変わっていることです。この頂点は反応速度が最大になる点、つまり吸着エネルギーの最適値を表しています。したがってこれらの図は、平衡状態と実際の反応環境とでは、吸着エネルギーの最適値が異なることを示しています。
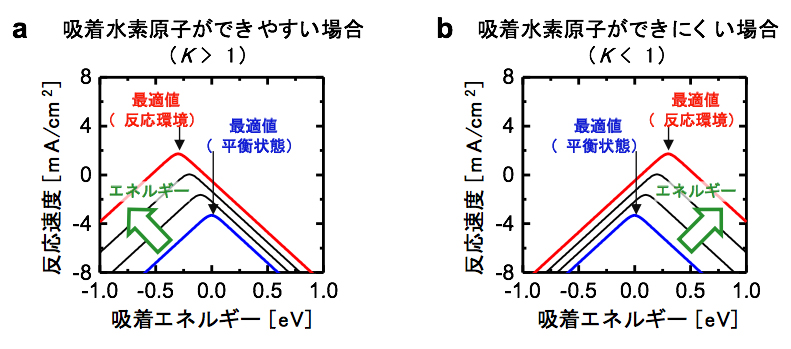
図3 本研究から予測される触媒活性の違い
aでは吸着水素原子が生成しやすい、bでは生成しにくい場合の平衡状態(青)と反応環境(赤)における触媒活性を示している。いずれの場合でも、触媒にエネルギーを与えることで、吸着エネルギーの最適値は平衡状態での値からずれる。なお、この図における反応環境とは、触媒に300mV程度の電圧をかけた場合に相当する。
このように、吸着水素原子のできやすさと吸着エネルギーの両方が触媒活性に重要なことが分かりました。そこで、吸着エネルギーだけでなく、吸着水素原子のできやすさも考慮できるように触媒活性を示しました(図4)。赤い領域ほど反応が速く、優れた触媒材料の領域に対応します。
図4aのように、触媒に与えたエネルギーが少ない場合には、図の中心部分しか高活性領域がありません。これは、平衡状態(図3の青い線)では吸着エネルギーがゼロeV(エレクトロン ボルト)[10]に近いほど活性が高いという従来理論の予測とも合致しています。現時点で、白金(Pt)よりもこの条件に適合する材料は見つかっていません。実際、与えるエネルギーが少ない状態では、Ptは水素酸化反応、水素発生反応の触媒として、人工材料の中で最も高い活性を示します。
しかし、触媒にエネルギーを与えると、図4bのように高活性領域が大きくなりました。このことにより、ニッケル(Ni)や銅(Cu)、タングステン(W)など、吸着エネルギーがPtから離れた材料でも、Ptと同等の高い反応速度が実現できる可能性があることが分かりました。これは、Ptのように地球上わずかにしか存在しない希少金属元素を、Ni、Cu、Wのような、より豊富に存在する元素で代替できる可能性を示しています。
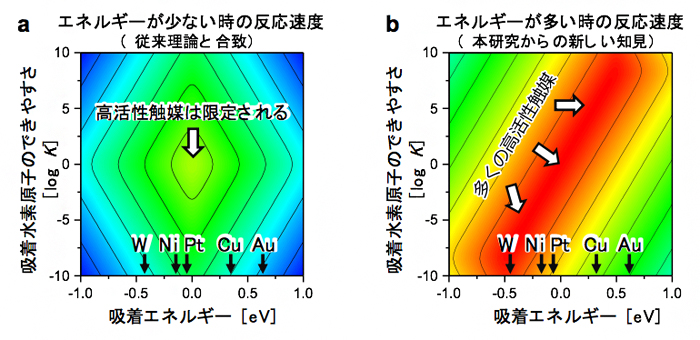
図4 本研究によって理論的に予測される触媒活性
反応が速い領域ほど暖色系で示してある。aは触媒に与えるエネルギーが少ない従来理論の条件(平衡状態)での反応速度を表し、bはより多くのエネルギー(500mVの電圧)を与えたときの反応速度を表す。エネルギーが多いbでは高活性領域が広がっており、Ni、Cu、WなどでもPtと並ぶ高い触媒活性が得られる可能性が示されている。
今後の期待
今回の理論的な予測は水素酸化反応をモデルにしていますが、それ以外にも触媒材料の効率化が期待されている反応がたくさんあります。したがって、本研究の理論を拡張し、より複雑な反応でも取り扱えるようにする必要があると考えられます。
同時に、優れた材料の予測だけでなく、そのような材料を開発することも重要です。そのことによって初めて、この研究で行われた理論的な予測の正しさを証明し、貴金属元素に依存しない、新たな触媒開発の指針を確立することが可能となります。特に、近年急速に加速している機械学習[11]による触媒探索も、Sabatier則から予測される平衡状態の活性をもとに材料の良し悪しを判定しています。したがって、本研究による触媒理論の拡張はデータ駆動型触媒探索の効率化にもつながる成果です。
本研究成果は、国際連合が設定した「持続可能な開発目標(SDGs)」のうち、目標7「エネルギーをみんなに そしてクリーンに」、目標12「つくる責任 つかう責任」、そして目標13「気候変動に具体的な対策を」に貢献する研究成果です。
補足説明
- 1.触媒
化学反応の前後で自身は変化しないが、継続的に反応を起こりやすくし続ける(反応速度を著しく大きくする)化学物質のこと。このような意味では、生物の体内にある酵素も触媒の一種と考えられる。 - 2.反応基質
反応が起こる前の化学物質を反応基質という。反応が起きると、基質は生成物に変換される。 - 3.吸着エネルギー
多くの触媒反応は、反応基質と触媒が一時的な結合を作ることで進行する。吸着エネルギーとは、このとき作られる結合の強さを表す数値である。吸着エネルギーが小さいほど結合は安定であり、大きいほど不安定となる。 - 4.平衡状態
触媒に与えるエネルギーが小さいと、反応は見かけ上起こらない。しかし、これは反応が全く起きていないわけではない。見かけ上何も起こらないのは、反応が起きているにもかかわらず、その逆反応も同じくらいの速さで起きているためである。このような、逆反応と釣り合いが取れた状態が平衡状態である。 - 5.反応速度論
化学反応がどれだけ速く起きるかを予測するための理論。反応が起きるかどうか、だけに着目する熱力学や平衡論よりも数式は複雑になるが、触媒活性についてより多くの知見を得られるという点において優れている。 - 6.燃料電池
水素と酸素を化学反応させて発電する装置。化学反応を効率的に起こすため、白金触媒が使われている。 - 7.Sabatier則
フランスのノーベル化学賞受賞者であるPaul Sabatierが、100年ほど前に見つけた法則。「触媒と基質の吸着エネルギーは、大きすぎても小さすぎても良くなく、最適値が存在する」とするもの。その提唱以降、さまざまな触媒反応でその正しさが実験によって証明されている。 - 8.モデル反応
数多くある反応の中でも、理論解析で取り上げるのに適した反応のこと。水素酸化反応は2段階で進むと考えられており、最も単純な触媒反応の一つである。このような単純な反応で起こりうる効果は、より複雑な反応でも起こる可能性があるため、単純なモデルを使う方がより広範囲の反応を扱うことにつながる。例えば、水素酸化反応で高活性領域が広がる(図4b)なら、その他の反応でも高活性領域の拡大が起きる可能性が高い。 - 9.速度定数
同じだけエネルギーを与えても、反応によって速さが異なる。この速さの違いを表す値が速度定数であり、触媒材料や反応環境によって変化する。本文中のKは、平衡状態における水素原子の吸着と脱着の速度定数の比を表している。 - 10.eV(エレクトロン ボルト)
エネルギーの単位の一つで、1eVは1.6x10-19Jに相当する。一つの分子の中の結合など、非常に小さなエネルギーを表す際に使われる単位である。 - 11.機械学習
人間の学習能力と同様に、機械(コンピュータ)に学習能力を持たせる手法。たくさんのデータを与えれば、機械が自動的に法則性を見つけ出すという特徴がある。
原論文情報
- Hideshi Ooka*, Ryuhei Nakamura, "Shift of the Optimum Binding Energy at Higher Rates of Catalysis", The Journal of Physical Chemistry Letters, 10.1021/acs.jpclett.9b01796
発表者
理化学研究所
環境資源科学研究センター 生体機能触媒研究チーム
チームリーダー 中村 龍平(なかむら りゅうへい)
基礎科学特別研究員 大岡 英史(おおおか ひでし)
 大岡 英史
大岡 英史
 中村 龍平
中村 龍平
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
