2019年10月28日
理化学研究所
日本医療研究開発機構
筑波大学
山陽小野田市立山口東京理科大学
福島県立医科大学
東京大学
硫化水素の産生過剰が統合失調症に影響
-創薬の新たな切り口として期待-
理化学研究所(理研)脳神経科学研究センター分子精神遺伝研究チームの井出政行客員研究員(筑波大学医学医療系講師)、大西哲生副チームリーダー、吉川武男チームリーダー、山陽小野田市立山口東京理科大学薬学部の木村英雄教授、福島県立医科大学医学部神経精神医学講座の國井泰人准教授、東京大学大学院医学系研究科の廣川信隆特任教授らの共同研究グループは、脳内の硫化水素の産生過剰が統合失調症[1]の病理に関係していることを発見しました。
本研究成果は、硫化水素というシグナル分子[2]を標的とした、統合失調症に対する新たな創薬の切り口になると期待できます。
今回、共同研究グループは、統合失調症に関係するマウス系統とそうではない系統で、網羅的なプロテオミクス解析[3]を行い、硫化水素産生酵素の一つであるMpstタンパク質の上昇の関与を見いだしました。また、ヒト由来の試料を用いた解析から、統合失調症での硫化水素の産生過剰を示すデータを得ました。特に、統合失調症患者の死後脳におけるMPSTタンパク質の高発現は、生前の臨床症状の重篤さに関連し、毛髪中のMPST遺伝子の発現量は感度の優れたバイオマーカーになる可能性が示されました。さらに、持続的な硫化水素の産生過剰が生じる原因は脳発達期の炎症・酸化ストレスに対する代償反応の一環である可能性、そのメカニズムとしてエピジェネティック変化[4]が根底にあることを明らかにしました。なお、硫化水素の産生過剰は、エネルギー代謝の減少、スパイン[5]密度の低下などを引き起こし、それらが統合失調症のリスクにつながることも示しました。
本研究は、ヨーロッパ分子生物学機構の科学誌『EMBO Molecular Medicine』のオンライン版(10月28日付け:日本時間10月28日)に掲載されます。
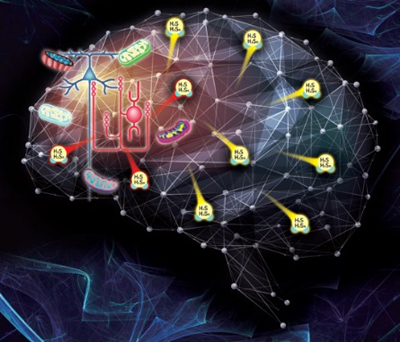
図 統合失調症の発症・経過における硫化水素産生過剰の関与
背景
統合失調症は、一般人口の約100人に1人の割合で発症する比較的頻度の高い精神疾患です。思春期に好発し、適切な治療や医療を受けないと生涯にわたって生活の質(QOL)が損なわれる可能性が高いという問題があります。
現在利用できる治療薬のほとんどは、神経伝達物質[6]の受容体をブロックするものですが、副作用に悩まされる患者も多く存在します。さらに、薬が効かない、いわゆる「治療抵抗性」の患者は3割に上るという報告もあります。このような状況にもかかわらず、新たな統合失調症治療薬の開発は充分に進んでいないのが現状です。大きな理由の一つに、統合失調症の新規治療薬をどのような原理に基づいて開発すればいいのかが分かっていないことがあります。この状況を打破するためには、より根本的な病態メカニズムの解明が必要です。
「硫化水素」が危険な毒ガスであることは300年ほど前から分かっていましたが、1990年前後に動物の脳に硫化水素が存在することが報告されました。その後、生体内のさまざまな組織で3種類の酵素(MPST、CBS、CTH)により、硫化水素が合成[7]されていることが報告されました。さらに、硫化水素が血管拡張作用や抗炎症・抗酸化作用など、生体にとって必須かつ有用な生理作用を担うことが報告されましたが、硫化水素の産生過剰がもたらす生物学的な影響についてはほとんど調べられてきませんでした。
研究手法と成果
統合失調症をはじめとした精神疾患では、一般的にプレパルス抑制(PPI)[8]という生理機能の低下がみられます。マウスでもヒトと同じようにPPIを測定でき、C3H/He(C3H)マウス系統ではPPIが不良、C57BL/6(B6)マウス系統ではPPIが良好です。
共同研究グループは、C3Hマウスを統合失調症に類似の形質を持つマウス、B6マウスを正常なマウスとして、両者の脳内のタンパク質を、プロテオミクス解析により網羅的に調べました。その結果、C3Hマウスの脳では、硫化水素の産生酵素の一つである「Mpstタンパク質」が多く発現していました(図1A)。Mpstにより産生された硫化水素や派生分子であるH2Sn(n=2, 3)は、タンパク質のシステイン残基にイオウを付加し、ポリサルファイド[9]を生成します(図1B)。実際にC3Hマウスの脳では、ポリサルファイドの量がB6マウスの脳に比較して多いことが判明しました(図1C)。
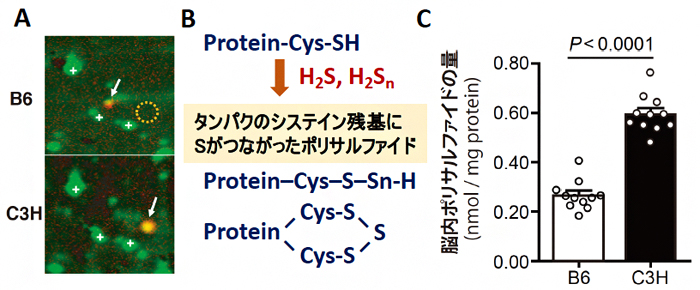
図1 B6マウスとC3Hマウスにおけるプロテオミクス解析の結果とイオウの動態
- A:白矢印は、硫化水素の産生酵素の一つであるMpstタンパク質をさす。統合失調症に類似した形質を持つC3Hマウスでは、B6マウスに比べてMpstタンパク質が多く発現していた。なおMpstタンパク質の位置が異なるのは、B6とC3HではMpstタンパク質の機能に影響を及ぼさないアミノ酸置換があるためである。B6で破線の○は、C3HでMpstが存在する場所にB6マウスでは存在していないことを示している。
- B:Mpstにより産生された硫化水素(H2S)や派生分子であるH2Snは、タンパク質のシステイン残基(Cys)にイオウ(S)を付加し、タンパク質のCysにSがつながったポリサルファイドを生成する。
- C:C3Hマウスでは、ポリサルファイドの量がB6マウスよりも多かった。
次に、Mpst遺伝子の発現量がPPIやイオウの蓄積に関係するかを調べました。まず、C3HマウスでMpst遺伝子の発現を欠損させたMpstノックアウトマウス(Mpst KO)と、B6マウスでMpst遺伝子の発現を上昇させたMpstトランスジェニックマウス(Mpst Tg)を作製しました。これらのマウスのPPIを調べると、C3H Mpst KOマウスではC3H野生型マウスよりPPIが上昇し(図2A)、B6 Mpst TgマウスではB6野生型マウスよりPPIが低下しました(図2B)。また、C3H Mpst KOマウスではC3H野生型マウスより脳内ポリサルファイドの量が減少しました(図2C)。これらにより、ポリサルファイドの過剰な蓄積はPPIの低下につながることが判明しました。
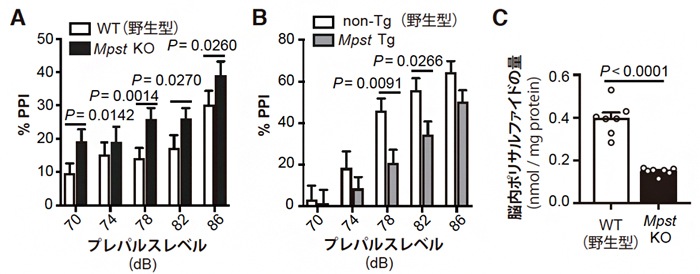
図2 Mpst遺伝子改変マウスでのプレパルス抑制(PPI)および脳内ポリサルファイドの量
- A:Mpst遺伝子を欠損させたC3H Mpst KOマウスでは、C3H野生型マウスよりPPIが上昇した。
- B:Mpst遺伝子の発現を上昇させたB6 Mpst Tgマウスでは、B6野生型マウスよりもPPIが低下した。
- C:C3H Mpst KOマウスでは、C3H野生型マウスよりも脳内ポリサルファイドの量が減少した。
次に、ヒト統合失調症でイオウ代謝がどのようになっているかを検討するために、種々のヒト由来試料を調べました。統合失調症患者の死後脳では、硫化水素産生酵素の遺伝子であるMPST遺伝子とCBS遺伝子の発現が健常者に比較して上昇しており(図3A, B)、MPSTタンパク量も上昇していました(図3C)。また、MPSTタンパク質の発現レベルが高いほど、生前の臨床症状が重症でした(図3D)。iPS細胞[10]から分化させた神経幹細胞の塊であるニューロスフェア[11]では、統合失調症患者由来のサンプルでCBS遺伝子の発現が上昇していました(図3E,F)。これらの結果から、ヒト統合失調症(の一部)では硫化水素の産生が亢進していることが示されました。そしてこの状態を、共同研究グループは「サルファイドストレス(イオウストレス)」と命名しました。
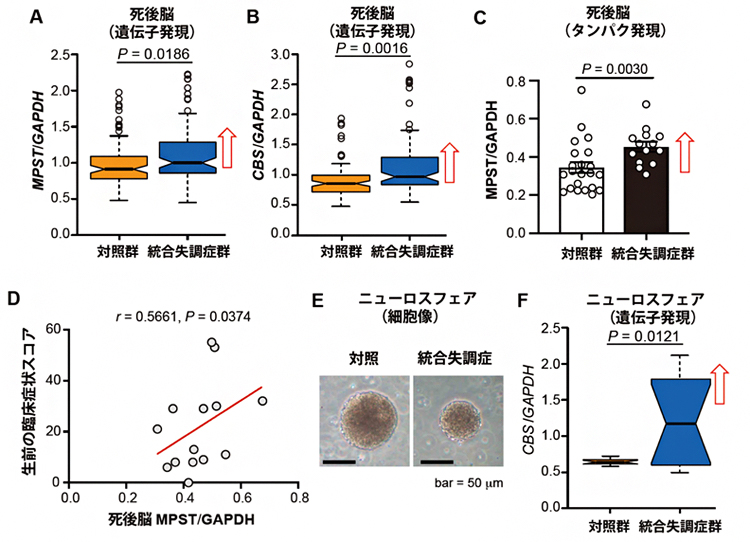
図3 ヒト由来の統合失調症試料でのイオウ代謝動態
- A:統合失調症患者の死後脳では、MPST遺伝子の発現が健常者より上昇していた。
- B:統合失調症患者の死後脳では、CBS遺伝子の発現が健常者より上昇していた。
- C:A、Bとは別の統合失調症患者の死後脳では、MPSTタンパク量が健常者より上昇していた。
- D:MPSTタンパク質の発現レベルが高いほど、生前の臨床症状が重症であった。
- E:iPS細胞から分化させたニューロスフェアの顕微鏡写真。
- F:Eの統合失調症患者由来のニューロスフェアでは、CBS遺伝子の発現が上昇していた。
統合失調症は臨床症状から診断をつけていますが、その根本的原因については個々の患者で様態が異なると考えられているため、サルファイドストレスにある統合失調症の一群を調べられるバイオマーカーの可能性を追求しました。図4Aのように、MPSTタンパク質とメッセンジャーRNA(mRNA)は脳だけでなく、頭髪の毛包細胞でも発現しており、図4Bのように、毛包細胞でのMPST遺伝子のmRNAの発現量は統合失調症群で上昇していました。この上昇を指標にROC曲線解析[12]をしたところ、感度[13]73.6%、特異度[13]47.2%で統合失調症群と診断できました(図4C)。よって、毛包細胞におけるMPST遺伝子の発現量は、サルファイドストレスにある統合失調症を同定するのに役立つ可能性があることが分かりました。
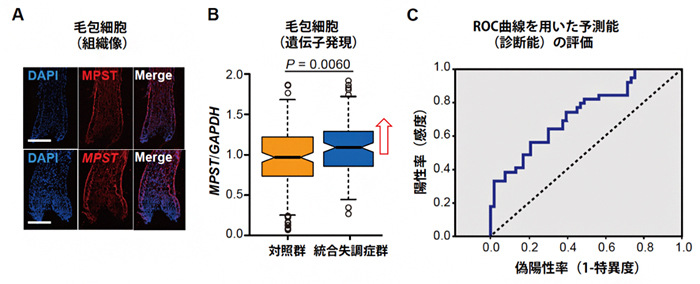
図4 頭髪の毛包細胞でのMPSTタンパク質/MPST遺伝子発現とバイオマーカーの可能性
- A:上段は統合失調症でのMPSTタンパク質の発現画像。DAPIは核染色を示す。MergeはDAPIとMPSTタンパク質合体画像。下段はMPSTのmRNAの発現画像。
- B:毛包細胞において、MPST遺伝子のmRNA発現量は統合失調症で上昇していた。
- C:ROC曲線を用いたバイオマーカーとしての性能評価。
次に、脳で硫化水素の産生が過剰になった場合に、どのような影響があるのかを調べました。Mpst遺伝子の発現を上昇させたMpst Tgマウスの脳において、網羅的な遺伝子発現を解析したところ、解糖系[14]とクエン酸回路[15](TCA回路)というエネルギー産生回路にある、複数の酵素遺伝子の発現量が低下していました。また、エネルギーを生み出すミトコンドリア内の酵素コンプレックスIV(チトクロムcオキシダーゼ)[16]の活性も低下していました。
これらの結果として、Mpst Tgマウスでは、エネルギー分子であるATP[17]の脳内濃度が低下していました。また、脳内で持続的に高頻度に発火し最もエネルギーを消費していると考えられているパルブアルブミン陽性GABA含有抑制性神経細胞[18]について、そのマーカーであるパルブアルブミン[19]遺伝子の発現低下も観察されました。パルブアルブミン遺伝子の発現低下は、これまでの統合失調症に関する研究でたびたび報告されてきた所見と一致します。
統合失調症では海馬の異常も報告されていること、およびPPI機能には海馬も関係することから、Mpst Tgマウスの胎児脳から取り出した海馬初代神経培養細胞[20]のスパインの密度を調べてみました。その結果、Mpst Tgマウスではスパイン密度の低下が観察されましたが(図5A,B)、これも統合失調症に関連した脳機能の変化であると考えられます。
以上のような、硫化水素がエネルギー産生系やシナプスに与える分子メカニズムの詳細は現段階では不明ですが、可能性の一つとして、イオウが関連タンパク質のシステイン残基に付加されて(図1B)、タンパク質の機能が変化すること(サルファイドストレス)が考えられます。
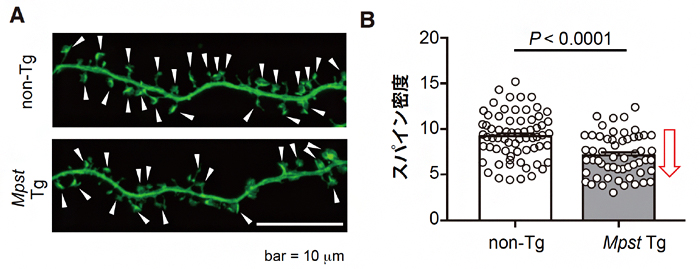
図5 海馬初代神経培養細胞におけるスパインの画像と密度
- A:上はB6 non-Tgマウス、下はB6 Mpst Tgマウスの胎児脳から取り出した海馬初代神経培養細胞のスパイン画像。左右に走行する太い樹状突起から伸びる個々のスパインを白い矢頭で示してある。下画像のスパインは上画像よりも密度が低いことが分かる。
- B:実際に両者のスパイン密度(単位距離あたりのスパインの数)を比較したところ、Mpst Tgマウスでは野生型よりも密度が低下していた。
最後に、硫化水素産生系が亢進する原因について調べました。マウスでは、B6系統に比較してC3H系統でMpst遺伝子の発現が上昇していましたが、C3HのゲノムDNAでは、Mpst遺伝子領域のエピジェネティック変化の一つであるDNAメチル化が亢進しており、メチル化レベルと遺伝子発現量には相関がありました。また、ヒト統合失調症患者の死後脳では、健常者と比較してCBS遺伝子の発現が上昇していましたが、統合失調症患者のゲノムDNAでは、健常者と比較してCBS遺伝子領域のDNAメチル化がやはり増加しており、メチル化レベルと遺伝子発現量には相関がありました。
このようにエピジェネティック変化が認められるということは、硫化水素産生系の亢進の原因が脳の発達期に生じた可能性を示しています。硫化水素は抗酸化能を持つことから、脳の発達期に酸化・炎症ストレスを与えた統合失調症のモデルマウスである「poly I:C投与マウス[21]」を解析しました。その結果、poly I:C投与母マウスから生まれた仔マウスが成体になった時点の脳では、さまざまな抗酸化遺伝子の発現量が上昇しており、かつそれらの発現量は硫化水素産生酵素の遺伝子の発現量と相関していました。このような相関は、ヒト死後脳でも観察されました。
以上のことから、脳の発達期(ヒトの場合は胎児期~周産期)に、産科合併症や母体のウイルス感染などにより脳に微細な侵襲(酸化・炎症ストレスを引き起こす)を受けた場合、酸化・炎症ストレスへの代償反応の一環として、典型的な抗酸化遺伝子とともに硫化水素産生酵素の遺伝子の発現亢進がプログラムされると考えられます(図6)。
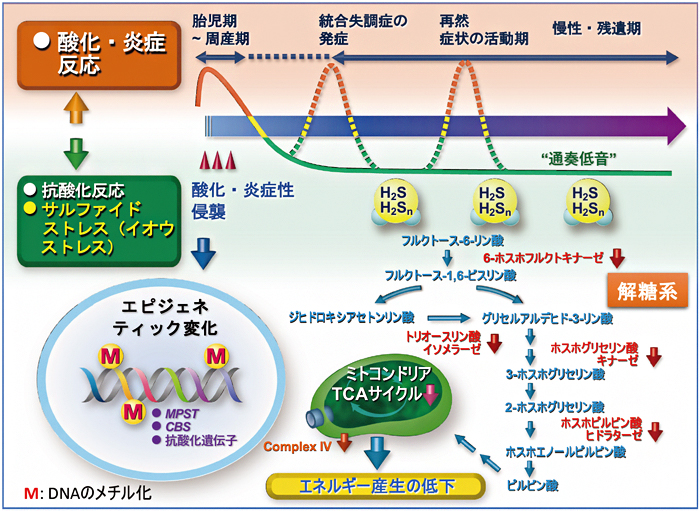
図6 統合失調症の発症・経過とサルファイドストレス(イオウストレス)の関与
脳の発達期(胎児期~周産期)に、微細な侵襲(酸化・炎症性ストレスを引き起こす)を受けると、脳では逆の代償的な抗酸化反応(還元反応)が生じ、還元反応の一環として硫化水素(抗酸化作用を持つ)やその派生分子であるH2Snの産生が亢進し、その亢進はゲノムDNAのエピジェネティック変化によって"通奏低音"のように生涯持続すると思われる(サルファイドストレスあるいはイオウストレス)。これに対して、酸化炎症反応は、脳の発達期以外では統合失調症の発症期、症状の活動期など、病相依存的なものである可能性がある。サルファイドストレスは、硫化水素の産生過剰を通して種々のタンパク質にイオウを付加するなどして、特に解糖系やミトコンドリアのTCAサイクル[15]およびコンプレックスIV(シトクロムcオキシダーゼ)に影響を与え、脳のエネルギー産生の低下を引き起こす。
今後の期待
今回の研究は、「統合失調症の神経発達障害仮説[22]」として知られていた従来の概念に関して、根本的に関与する分子や生体反応の一つを明らかにしたといえます。また、精神疾患の病態は神経と神経のつながり(神経回路)、電気信号の伝達の問題(シナプス、ミエリンによる軸索の絶縁状態)などいろいろな階層レベルで考えられていまますが、今回の研究結果から、より根底にあるエネルギー関連の問題を、硫化水素を通して提示したといえます。今回の研究結果は、これまでの研究に対するニつのアンチテーゼを含みます。まず、精神疾患に関するこれまでの研究では炎症反応に重点が置かれていたのに対し、今回の研究結果は、その反対の生体反応である還元反応(硫化水素産生の亢進を含む)が疾患にとってより重要である可能性を示しました。次に、これまでの研究では硫化水素による必須かつ有用な生理作用に重点が置かれてきたのに対し、今回の研究ではその産生が過剰になった場合の脳への影響が明らかになりました。
今回の研究結果から、硫化水素産生酵素の阻害剤を開発すれば、一部の統合失調症の症状改善に有効となる可能性が考えられます。また、今回サルファイドストレスと命名した現象のメカニズムをより詳細に探求していくことによって、さらなる新たな創薬の切り口が見えてくる可能性が期待できます。
補足説明
- 1.統合失調症
代表的な精神疾患であり、人口の約1%という比較的高い生涯発症率を持つ。多くは思春期から壮年期の間に発症し、幻覚や妄想に代表される「陽性症状」、感情の平板化、うつ様症状に代表される「陰性症状」、および「認知機能の低下」を伴う。ドーパミンと呼ばれる神経伝達物質の作用を抑える薬剤の投与が治療の中心となるが、その治療効果は不十分であったり、再燃を繰り返すうちに次第に重篤化したりすることも多い。そのため、発症メカニズムの理解、それに基づく根本的な治療法や予防法の開発が長く望まれている。 - 2.シグナル分子
生体の反応は、細胞間あるいは細胞内の情報の伝達を助けるいろいろな分子の存在に支えられている。例えばホルモンや成長因子、アミノ酸関連物質を中心とする神経伝達物質といったものに加えて、cAMP(環状アデノシン一リン酸)、ジアシルグリセロールなどさまざまな物質がそれに相当する。加えて、最近では硫化水素、一酸化窒素、一酸化炭素といったガス分子が生体内の酵素の働きにより作り出され、シグナル分子として働くことが明らかになってきた。 - 3.プロテオミクス解析
ある生物や細胞が持つさまざまなタンパク質の機能や量などを網羅的に解析する手法。一般的には、タンパク質を分離する電気泳動法と、タンパク質を同定するための質量分析法を組み合わせる手法が取られている。 - 4.エピジェネティック変化
DNAの塩基配列の変化を伴わない遺伝子の分子修飾のことを指す。この変化が起こることにより、遺伝子の発現量が変化することが知られている。DNAのシトシン塩基のメチル化は、エピジェネティック変化の一つである。 - 5.スパイン
神経細胞の樹状突起から多数出ている小突起構造であり、そこに入力する別の神経線維の末端がシナプスと呼ばれる構造を介して結合し、神経伝達物質による神経入力を受ける。 - 6.神経伝達物質
シナプス(神経細胞間などに形成される神経活動を伝える接合部位)で情報伝達を介在する物質。セロトニンやドーパミンは代表的な神経伝達物質である。 - 7.硫化水素の合成
生体では、下の図のように、MPST、CBS、CTHという3種類の合成酵素(矢印で示してある)によって硫化水素が産生されている。ただ、第4の硫化水素合成酵素といえるSelenium-binding protein 1(SELENBP1)が2018年に報告された。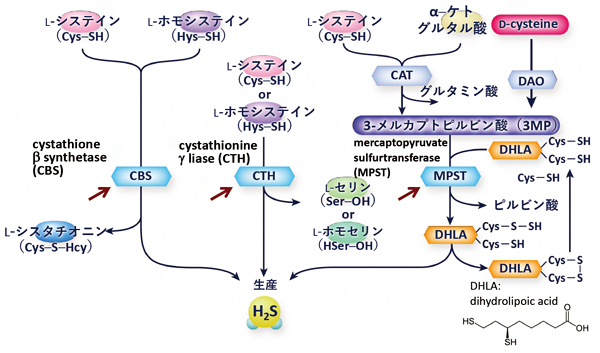
- 8.プレパルス抑制(PPI)
ヒトでも動物でも大きな音刺激を与えると驚愕反射が起こるが、大きな音刺激(パルス)の直前(例えば0.1秒直前)に小さな音刺激(プレパルス)(それ自身では驚愕反射を引き起こさない程度の小さな音)を与えると、その後の大きな音に対する驚愕反射が抑制される。この現象をPPIという。マウスでは、音刺激を与えた際の体動(筋反射)の大きさを測定して、PPIの値を算出する。PPIが良好なほど、感覚フィルター機能がしっかりしていると言える。統合失調症やその家族の一部では、PPIが低下しており、このためPPIの低下は、統合失調症のなりやすさに関係があると考えられている。ちなみに、精神疾患に関連のある生物学的、生理学的な特徴は中間表現型と呼ばれ、PPIの低下は統合失調症の中間表現型の一つと考えられている。PPIはprepulse inhibitionの略。 - 9.ポリサルファイド
化学式でR-Sn-R(nは2以上の整数)と表せる有機多硫化物の総称。生体においては、タンパク質に含まれるシステインと呼ばれるアミノ酸が、様々な多硫化構造を取ることが知られている。 - 10.iPS細胞
個体から採取した皮膚、血液などに含まれる分化した細胞を、人為的に受精卵のような未分化の状態にしたもの。京都大学の山中博士らのグループによって作製法が考案された。iPS細胞は、培養条件を調整することで、脳を構成する細胞など目的の細胞に分化させることができる。 - 11.ニューロスフェア
神経幹/前駆細胞の増殖因子であるEGFとbFGFを含む無血清培地中でiPS細胞を浮遊培養することで産生できる細胞塊。この方法によって、未分化能を維持したまま神経幹/前駆細胞を選択的に増殖させることができる。 - 12.ROC解析
ある特定の診断法の有用性を統計的に解析する手法の一つであり、診断バイオマーカーの適切なカットオフ値を決定することができる。ROCは、Receiver Operating Characteristicの略で、受信者動作特性と訳される。 - 13.感度、特異度
疾患診断バイオマーカーにおける「感度」とは、設定した判別しきい値(カットオフ値)により疾患群を疾患であると正しく判定できる割合をいう。例えば、患者100名に、あるカットオフ値を適用し75人が正しく陽性、25人が間違って陰性であると判定された場合、感度は0.75となる。一方、疾患診断バイオマーカーにおける「特異度」とは、設定した判別しきい値(カットオフ値)を非疾患群に適応した場合、正しく陰性であると判定できる割合をいう。「1-特異度」の値が偽陽性率(本来は非疾患なのに疾患と誤って判定される割合)となる。 - 14.解糖系
狭義には、最も基本的なエネルギー源であるグルコース(ブドウ糖)を数段階の酵素反応によりピルビン酸を作り出すまでの生化学経路のことを指す。ピルビン酸は、さらにアセチルCoAと呼ばれる物質に代謝されクエン酸回路に入る。 - 15.クエン酸回路
トリカルボン酸(TCA)回路などともいわれ、糖質や脂肪酸の代謝によって作り出したアセチルCoAと呼ばれる物質から、生体エネルギー物質であるATPの産生に必要とされるNADH(ニコチンアミドアデノシンジヌクレオチド)などを産生・供給する。 - 16.コンプレックスIV(チトクロムcオキシダーゼ)
ATP産生に必要とされる酵素であり、ミトコンドリア内膜に存在するさまざまなタンパク質から構成される呼吸鎖(あるいは電子伝達系)の一部を占める巨大タンパク質複合体である。毒ガスとしての硫化水素の作用は、この酵素の阻害によるものであると説明されている。 - 17.ATP
アデノシン三リン酸。主に細胞内小器官のミトコンドリアで生成される生体物質で、「生体のエネルギー通貨」とも呼ばれる。ATPは細胞活動のさまざまな局面でエネルギー物質として利用され、生命活動を支えている。 - 18.GABA含有抑制性神経細胞
GABA(ガンマアミノ酪酸)と呼ばれるアミノ酸類似物質を神経伝達物質として持つ神経細胞の一群であり、放出先の神経細胞の発火を抑制する働きをする。 - 19.パルブアルブミン
GABA含有抑制性神経細胞の中でも、パルブアルブミンと呼ばれる特別なタンパク質を作っている細胞群。統合失調症とパルブアルブミン含有抑制性神経細胞の障害の関連は数多く報告されている。 - 20.海馬初代神経培養細胞
生きているマウスなどの実験動物の脳から海馬を取り出し、そこに含まれる神経細胞を体外で培養したもの。脳内に存在しているときのさまざまな特徴を保持していると考えられている。 - 21.poly I:C投与マウス
poly I:C(polyinosinic:polycytidylic acid)は人工的に合成した核酸の一種で、動物にこの化合物を投与することで、ウイルス感染時に惹起される炎症反応を模倣できる。妊娠母マウス(胎児の脳発達期)に投与することで、仔マウスから統合失調症のモデルマウスを作製できる。 - 22.神経発達障害仮説
「脳発達期の微細な障害が統合失調症を引き起こす基盤となる」という有力な病因仮説の一つ。疫学調査やマウスを用いた実験により支持されているものの、実際ヒトの脳でどのようなことが起こっているのか、その分子メカニズムはよく分かっていない。
共同研究グループ
理化学研究所 脳神経科学研究センター
分子精神遺伝研究チーム
チームリーダー 吉川 武男(よしかわ たけお)
副チームリーダー 大西 哲生(おおにし てつお)
研究員 豊島 学(とよしま まなぶ)
研究員 シャビーシュ・バラン(Shabeesh Balan)
CDP研究員 前川 素子(まえかわ もとこ)
基礎科学特別研究員 島本(光山) 知英(しまもと・みつやま ちえ)
客員研究員 井出 政行(いで まさゆき)
(筑波大学 医学医療系 講師)
客員研究員 豊田 倫子(とよた ともこ)
テクニカルスタッフⅠ 大羽 尚子(おおば ひさこ)
テクニカルスタッフⅡ 渡邉 明子(わたべ あきこ)
テクニカルスタッフⅠ 久野 泰子(ひさの やすこ)
テクニカルスタッフ 野崎 弥生(のざき やよい)
大学院生リサーチ・アソシエイト 原 伯徳(はら とものり)
大学院生リサーチ・アソシエイト 和田 唯奈(わだ ゆいな)
生体物質分析ユニット
専門技術員 岩山 佳美(いわやま よしみ)
精神疾患動態研究チーム
チームリーダー 加藤 忠史(かとう ただふみ)
時空間認知神経生理学研究チーム
チームリーダー 藤澤 茂義(ふじさわ しげよし)
株式会社MCBI
業務執行役員 目野 浩二(めの こうじ)
研究員 石井 俊(いしい たかし)
山陽小野田市立山口東京理科大学 薬学部 薬学科
教授 木村 英雄(きむら ひでお)
准教授 澁谷 典広(しぶや のりひろ)
客員研究員 木村 由佳(きむら ゆか)
熊本大学 医学部 先端生命医療科学部門
教授 岩本 和也(いわもと かずや)
研究員 村田 唯(むらた ゆい)
東京大学大学院 医学系研究科
特任教授 廣川 信隆(ひろかわ のぶたか)
講師 田中 庸介(たなか ようすけ)
特任研究員 森川 桃(もりかわ もも)
千葉大学 社会精神保健教育研究センター 病態解析研究部門
教授 橋本 謙二(はしもと けんじ)
久留米大学 医学部 薬理学講座
教授 西 昭徳(にし あきのり)
慶応大学 医学部 生理学教室
教授 岡野 栄之(おかの ひでゆき)
東京都医学総合研究所
副所長 糸川 昌成(いとかわ まさなり)
福島県立医科大学 医学部 神経精神医学講座
教授 矢部 博興(やべ ひろおき)
准教授 國井 泰人(くにい やすと)
新潟大学 脳研究所 病理学分野
教授 柿田 明美(かきた あきよし)
医療創成大学 薬学部 薬学科
教授 片桐 拓也(かたぎり たくや)
The Florey Institute of Neuroscience and Mental Health(オーストラリア)
教授 ブライアン・ディーン(Brian Dean)
筑波大学 医学医療系
准教授 内田 和彦(うちだ かずひこ)
研究支援
本研究は、日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム『臨床と基礎研究の連携強化による精神・神経疾患の克服(融合脳)』の「細胞内代謝・ダイナミクス制御から切り拓く発達障害・統合失調症の病理の解明・新規治療法の開発(代表:吉川武男)」「うつ症状の神経基盤モデルに基づく診断・治療法の開発-皮質・側坐核・中脳系への着目(代表:橋本謙二)」「日本ブレインバンクネットの構築(代表:齋藤祐子)」および日本学術振興会(JSPS)科学研究費補助金新学術領域研究「マルチスケール精神病態の構成的理解(領域代表者:林(高木)朗子)」「コホート・生体試料支援プラットフォーム(領域代表者:今井浩三)」、同基盤研究(A)「統合失調症生起・転帰の縦断的メカニズムの解明(代表:吉川武男)」、新エネルギー・産業技術総合開発機構(NEDO)(実施者:内田和彦)による支援を受けて行われました。
原論文情報
- Masayuki Ide, Tetsuo Ohnishi, Manabu Toyoshima, Shabeesh Balan, Motoko Maekawa, Chie Shimamoto-Mitsuyama, Yoshimi Iwayama, Hisako Ohba, Akiko Watanabe, Takashi Ishii, Norihiro Shibuya, Yuka Kimura, Yasuko Hisano, Yui Murata, Tomonori Hara, Momo Morikawa, Kenji Hashimoto, Yayoi Nozaki, Tomoko Toyota, Yuina Wada, Yosuke Tanaka, Tadafumi Kato, Akinori Nishi, Shigeyoshi Fujisawa, Hideyuki Okano, Masanari Itokawa, Nobutaka Hirokawa, Yasuto Kunii, Akiyoshi Kakita, Hirooki Yabe, Kazuya Iwamoto, Kohji Meno, Takuya Katagiri, Brian Dean, Kazuhiko Uchida, Hideo Kimura, Takeo Yoshikawa, "Excess hydrogen sulfide and polysulfides production underlies a schizophrenia pathophysiology", EMBO Molecular Medicine, 10.15252/emmm.201910695
発表者
理化学研究所
脳神経科学研究センター 分子精神遺伝研究チーム
客員研究員 井出 政行(いで まさゆき)
(筑波大学 医学医療系 講師)
副チームリーダー 大西 哲生(おおにし てつお)
チームリーダー 吉川 武男(よしかわ たけお)
山陽小野田市立山口東京理科大学 薬学部
教授 木村 英雄(きむら ひでお)
福島県立医科大学 医学部 医学部神経精神医学講座
准教授 國井 泰人(くにい やすと)
東京大学 大学院 医学系研究科
特任教授 廣川 信隆(ひろかわ のぶたか)
 井出 政行
井出 政行
 大西 哲生
大西 哲生
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
筑波大学 広報室
Tel: 029-853-2039
E-mail: kohositu [at] un.tsukuba.ac.jp
公立大学法人山陽小野田市立山口東京理科大学
広報課
Tel: 0836-88-4505 / Fax:0836-88-3400
E-mail:kouhou [at] admin.socu.ac.jp
公立大学法人福島県立医科大学 医療研究推進課
Tel: 024-547-1794 / Fax:024-581-5163
E-mail:rs [at] fmu.ac.jp
東京大学医学部 総務係
Tel: 03-5841-3304
E-mail:ishomu [at] m.u-tokyo.ac.jp
※上記の[at]は@に置き換えてください。
産業利用に関するお問い合わせ
AMED事業に関する問合せ先
日本医療研究開発機構
戦略推進部 脳と心の研究課
Tel: 03-6870-2222
E-mail: brain-pm [at] amed.go.jp
※上記の[at]は@に置き換えてください。
