理化学研究所(理研)光量子工学研究センター生命光学技術研究チームの道川貴章研究員(同センターアト秒科学研究チーム研究員、脳神経科学研究センター細胞機能探索技術研究チーム研究員)、宮脇敦史チームリーダー(脳神経科学研究センター細胞機能探索技術研究チームチームリーダー、日本医療研究開発機構「革新的技術による脳機能ネットワークの全容解明プロジェクト」プロジェクトリーダー)らの共同研究グループは、小脳全体で時々刻々と変化する感覚入力をリアルタイムで表現していることを見いだしました。これは従来の考え方を覆す世界で初めての発見です。
本研究成果は、運動障害の新たな治療やリハビリテーション法、ブレイン・マシン・インターフェイス[1]や脳型コンピューターの開発への応用が期待できます。
今回、共同研究グループは、蛍光カルシウムセンサータンパク質を全ての小脳プルキンエ細胞[2]に発現する遺伝子組換えマウスと、独自に開発した顕微鏡システムおよび画像解析技術を組み合わせることで、小脳皮質の背側全域を同時に計測可能な実験システムの開発に成功しました。この手法を用いて、2万個以上のプルキンエ細胞の複雑スパイクの発火[3]を同時に測定し、これまで計測が難しかった「単一試行における時々刻々と変化する複雑スパイク集団が持つ情報」を定量的に解析しました。その結果、小脳には前肢や後肢に個別に対応した領野があるのではなく、「セグメント」と呼ばれる小区域の活動パターンの組み合わせが、全体として身体のさまざまな部位への感覚入力の確率をリアルタイムで表現する、分散型の集団符号化[4]を行っていることが明らかになりました。
本研究は、科学雑誌『Cell Reports』(11月9日号)に掲載されます。

覚醒したマウス(左)小脳の背側全域に含まれる2万個以上のプルキンエ細胞の活動
背景
脳のさまざまな領野がそれぞれ異なる機能を担うと考える「機能局在論」と、全体が協調して複数の機能を担うと考える「全体論」は、これまで神経科学研究においてさまざまな議論を呼んできました。大脳皮質では、感覚入力を受ける一次体性感覚野、および運動制御に関与する一次運動野で、それぞれ身体の各部位に対応する領域が順番に並んでいる体部位再現地図が知られており、機能局在論を基にした多くの解析が進められています。
小脳は大脳の尾側に位置し、脳全体の重さの10%強を占めています。小脳はその小さな体積に大脳よりも多くの神経細胞を含んでおり、運動や知覚にとってなくてはならない器官です。身体の運動の制御に関与する小脳が機能局在論に従うのか、それとも全体論に従うのかという点も大脳と同様に議論されてきました。
細胞外記録などの電気生理学的計測により、感覚入力によって誘導されるプルキンエ細胞の複雑スパイクの発火が小脳皮質上で局在して生じるという機能局在論に沿った結果が脳科学の教科書に採用され、広く受け入れられています(図1)。一方で、限局した身体部位刺激による応答が小脳皮質の広い範囲で計測されたという報告もあり、小脳皮質の領野と身体の部位との対応については研究者によって見解が分かれていました。
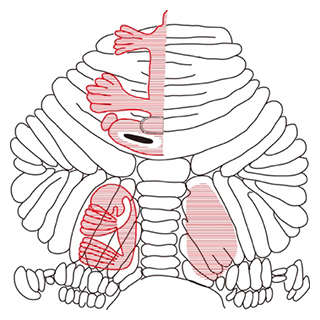
図1 小脳皮質の体部位再現仮説
小脳には身体部位に対応した領域(赤で示した部分)が複数カ所存在すると考える体部位再現仮説が提唱されている。小脳に描かれた「こびと」は、ホムンクルスと呼ばれる。
研究手法と成果
これまで小脳皮質と身体の部位との対応は、主に細胞外電極によって比較的少数の神経細胞の活動を計測する手法で多くの動物を調べ、全体像を推定するという方法を用いて解析されてきました。近年、蛍光カルシウムセンサータンパク質と二光子励起レーザー顕微鏡[5]を組み合わせることで、数mm四方の脳の領野に含まれる数百個程度の小脳皮質のプルキンエ細胞の活動が計測できるようになりましたが、マウスの小脳は8 x 5 mm程度の大きさであり、プルキンエ細胞の活動の全容は不明のままでした。
そこで本研究では、蛍光カルシウムセンサータンパク質yellow cameleon[6]を全ての小脳プルキンエ細胞に発現する遺伝子組換えマウスと、独自に開発した超広視野マクロ顕微鏡システム[7]および画像解析技術を組み合わせることで、小脳皮質の背側全域を同時に計測可能な実験システムの構築を試み、着想から20年以上の年月を経て遂に成功しました。
このシステムを用いて、マウス小脳の背側表面から観察可能な2万個以上の全てのプルキンエ細胞の複雑スパイクの発火を同時に測定したところ、個々のプルキンエ細胞は独立に活動しているのではなく、近くのプルキンエ細胞が同期して発火していることが分かりました。共同研究グループは、この同期して発火するプルキンエ細胞クラスターを「セグメント」と名付け(図2)、感覚情報表現における役割を解析しました。
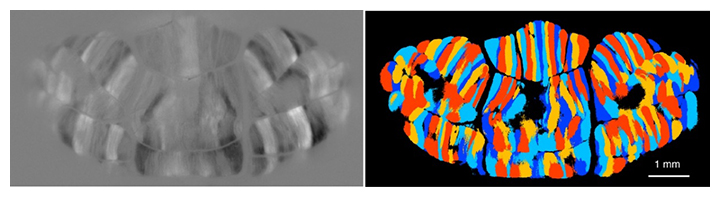
図2 開発した実験システムにより明らかになった小脳皮質のセグメント
近傍のプルキンエ細胞は同期して複雑スパイクを発生し、マウス小脳皮質の背側表面はおよそ100個の同期発火するプルキンエ細胞から構成されるおよそ200個のセグメントに分けられる。
身体部位と小脳皮質の関係を調べるために、麻酔下および覚醒条件でマウスの四肢の筋肉に微弱な電気刺激を加え、小脳皮質での複雑スパイク応答を観察しました。その結果、従来の機能局在仮説とは異なり、観察した小脳皮質のほぼ全域で応答が見られることが分かりました(図3)。この結果は、小脳には前肢や後肢に個別に対応した領野があるのではなく、これまで考えられてきたようなホムンクルス[8](図1)が小脳に存在しないことを示しています。
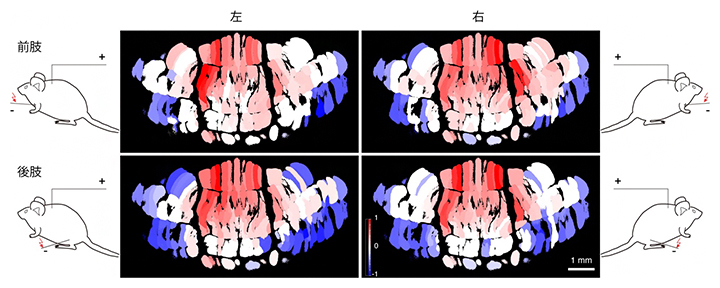
図3 四肢の筋肉への電気刺激により生じた小脳皮質の複雑スパイク応答
プルキンエ細胞は通常1 Hz程度の頻度で、複雑スパイクを発生している。筋肉刺激により複雑スパイク発火が増加したセグメントを赤で、減少したセグメントを青で示した。
そこで、小脳皮質で観察された複雑スパイクの応答からどの筋肉が刺激されたかを読み取れるかどうか、つまり、神経細胞応答の暗号解読が可能であるかどうかを、ベイズ推定[9]を用いて試みました。その結果、複数のセグメントの応答から、各試行において電気刺激を与えたタイミングおよび刺激された筋肉を正確に読み取れることが分かりました。
この結果は各セグメントが感覚事象の条件付き確率を表し、小脳が全体として分散型の集団符号化を行うことで、時々刻々と変化する外界や身体の情報を表現していることを示しています。
今後の期待
本研究では、「百聞は一見にしかず」のことわざ通り、小脳の活動を丸ごと観察することで、小脳皮質における情報表現を明らかにしました。そして、従来考えられてきた局所モジュールによる並列計算から、小脳皮質が全体として分散型集団符号化を行っているという、小脳の計算機構に関する大きな発想の転換を促す結果が得られました。
今後、小脳の全体の働きを調べることを通じて運動制御における小脳の働きの本質的理解が深まることで、脊髄小脳失調症(SCA)や小脳梗塞など小脳疾患により生じる運動障害や知覚障害の治療やリハビリテーション、考えただけで外部機器を操作するブレイン・マシン・インターフェイスや脳型コンピューターなどの開発へ向けた応用が期待できます。
補足説明
- 1.ブレイン・マシン・インターフェイス
脳波などによる脳活動の検出、あるいは逆に脳への刺激などといった手法により、脳とコンピューターなどの外部機器を相互につなげる技術の総称。 - 2.プルキンエ細胞
小脳皮質から出力する唯一の細胞で、巨大な樹状突起を持つ。プルキンエ細胞は単純スパイクと呼ばれる活動電位を自発的に生じ、苔状線維入力によりその発火頻度が上昇する。脳幹に存在する下オリーブ核の軸索である登上線維入力を受け、樹状突起内の広範なカルシウム濃度上昇を伴う複雑スパイクと呼ばれるバースト状の活動電位を示す。このため、樹状突起のカルシウム濃度を蛍光カルシウムセンサーで計測することで、複雑スパイクの発生を光学的に検出できる。 - 3.スパイク発火
活動電位と呼ばれる、神経細胞の膜電位が一過性にスパイク状に上昇する現象を指す。脳における情報処理の担い手であり、単位時間あたりのスパイク数やスパイクが発生するタイミングによって情報が表現されていると考えられている。 - 4.集団符号化
単一神経細胞のスパイク発火ではなく、神経細胞集団のスパイク発火により外界の情報を運ぶ仕組みを指す。 - 5.二光子励起レーザー顕微鏡
赤外線超短パルスレーザーを顕微鏡の対物レンズを介して標本に入射して、焦点付近の蛍光色素のみを励起する走査型の顕微鏡。赤外線を用いるため組織透過性に優れており、生きた動物の脳活動計測に用いられる。ただし、レーザーパルスを標本に走査して画像を取得するため、視野の大きさと画像取得速度がトレードオフとなり、広視野の脳活動イメージングには必ずしも適さない。 - 6.yellow cameleon
宮脇敦史博士が1997年に世界に先駆けて開発した蛍光カルシウムセンサータンパク質。1波長励起2波長蛍光測光により、分子内の色が異なる蛍光タンパク質間の蛍光共鳴エネルギー移動(FRET)の効率の変化を求め、細胞内カルシウム濃度変化を検出する。2波長の蛍光強度の比からFRET効率を計算する。脳の上下動などの神経細胞活動以外の要因による蛍光強度の変化(アーチファクト)を補正できるため、生きた動物の脳活動の計測に適している。また、センサーや励起光の量に影響を受けないカルシウム濃度計測ができ、複雑な神経回路を定量的に解析するのにも適している。 - 7.超広視野マクロ顕微鏡システム
カメラ用の高い開口数のレンズと一光子励起を組み合わせ、CCDやCMOSなどのイメージセンサーにより画像を取得する顕微鏡で、広い視野における高速イメージングに用いられる。本研究では、yellow cameleon用に二波長の蛍光を計測可能な顕微鏡を開発して用いた。 - 8.ホムンクルス
ラテン語で小さな人を意味する。カナダの脳外科医ペンフィールドは、てんかん患者の手術部位の決定に際し、ヒトの大脳皮質を電気刺激して運動野や体性感覚野と体部位との対応関係を調べ、1950年に出版した著書で、「こびと」(ホムンクルス)を大脳皮質の運動野と体性感覚野にそれぞれ描いた。小脳のホムンクルス(図1)は1952年にアメリカのレイ・スナイダーにより描かれた。 - 9.ベイズ推定
ベイズ確率の考え方に基づき、観測事象(観測された事実)から、推定したい事柄(それの起因である原因事象)を、確率的な意味で推論することを指す。
共同研究グループ
理化学研究所
光量子工学研究センター
生命光学技術研究チーム
研究員 道川 貴章(みちかわ たかゆき)
(アト秒科学研究チーム研究員、脳神経科学研究センター 細胞機能探索技術研究チーム 研究員)
チームリーダー 宮脇 敦史(みやわき あつし)
(脳神経科学研究センター 細胞機能探索技術研究チーム チームリーダー)
画像情報処理研究チーム
チームリーダー 横田 秀夫(よこた ひでお)
脳神経科学研究センター
行動遺伝学技術研究チーム
チームリーダー(研究当時) 糸原 重美(いとはら しげよし)
研究員(研究当時) 吉田 崇将(よしだ たかまさ)
研究員(研究当時) 黒木 暁(くろき さとし)
東京都医学総合研究所 運動・感覚システム研究分野
プロジェクトリーダー(研究当時) 筧 慎治(かけい しんじ)
主席研究員 石川 亨宏(いしかわ たかひろ)
東京農工大学 大学院工学研究院
教授 清水 昭伸(しみず あきのぶ)
助教(研究当時) 斉藤 篤(さいとう あつし)
大学院生(研究当時) 君塚 涼(きみづか りょう)
研究支援
本研究は、日本医療研究開発機構(AMED)「革新的技術による脳機能ネットワークの全容解明プロジェクト(プロジェクトリーダー:宮脇敦史、岡野栄之)」、日本学術振興会(JSPS)科学研究費補助金新学術領域研究(研究領域提案型)「共鳴誘導で革新するバイオイメージング(領域代表者:宮脇敦史)」、理化学研究所共生生物学プロジェクトによる支援を受けて行われました。
原論文情報
- Takayuki Michikawa, Takamasa Yoshida, Satoshi Kuroki, Takahiro Ishikawa, Shinji Kakei, Ryo Kimizuka, Atsushi Saito, Hideo Yokota, Akinobu Shimizu, Shigeyoshi Itohara and Atsushi Miyawaki, "Distributed sensory coding by cerebellar complex spikes in units of cortical segments", Cell Reports, 10.1016/j.celrep.2021.109966
発表者
理化学研究所
光量子工学研究センター 生命光学技術研究チーム
研究員 道川 貴章(みちかわ たかゆき)
(アト秒科学研究チーム 研究員、脳神経科学研究センター 細胞機能探索技術研究チーム 研究員)
チームリーダー 宮脇 敦史(みやわき あつし)
(脳神経科学研究センター 細胞機能探索技術研究チーム チームリーダー)
 道川 貴章
道川 貴章
 宮脇 敦史
宮脇 敦史
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
AMED事業に関すること
日本医療研究開発機構 疾患基礎研究事業部 疾患基礎研究課
革新的技術による脳機能ネットワークの全容解明プロジェクト
Tel: 03-6870-2286
Email: brain-m [at] amed.go.jp
※[at]は@に置き換えてください。
