理化学研究所(理研)生命機能科学研究センター比較コネクトミクス研究チームの稲田健吾基礎科学特別研究員、宮道和成チームリーダーらの共同研究グループは、マウスを用いて、食欲を抑制する脳神経回路の機能にオキシトシン[1]が必須であることを明らかにしました。
オキシトシンを介した食欲抑制神経回路の存在をはっきりと捉えた本研究成果は、食欲制御の神経基盤を解明する上で重要な知見であり、将来的にはヒトの肥満や摂食障害に関する理解を深めるものと期待できます。
食欲は動物の根源的な欲求ですが、脳には過剰な摂食を防ぐための機能も備わっています。マウスは適切な量の餌を食べると、それ以上食べるのをやめますが、これは脳内で食欲を抑制する神経回路が活性化されるためだと考えられています。この摂食の制御には、ホルモンの一種であるオキシトシンの関与が示唆されてきましたが、詳しいことは不明でした。
今回、共同研究グループは、視床下部[2]の室傍核[2]と呼ばれる脳領域のオキシトシン神経細胞[1]に着目しました。この細胞のオキシトシン合成を阻害すると、マウスの摂食量と体重が増加し肥満になったことから、室傍核から分泌されるオキシトシンがマウスの食欲抑制に必須の役割を持つことが分かりました。さらに、同じく視床下部にある弓状核[2]でオキシトシン受容体を発現している神経細胞が食欲抑制の効果を伝えていることが明らかになりました。
本研究は、米国の科学雑誌『eLife』(10月25日付:日本時間10月26日)に掲載されました。
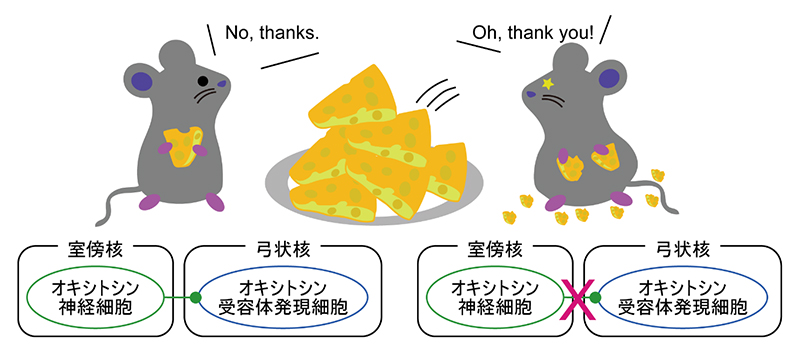
オキシトシン神経細胞とオキシトシン受容体発現細胞で構成される食欲抑制神経回路
背景
おいしい食事は人生における楽しみの一つです。栄養のある食事は、ヒトも含め、動物が元気に活動するために必要不可欠であることから、動物の脳には食欲という強烈な欲求が備わっています。一方で、食べ過ぎは肥満につながり、さまざまな病気のリスクを増加させます。そのため脳には、適切な量の食事を取った後に、食欲にブレーキをかけ摂食を抑制する機能も備わっています。しかし、摂食を制御する脳神経回路についてはまだまだ解明すべきことが数多く残されています。現在、世界的に肥満が社会問題化しており、摂食制御の神経回路の理解は人類にとって喫緊の課題です。
食欲の増進や抑制には、多数のホルモンが関与しています。このうち今回、共同研究グループは、雄マウスをモデルとして、オキシトシンというホルモンに注目しました。オキシトシンは、脳の視床下部の室傍核と視索上核[2]という神経核に存在するオキシトシン神経細胞で合成され、分泌されます。オキシトシンは出産や授乳、母親の子育て行動に深く関与するホルモンです。さらに、過去の研究から、オキシトシンには体重増加を防ぐ機能もあることが分かっています。
しかし、従来のオキシトシン遺伝子(オキシトシン合成に関わる遺伝子)やオキシトシン受容体遺伝子のノックアウトマウス[3]では、摂食量に異常が見つかっておらず、オキシトシンのシグナルが生理的な条件下において、本当に摂食制御に関わるのか疑問視する意見もありました。さらに、仮にオキシトシンが食べ過ぎの抑止に関与するとしても、脳のどの領域にあるオキシトシン神経細胞が重要なのか、また放出されたオキシトシンがどの脳領域に作用して、効果が発揮されているのかは分かっていませんでした。
研究手法と成果
共同研究グループは、従来のオキシトシン遺伝子のノックアウトマウスにおいて摂食量に異常が見られないのは、受精卵のときから遺伝子が働かないため、発生期にオキシトシンの欠損を補うような何らかの補償機構が発達したためではないかと考えました。そこで、成獣期になってから、オキシトシン神経細胞のオキシトシンの合成能を失わせる実験を試みました。この実験には、以前共同研究グループが作製したオキシトシン遺伝子のコンディショナルノックアウトマウス[3]という特殊なマウス系統を使用しました注)。このマウス系統では、室傍核、あるいは視索上核のオキシトシン神経細胞だけを狙って、任意のタイミングでオキシトシンの合成能を失わせることができます。
まず、成獣期に室傍核のオキシトシン神経細胞からオキシトシンの合成能を失わせると、雄マウスの体重が増加し、摂食量も増えることが分かりました(図1A)。一方、視索上核のオキシトシン神経細胞で同様の実験を行っても、体重や摂食量に変化は見られませんでした(図1B)。これらの結果は、室傍核のオキシトシン神経細胞から分泌されるオキシトシンが摂食量抑制効果を持つことを示しています。
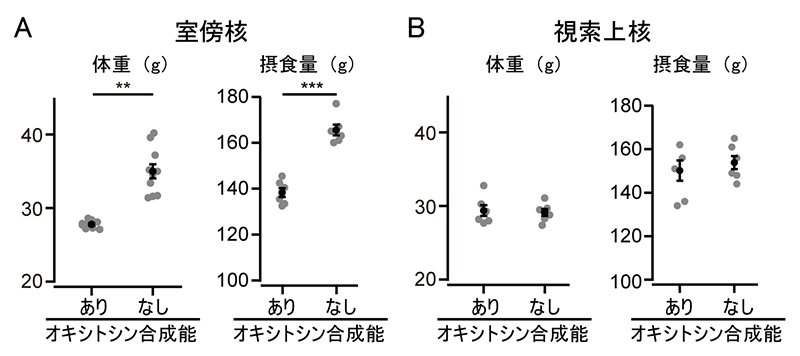
図1 室傍核や視索上核におけるオキシトシン合成能の有無と体重や摂食量への影響
- A.室傍核のオキシトシン神経細胞からオキシトシン合成能を欠損させた場合(なし)と正常な場合(あり)。体重(左)は、コンディショナルノックアウトを始めてから5週間後に計測した。摂食量(右)は5週間の総摂食量。オキシトシン合成能なしのマウスでは、正常なマウスに比べて、体重、摂食量ともに有意な増加が見られた。比較した2群の有意水準は、**はp<0.01、***はp<0.001。
- B.視索上核のオキシトシン神経細胞からオキシトシン合成能を欠損させた場合(なし)と正常な場合(あり)。オキシトシン合成能なしのマウスと正常なマウスとでは、体重や摂食量に有意差は見られなかった。
次に、室傍核オキシトシン神経細胞から分泌されたオキシトシンが、どの脳領域に作用することで摂食量抑制効果を発揮しているのを調べるために、オキシトシン受容体遺伝子のコンディショナルノックアウトマウスを用意しました。このマウス系統では、狙った神経核にあるオキシトシン受容体を発現している細胞から、オキシトシン受容体を欠損させることができます。
室傍核オキシトシン神経細胞は視床下部を含め、脳全体に広く軸索[4]を投射しています。また、オキシトシン受容体を発現している細胞も、脳のさまざまな領域に見られます。そこで、食欲を制御していることが知られている視床下部を対象として、どの神経核にあるオキシトシン受容体が摂食量抑制効果を伝えているのか、探索しました。そのために、まず視床下部を前側(頭側)と後ろ側(尾側)の二つに大きく分けて、それぞれに含まれる細胞のオキシトシン受容体を欠損させました。すると、特に後ろ側の視床下部でオキシトシン受容体を欠損させた場合に、体重と摂食量の増加が見られました。
さらに、後ろ側の視床下部のうち、どの神経核にあるオキシトシン受容体が重要なのか調べました。すると、食欲制御中枢として知られる弓状核のオキシトシン受容体を欠損させた場合に、体重と摂食量の増加が見られました(図2A)。
これらの結果は、室傍核オキシトシン神経細胞から分泌されたオキシトシンが弓状核のオキシトシン受容体と結合することで、摂食量が抑制され、体重の増加が防がれていることを示しています(図2B)。
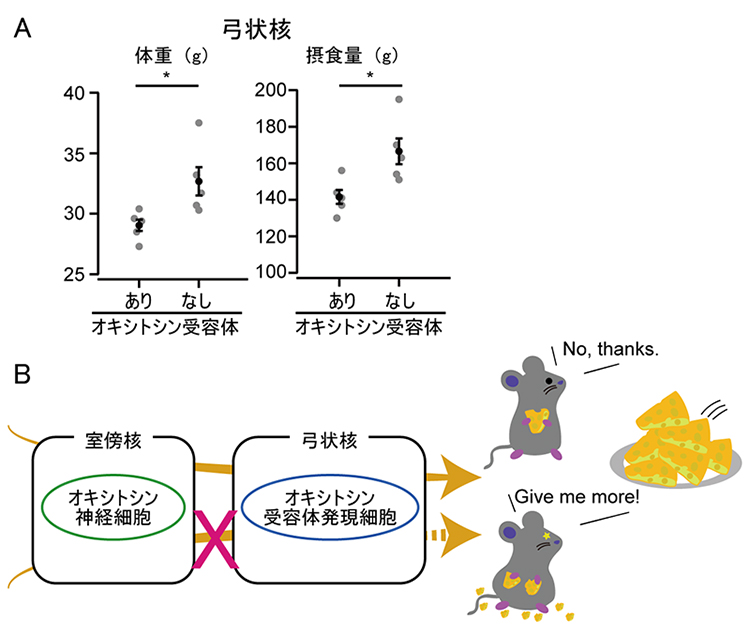
図2 体重と摂食量の増加抑制に必須な弓状核オキシトシン受容体発現細胞
- A.弓状核のオキシトシン受容体発現細胞からオキシトシン受容体を欠損させた場合(なし)と正常な場合(あり)。体重(左)はコンディショナルノックアウトを始めてから5週間後に計測した。摂食量(右)は5週間の総摂食量。オキシトシン受容体なしのマウスでは、正常なマウスに比べて体重、摂食量ともに増加した。*は比較した2群の有意水準(p<0.05)。
- B.今回の実験結果の模式図。室傍核オキシトシン神経細胞からオキシトシンが分泌され、弓状核オキシトシン受容体発現細胞へ伝わることで、体重や摂食量が抑制される。
- 注)2022年4月20日プレスリリース「父親の子育てを支える神経回路の変化」
今後の期待
今回共同研究グループは、室傍核オキシトシン神経細胞から弓状核オキシトシン受容体発現細胞へのオキシトシンを介したシグナル伝達が、摂食量と体重増加を抑制していることを明らかにしました。しかし、オキシトシン受容体は弓状核以外のさまざまな領域にも発現しており、今回解明したシグナル伝達経路以外の経路が食欲抑制へ貢献している可能性も残されています。また、弓状核オキシトシン受容体発現細胞が、オキシトシン結合後にどのような神経細胞へ情報を伝えているのかも分かっていません。
オキシトシンの投与は、ヒトの摂取カロリーを下げる作用があることが報告され始めています。今後さらに研究を進めることで、マウスとヒトの共通性や種差の検討などを通して、ヒトを含む哺乳類の食欲制御を行う神経基盤が明らかになるものと期待できます。
補足説明
- 1.オキシトシン、オキシトシン神経細胞
オキシトシンは、視床下部室傍核や視索上核に存在する神経細胞(オキシトシン神経細胞)によって合成され、下垂体後葉から分泌されるホルモン。9個のアミノ酸残基から構成されるペプチドホルモンで、1906年、ヘンリー・デールによって子宮筋の収縮活性を指標に発見された。ヒトや愛玩動物の陣痛促進剤として広く使用されている。近年、古典的な母性機能に加えて、男性の生殖機能の制御や、両性ともに社会親和性を亢進させる作用が着目され、活発に研究が進められている - 2.視床下部、室傍核、視索上核、弓状核
脳の視床下部は内分泌や自律機能の調節を担い、生理機能をつかさどる中枢領域。視床下部は特定の機能をつかさどる多くの神経核(細胞の集まり)から構成されており、本研究で扱った室傍核や視索上核、そして弓状核も、視床下部に含まれる神経核である。 - 3.ノックアウトマウス、コンディショナルノックアウトマウス
ここでの「ノックアウト」は遺伝子破壊を意味する用語。通常のノックアウトマウスは、受精卵の段階から特定の遺伝子配列を欠損しており、個体の一生を通じて全ての細胞で遺伝子機能が失われている。そのため、発生初期で致死性となるような遺伝子破壊や、生存に必須な細胞機能を担う遺伝子については、個体レベルの機能解析が困難な場合がある。一方、本研究で用いたオキシトシン遺伝子、あるいはオキシトシン受容体遺伝子のコンディショナルノックアウトマウスは、オキシトシンやオキシトシン受容体の産生に必要なDNA配列を、DNA組換え酵素Cre依存的に欠損させることのできるマウス系統。「Creを発現している細胞だけにおいて」という条件付き(コンディショナル)で作動するので、従来のノックアウトマウスではできなかった時間的・空間的な制御が可能である。本研究では、Creを発現させるアデノ随伴ウイルスを左右の神経核に局所注入することで、コンディショナルノックアウトを行った。 - 4.軸索
神経細胞から伸びている長い突起。ある神経細胞から伸びる軸索は、別の神経細胞へ情報を伝達する。
共同研究グループ
理化学研究所
生命機能科学研究センター比較コネクトミクス研究チーム
チームリーダー宮道和成(ミヤミチ・カズナリ)
基礎科学特別研究員稲田健吾(イナダ・ケンゴ)
テクニカルスタッフ(研究当時)辻本和子(ツジモト・カズコ)
自治医科大学医学部
助教吉田匡秀(ヨシダ・マサヒデ)
福島県立医科大学肥満・体内炎症解析研究講座
特任教授西森克彦(ニシモリ・カツヒコ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、基礎科学特別研究員制度)で実施し、日本学術振興会(JSPS)科学研究費助成事業特別研究員奨励費「神経配線のレベルにおける雌雄差の形成メカニズム(特別研究員:稲田健吾)」、同挑戦的研究(開拓)「ニューロンの個性と接続パターンとを結び付ける新規技術で解明する脳の性差と進化(研究代表者:宮道和成)」、花王芸術・科学財団花王科学奨励賞「機能的な神経配線の雌雄差形成メカニズムの解明(稲田健吾)」、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「腸-脳機能コネクトミクスによる腸内感覚の機能解明と操作(共同研究者:宮道和成)」などによる助成を受けて行われました。
原論文情報
- Kengo Inada, Kazuko Tsujimoto, Masahide Yoshida, Katsuhiko Nishimori & Kazunari Miyamichi, "Oxytocin signaling in the posterior hypothalamus prevents hyperphagic obesity in mice", eLife, 10.7554/eLife.75718
発表者
理化学研究所
生命機能科学研究センター 比較コネクトミクス研究チーム
チームリーダー宮道和成(ミヤミチ・カズナリ)
基礎科学特別研究員稲田健吾(イナダ・ケンゴ)
 宮道和成
宮道和成
 稲田健吾
稲田健吾
報道担当
理化学研究所広報室報道担当
お問い合わせフォーム
