理化学研究所(理研)開拓研究本部 岩崎RNAシステム生化学研究室の岩崎 信太郎 主任研究員、陈 明明 国際プログラム・アソシエイト(研究当時)、七野 悠一 研究員、環境資源科学研究センター 植物免疫研究グループの白須 賢 グループディレクター、熊倉 直祐 研究員、生命機能科学研究センター 翻訳構造解析研究チームの伊藤 拓宏 チームリーダーらの国際共同研究グループは、抗菌性物質による植物の防御をすり抜けて感染する新たな糸状菌(カビ)を発見し、そのメカニズムを解明しました。
本研究成果は、多大な作物被害をもたらす糸状菌の薬剤抵抗性メカニズムの理解と、抗菌性物質を利活用した医薬・農薬開発に貢献すると期待できます。
アグライア(和名:樹蘭)と呼ばれる植物が産生するロカグレートという化合物には、細胞内の翻訳を阻害する働きがあり、抗菌剤や抗がん剤、新型コロナウイルス感染症の治療薬候補として注目されています。アグライアはロカグレートを、菌類感染からの防御に利用していると考えられていました。
国際共同研究グループは今回、新たに発見した糸状菌(Ophiocordyceps sp. BRM1株)がロカグレートによる防御をすり抜け、アグライアに感染する能力を持つことを突き止めました。この糸状菌の翻訳開始因子「eIF4A[1]」はロカグレートに結合しないように変異することで、ロカグレート抵抗性を獲得していることが分かりました。糸状菌の感染戦略としては、抗菌性物質を分解するメカニズムがよく知られていますが、この糸状菌はそれとは異なる独自のメカニズムを持っていました。
本研究は、科学雑誌『eLife』オンライン版(2月28日付:日本時間2月28日)に掲載されました。

抗菌性物質ロカグレートを生産するアグライアから発見された糸状菌(白く見える部分)
背景
近年、ロカグレートという化合物の抗菌作用や抗がん作用、新型コロナウイルス感染症(COVID-19)への治療効果が注目されています注1)。ロカグレートは、アグライア(和名:樹蘭)という東南アジアに自生する植物が生産する二次代謝産物[2]であり、植物、菌類を含む真核生物の細胞内に存在する翻訳開始因子「eIF4A」に結合することで翻訳を阻害します。翻訳が阻害されると最終的に細胞は増殖できなくなり、死滅します。
このロカグレートの翻訳阻害作用(抗菌作用)を、アグライアは自身の防御に利用していると考えられていました。従って、もしアグライアに感染する菌類が存在すれば、ロカグレートの抗菌作用を回避する術を持つと予想されていましたが、そのような菌類の存在はこれまで報告されていませんでした。
- 注1)Göran Schulz, Catherine Victoria, Andreas Kirschning, Eike Steinmann,Rocaglamide and silvestrol: a long story from anti-tumor to anti-coronavirus compounds, Natural Product Reports, Volume 38, Issue 1, 2021
研究手法と成果
国際共同研究グループはまず、アグライアに感染する新たな糸状菌(カビ)を発見しました。この糸状菌からRNAを単離し、次世代シーケンサー[3]を用いた解析によりトランスクリプトーム[4]を再構築し、系統樹解析を行いました。その結果、この糸状菌が漢方薬として用いられる冬虫夏草[5]などで有名なOphiocordyceps属菌の一種であったことから、「Ophiocordyceps sp. BRM1株(BRM1株)」と名付けました。この糸状菌の持つeIF4Aタンパク質をコードする遺伝子を調べたところ、ロカグレートに結合する部位のアミノ酸配列が変異していることを発見しました。
そこで試験管内で、BRM1株のeIF4Aに対するロカグレートの作用を調べたところ、ヒトのeIF4Aに比べて著しく低下していることが分かりました(図1A)。一方、ヒトのeIF4AにBRM1株型の(アミノ酸)変異を導入したところ、ロカグレートの作用は低下し、BRM1株のeIF4Aをヒト型のアミノ酸配列にするとロカグレートの作用が上昇しました(図1A)。また、試験管内の翻訳反応系を用いた解析から、BRM1株型の変異を導入したヒトeIF4Aは、ロカグレートによる翻訳阻害を回避することが分かりました(図1B)。
次に、BRM1株型eIF4Aを持つ菌類を実際に植物に感染させて、BRM1株型の変異が、菌類細胞内での翻訳や植物への感染に与える影響を調べました。まず、植物に感染する糸状菌の一種である炭疽病菌のeIF4Aに、CRISPR-Cas9システム[6]を用いたゲノム編集により、BRM1株型の変異を導入しました。この炭疽病菌にロカグレートを投与し、細胞内の翻訳状態を網羅的に調べるリボソームプロファイリング法[7]で解析したところ、BRM1株型変異eIF4Aにより、ロカグレートによる翻訳阻害が低減することが分かりました(図1C)。
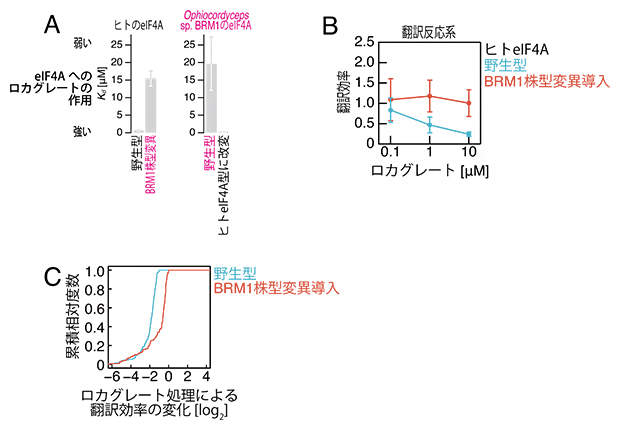
図1 BRM1株型eIF4Aのロカグレート抵抗性
- (A)ヒトおよびBRM1株のeIF4Aへのロカグレートの作用。ヒトeIF4A野生型にはロカグレートが強く作用したが、BRM1株型(アミノ酸)変異を導入すると低下した(左)。一方、Ophiocordyceps sp. BRM1株のeIF4A野生型へのロカグレートの作用は弱かったが、ヒトeIF4A型のアミノ酸残基を導入すると上昇した(右)。eIF4AはATP依存的RNA結合タンパク質であり、ロカグレートによってATP非依存的にRNAに結合する活性(解離定数 Kd)を指標に解析した。
- (B)試験管内の翻訳反応系に対するロカグレートの阻害効果。ヒトeIF4A野生型の場合、ロカグレート濃度の上昇に伴って翻訳効率が低下した(青線)。一方、BRM1株型変異を導入したヒトeIF4Aでは、ロカグレートによる翻訳阻害が回避された(赤線)。
- (C)BRM1株型の変異を持つ炭疽病菌におけるロカグレートによる翻訳制御。リボソームプロファイリング法により、翻訳の効率変化を網羅的に解析した。野生型炭疽病菌で特にロカグレートによって翻訳阻害されやすいmRNAを解析の対象とした。BRM1株型変異を導入した炭疽病菌では、ロカグレートによる翻訳阻害が回避された(赤線)。
さらに、炭疽病菌をロカグレートとともに植物(キュウリ葉)へ接種する実験を行ったところ、野生型炭疽病菌ではロカグレートによって植物への感染が阻害された一方で、BRM1株型変異eIF4Aを持つ炭疽病菌ではロカグレートによる感染阻害を免れることが明らかになりました(図2)。
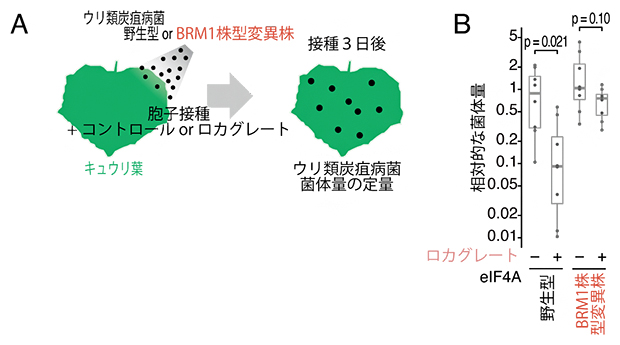
図2 BRM1株型のeIF4Aのロカグレートによる感染阻害の回避
- (A)BRM1株型変異が炭疽病菌のロカグレート抵抗性に与える影響の評価実験。キュウリに感染するウリ類炭疽病菌の野生型とBRM1株型変異株を用いた。炭疽病菌胞子をロカグレートもしくはコントロールの溶媒(DMSO)と共にキュウリ葉に接種し、3日後に炭疽病菌菌体量を測定した。
- (B)キュウリ葉上のウリ類炭疽病菌菌体量。野生型eIF4Aを持つ炭疽病菌はロカグレートにより菌体量が低下した。一方、eIF4AにBRM1株型変異を導入した炭疽病菌では、ロカグレートによる感染阻害が見られなかった。統計解析にはt検定を利用。
これらの結果から、BRM1株はロカグレートに結合しないようeIF4Aを進化させ、ロカグレート抵抗性を獲得したと考えられます(図3)。
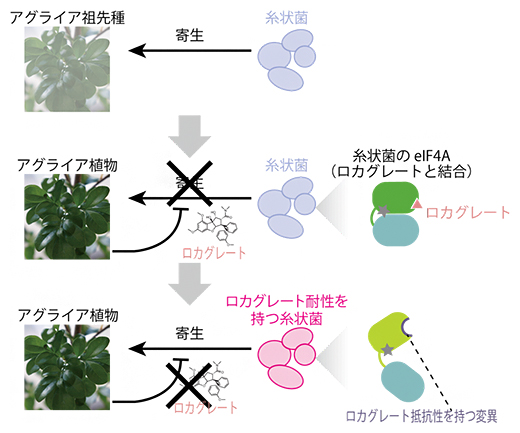
図3 ロカグレートを介した、植物と糸状菌の生存競争
- 上段:アグライア祖先種に糸状菌が寄生。
- 中段:アグライアが抗菌活性を持つロカグレートを産生。ロカグレートは糸状菌のeIF4Aに結合して翻訳を阻害し、寄生を阻止。
- 下段:糸状菌のeIF4Aにロカグレート抵抗性を持つ変異が生じ、再び寄生が成立。
今後の期待
本研究では、ロカグレートによるアグライアの防御をすり抜けて感染する新たな糸状菌を発見し、その仕組みを解明しました。糸状菌の感染戦略としては、植物の抗菌性物質を分解するメカニズムがよく知られていますが、今回発見したBRM1株はそれとは異なる独自のメカニズムを持っていました。
糸状菌は、感染した農作物を枯らしてしまい、大きな作物被害をもたらすことがあります。今回明らかになった、糸状菌が抗菌性物質の防御をすり抜けるメカニズムは、糸状菌の感染を防ぐ農薬などの開発に役立つと期待できます。
また、ロカグレートは抗がん作用や新型コロナウイルス感染症の治療薬候補として注目されています。本研究で明らかになった薬剤抵抗性のメカニズムは、その医薬応用の一助にもなると期待できます。
補足説明
- 1.eIF4A
真核生物の翻訳の開始に必須な翻訳開始因子の一つ。DEAD-box型RNA結合タンパク質。mRNAの5'非翻訳領域に結合し、RNAの二次構造を解きほぐすなどの機能により、翻訳開始を促進すると考えられている。eIFはeukaryotic translation initiation factorの略。 - 2.二次代謝産物
生育そのものには必要とされない代謝産物のことで、抗生物質などが含まれる。一方、生物体を構成・維持する上で重要な物質を一次代謝産物と呼ぶ。 - 3.次世代シーケンサー
DNAの塩基配列を決定するための装置。複数のDNA断片の塩基配列を同時並行で、高速・高精度に決定できる。 - 4.トランスクリプトーム
ゲノムDNAを鋳型としてRNAが合成されることを転写(トランスクリプション)と呼び、転写の結果合成されたRNAを転写産物と呼ぶ。細胞中にはさまざまなRNAがそれぞれの量で存在している。このようなRNAの総体を、転写産物を表す「トランスクリプト」に総体を表す接尾語「オーム」をつなげて「トランスクリプトーム」と呼ぶ。 - 5.冬虫夏草
Ophiocordyceps属の一種であるOphiocordyceps sinensisが蛾(ガ)の体に寄生して育った子実体(キノコ)のこと。主にチベット高原に自生し、古来漢方薬として用いられてきた。 - 6.CRISPR-Cas9システム
任意の領域のDNAを切断する技術のこと。DNA切断活性を持つCas9タンパク質と、標的配列DNAと相同な配列を持つガイドRNA(gRNA)からなる。Cas9とgRNAの複合体が、gRNAと相同な配列を持つ二本鎖DNAを特異的に切断する。本研究では、CRISPR-Cas9システムによってゲノムDNAを切断して相同組換えを誘導し、変異型eIF4Aを炭疽病菌に導入した。 - 7.リボソームプロファイリング法
組織から翻訳装置であるリボソームを抽出し、リボソームと結合しているRNA配列を同定することで、どの遺伝子がどの程度の効率で翻訳されているかを知る解析法。リボソームは大きな複合体であるため、一定のmRNA領域を覆うように結合する。これらのリボソームとmRNAの複合体をRNA分解酵素で処理すると、リボソームが保護するmRNA断片だけが分解されずに回収される。
国際共同研究グループ
理化学研究所
開拓研究本部 岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(イワサキ・シンタロウ)
国際プログラム・アソシエイト(研究当時)陈 明明(チェン・ミンミン)
研究員 七野 悠一(シチノ・ユウイチ)
テクニカルスタッフⅠ 水戸 麻理(ミト・マリ)
大学院生リサーチ・アソシエイト 斉藤 大寛(サイトウ・ヒロノリ)
環境資源科学研究センター 植物免疫研究グループ
グループディレクター 白須 賢(シラス・ケン)
(環境資源科学研究センター 副センター長)
研究員 熊倉 直祐(クマクラ・ナオヨシ)
研究員(研究当時)パメラ・ガン(Pamela Gan)
生命機能科学研究センター 翻訳構造解析研究チーム
チームリーダー 伊藤 拓宏(イトウ・タクヒロ)
技師 西本 まどか(ニシモト・マドカ)
カリフォルニア大学バークレー校(米国)
Department of Molecular and Cell Biology
助教授 ニコラス・インゴリア(Nicholas T. Ingolia)
大学院生(研究当時)ライアン・ミュラー(Ryan Muller)
研究支援
本研究は、理化学研究所運営費交付金組織横断連携プロジェクト「ライフサイエンスの横断的取組による超高齢社会課題解決への貢献(研究分担者:岩崎信太郎、伊藤拓宏)」、RIKEN Pioneering Projects「Biology of Intracellular Environments(研究分担者:岩崎信太郎、伊藤拓宏)」で実施し、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(B)「新規Disome-Seq法:パラメトリックなリボソーム渋滞の網羅的探索(研究代表者:岩崎信太郎)」、同学術変革領域研究(A)「APEX-Ribo-seq:近傍標識による非典型局所翻訳の網羅解析(研究代表者:七野悠一)」、同若手研究(A)「翻訳開始因子パラログによる選択的翻訳の網羅的解析(研究代表者:岩崎信太郎)」、同基盤研究(B)「複合体間の動的な相互作用による翻訳制御の構造基盤(研究代表者:伊藤拓宏)」、同基盤研究(S)「植物と病原体の攻防における分子機構(研究代表者:白須賢)」、同若手研究「植物病原糸状菌の病原性に寄与する二次代謝物の同定と機能解明(研究代表者:熊倉直祐)」「翻訳開始因子eIF4A1とグルタミン代謝による協調的な発現制御機構(研究代表者:七野悠一)」、科学技術振興機構(JST)戦略的創造研究推進事業ACT-X「遺伝子多重破壊法を用いた感染メカニズムの網羅的解明(研究代表者:熊倉直祐)」による助成、および理化学研究所脳神経科学研究センター生体物質分析支援ユニットの支援を受けて行われました。
原論文情報
- Mingming Chen, Naoyoshi Kumakura, Hironori Saito, Ryan Muller, Madoka Nishimoto, Mari Mito, Pamela Gan, Nicholas T. Ingolia, Ken Shirasu, Takuhiro Ito, Yuichi Shichino, and Shintaro Iwasaki, "A parasitic fungus employs mutated eIF4A to survive on rocaglate-synthesizing Aglaia plants", eLife, 10.7554/eLife.81302
発表者
理化学研究所
開拓研究本部 岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(イワサキ・シンタロウ)
国際プログラム・アソシエイト(研究当時)陈 明明(チェン・ミンミン)
研究員 七野 悠一(シチノ・ユウイチ)
環境資源科学研究センター 植物免疫研究グループ
グループディレクター 白須 賢(シラス・ケン)
(環境資源科学研究センター 副センター長)
研究員 熊倉 直祐(クマクラ・ナオヨシ)
生命機能科学研究センター 翻訳構造解析研究チーム
チームリーダー 伊藤 拓宏(イトウ・タクヒロ)
 岩崎 信太郎
岩崎 信太郎
 陈 明明
陈 明明
 七野 悠一
七野 悠一
 白須 賢
白須 賢
 熊倉 直祐
熊倉 直祐
 伊藤 拓宏
伊藤 拓宏
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
