2023年6月12日
理化学研究所
世界最速・簡易遺伝子検査法「Direct-SATORI法」の開発
-汎用的ウイルス検査法として農業・医療分野での実用化に期待-
理化学研究所(理研)開拓研究本部 渡邉分子生理学研究室の渡邉 力也 主任研究員、篠田 肇 研究員、上田 智也 基礎特別研究員らの研究チームは、生体試料から直接ウイルスを検出できる世界最速の非増幅遺伝子検査法「Direct-SATORI法」を開発し、生体試料から8種類の病害ウイルスを15分間で直接検出できる全自動遺伝子検査を実現することに成功しました。
本研究成果は、ウイルス病の診断を含む、次世代の遺伝子検査法として、農業から医療に至る幅広い分野で実用化されるものと期待できます。
今回、研究チームは2021年度に発表した世界最速の遺伝子検査法である「SATORI法」を大幅に改善し、生体試料からウイルス遺伝子を直接検出できるDirect-SATORI法を開発しました。Direct-SATORI法では、従来の遺伝子検査の律速であった、(1)遺伝子の抽出・精製、(2)遺伝子の増幅の両工程を省略することができ、検出時間の大幅な短縮と多種ウイルスの並列/多項目検出を実現しました。また、2022年度に発表した全自動装置「opn-SATORI装置」を最適化することで、Direct-SATORI法を用いた全自動遺伝子検査を実現し、トマトの葉を用いた検証実験では、8種類の病害ウイルスを15分間で全自動検出することに成功しました。検出時間は、従来法(PCR法)と比べて10分の1以下まで短縮し、さらには感度[1]96%、特異度[2]99%を達成しました。
本研究は、科学雑誌『Analytical Chemistry』オンライン版(6月12日付:日本時間6月12日)に掲載されました。
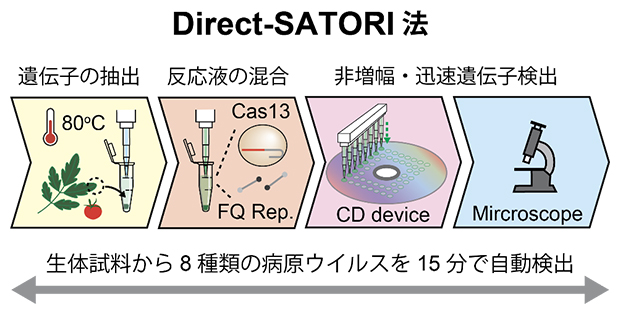
本研究手法の概要図
背景
私たちは新型コロナウイルス感染症(COVID-19)を経験し、将来のパンデミックに備えるべく、汎用的な感染検査法の確立が急務とされています。ヒト・動物・植物などを対象とした従来のウイルス病の診断では、主にウイルスのタンパク質抗原を検出する方法(抗原検査法)と遺伝子を増幅して検出する方法(PCR検査法[3])が利用されており、それぞれスクリーニング、確定診断など用途に応じて使い分けられています。
抗原検査法は30分間程度で迅速かつ簡便にウイルスを検出できるため、スクリーニングには適していますが、感度や特異度の低さに起因する検出エラーの多さが問題になっています。一方、PCR検査法は感度が優れ、確定診断に適していますが、検出の前処理に最短で1時間程度かかるため、大量の検体を迅速に解析し、診断につなげることが困難です。そのため、PCR検査法の「感度の高さ」と、抗原検査法の「迅速・簡便さ」を両立させた新しい検査法の開発が期待されています。
この背景を鑑み、これまでに研究チームは世界最速の遺伝子検査法「SATORI法」(2021年度発表)注1)、およびその全自動装置「opn-SATORI装置」(2022年度発表)注2)を開発しました。SATORI法は、CRISPR-Cas13a[4]と呼ばれる酵素と微小試験管を集積したマイクロチップを用いることで、ウイルスの遺伝子を増幅せずとも「1分子」レベルで識別し、9分間以内の世界最速の迅速検出を実現しました(図1)。検出限界濃度は1マイクロリットル(μL、1μLは100万分の1リットル)当たり1.4コピー(PCR検査法とほぼ同等)で、COVID-19の臨床検体を用いた検証実験では、陽性判定および変異株判定において98%以上の正解率を達成し、従来技術と検出原理の異なる革新的な遺伝子検査法でした。
しかし従来のSATORI法では、生体試料から直接ウイルスを検出することはできず、別の装置を用いて、ウイルスの遺伝子をあらかじめ抽出・精製する必要がありました。そのため、臨床現場で生体試料を採取してからSATORI法の全工程を完結するのに最低でも30分間以上の時間を要するなど、さらなる検査工程の簡略化および検査時間の短縮が強く期待されていました。
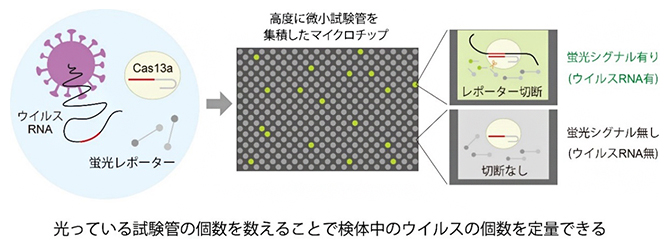
図1 独自の世界最速遺伝子検査法(SATORI法)
核酸切断酵素Cas13aと蛍光レポーター、検体のウイルスRNAを混ぜると、特異的にウイルスRNAとCas13aの複合体が形成される。複合体が形成されるとCas13aの酵素活性のスイッチが入り、蛍光基と消光基がつながった蛍光レポーターが切断される。これをマイクロチップアレイに小分けにして封入すると、ウイルスRNAが存在する微小試験管だけ蛍光シグナルが1分間以内に上昇する。マイクロチップの蛍光シグナルの有無を二値化し、そのデジタル信号からシグナル有りの微小試験管の個数をカウントする。微小試験管内にウイルスRNAは1個だけ存在するため、カウントされる試験管の個数はサンプル中のウイルスRNAの個数に相当する。
- 注1)2021年4月19日プレスリリース「新型コロナウイルスの超高感度・世界最速検出技術を開発」
- 注2)2022年5月26日プレスリリース「新型コロナウイルスの超高感度・全自動迅速検出装置の開発」
研究手法と成果
研究チームは2021年度に発表した世界最速の非増幅遺伝子検査法SATORI法を大幅に改善し、生体試料からウイルス遺伝子を直接検出できる「Direct-SATORI法」を開発しました(図2)。Direct-SATORI法では、従来の遺伝子検査の律速であった、(1)遺伝子の抽出・精製、(2)遺伝子の増幅の工程を省略することができ、検出時間の大幅な短縮と多種ウイルスの並列/多項目検出を実現しました。また、2022年度に発表した全自動装置opn-SATORI装置を最適化することで、Direct-SATORI法を用いた全自動遺伝子検査を実現しました。詳しい改善点は以下の通りです。
- 1)生体試料からウイルス遺伝子を迅速抽出する新手法を開発
(界面活性剤の添加と5分間の加熱処理のみのシンプルな手法/自動化対応) - 2)8種類の病害ウイルスを並列検出するための新自動機構の開発
(opn-SATORI装置に8連自動分注ユニット、自動加熱ユニットを導入)
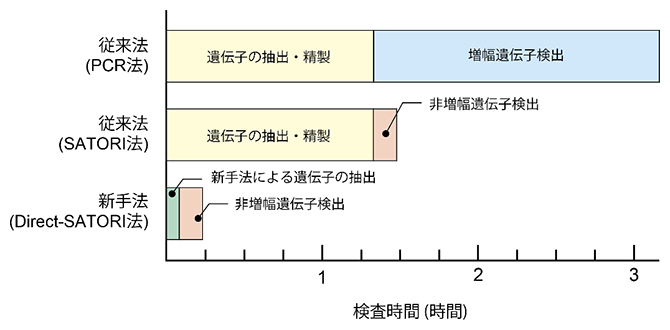
図2 従来の遺伝子検査法との検査時間の比較
生体試料を採取してからの検査時間の内訳。例として、植物の葉を用いた遺伝子検査の内訳を示す。
Direct-SATORI法を用いた全自動遺伝子検査を実施したところ、トマトの葉を用いた検証実験では、8種類の病害ウイルス(トマトモザイクウイルス:ToMV、トマトアスパーミウイルス:TAV、トマト黄化えそウイルス:TSWV、キュウリモザイクウイルス:CMV、ジャガイモXウイルス:PVX、ジャガイモYウイルス:PVY、タバコモザイクウイルス:TMV、タバコ壊死ウイルス:TNV)を15分間で全自動検出することに成功しました(図3)。
検出時間は、従来法(PCR法)の10分の1以下まで短縮し、感度96%、特異度99%を達成しました。また、検証実験に用いたトマトの葉はわずか1mgであり、従来の検査法では50mg程度を要していたことから、現場で微量サンプルを採取し迅速検査へつなげる上で、Direct-SATORI法が有効であることが示されました。
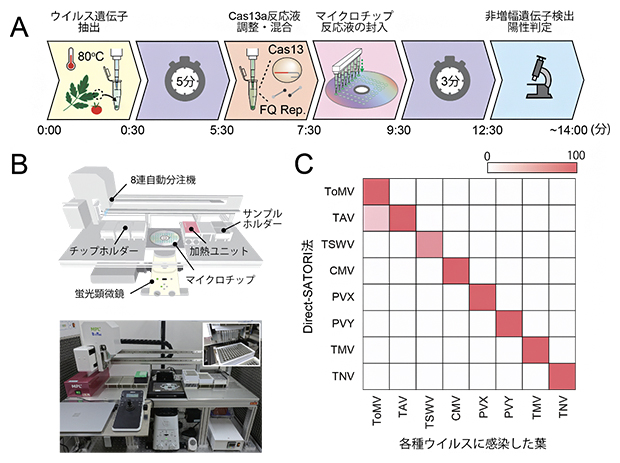
図3 Direct-SATORI法によるトマトウイルス病の多項目・迅速遺伝子検査
- (A)Direct-SATORI法の模式図。生体試料から最大8種類の病原ウイルスを15分間以内に直接検出できる。
- (B)Direct-SATORI法に最適化したopn-SATORI装置(ver2)の写真と模式図。ウイルス遺伝子の抽出から陽性判定までを一貫して自動処理することが可能である。
- (C)トマトの葉を用いた8種病原ウイルスの陽性判定。感度96%、特異度99%。
今後の期待
Direct-SATORI法は、従来の遺伝子検査の律速過程を省略した、高感度・高精度かつ迅速な新しい遺伝子検査法です。生体試料から最大8種類の病原ウイルスを15分間で直接検出できることから、ポストコロナ社会において、多種感染症を識別・診断するための汎用的な遺伝子検査法となることが期待できます(図4)。
また、Direct-SATORI法は生体試料からウイルスの遺伝子を直接検出することができるため、従来法で用いられる遺伝子の精製装置を必要とせず、検出工程が非常にシンプルになっています。加えて、消耗品のコストは8種類の病原ウイルスの同時検査で約15.6米ドルと低いことから、今後、Direct-SATORI法が、迅速かつ低コストな遺伝子検査のニーズを満たすとともに、医療から農業に関連するさまざまなウイルス病の予防に資することも併せて期待できます。
図4 Direct-SATORI法の将来展望:医療・農業分野における汎用的な遺伝子検査法
補足説明
- 1.感度
検査の性能を表す指標の一つ。陽性のものを正しく陽性と判定した割合。 - 2.特異度
検査の性能を表す指標の一つ。陰性のものを正しく陰性と判定した割合。 - 3.PCR検査法
ポリメラーゼ連鎖反応法(PCR法)によってウイルスに特徴的な遺伝子配列を増幅してウイルスの有無を検出する方法。 - 4.CRISPR-Cas13a
多くの細菌は、「CRISPR-Casシステム」と呼ばれる獲得免疫システムを備えている。VI型CRISPR-Casシステムに属するCRISPR-Cas13aはガイドRNAと複合体を形成する。そして、ガイドRNAと相補的な1本鎖RNAと結合すると活性化し、1本鎖RNAを切断するRNA依存性RNA切断酵素である。
研究チーム
理化学研究所 開拓研究本部 渡邉分子生理学研究室
主任研究員 渡邉 力也(ワタナベ・リキヤ)
研究員 篠田 肇(シノダ・ハジメ)
基礎特別研究員 上田 智也(ウエダ・トモヤ)
テクニカルスタッフⅠ 飯田 龍也(イイダ・タツヤ)
テクニカルスタッフⅠ 牧野 麻美(マキノ・アサミ)
テクニカルスタッフⅠ 吉村 麻実(ヨシムラ・マミ)
研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業CREST「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出(研究総括:馬場嘉信、JPMJCR19H5)」、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(A)「未開拓タンパク質の1分子計測技術・デバイス開発(研究代表者:渡邉力也、20H05931)」、同基盤研究(A)「デジタル検出技術を基盤としたウイルスの新規感染診断法の開発(研究代表者:渡邉力也、21H04645)」、日本医療研究開発機構(AMED)「官民による若手研究者発掘支援事業(JP22he0422018)」、浦上食品・食文化振興財団研究助成をはじめとする諸機関からの支援によって行われました。
原論文情報
- Tomoya Ueda, Hajime Shinoda, Asami Makino, Mami Yoshimura, Tatsuya Iida, Rikiya Watanabe, "Purification/amplification-free RNA detection platform for rapid and multiplex diagnosis of plant viral infections", Analytical Chemistry, 10.1021/acs.analchem.3c01691
発表者
理化学研究所
開拓研究本部 渡邉分子生理学研究室
主任研究員 渡邉 力也(ワタナベ・リキヤ)
研究員 篠田 肇(シノダ・ハジメ)
基礎特別研究員 上田 智也(ウエダ・トモヤ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
