2023年6月13日
理化学研究所
高エネルギー加速器研究機構
肝がん再発予防薬の標的タンパク質を同定
-タンパク質架橋酵素の立体構造を変えて肝がん幹細胞を制する-
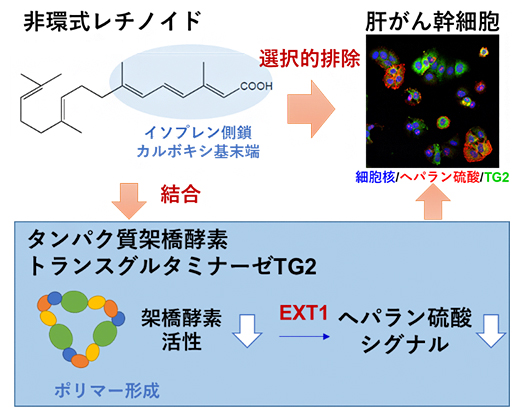
理化学研究所(理研)生命医科学研究センター 細胞機能変換技術研究チームの秦 咸陽 研究員、鈴木 治和 チームリーダー、高エネルギー加速器研究機構(KEK)物質構造科学研究所の清水 伸隆 教授らの国際共同研究グループは、世界初の肝がん再発予防薬として期待される「非環式レチノイド[1](一般名:ペレチノイン)」がタンパク質架橋酵素トランスグルタミナーゼ(TG2)[2]に結合することを発見しました。
本研究成果は、肝がん治療後の再発を予防する補助療法の開発やタンパク質架橋酵素の活性制御のために、非環式レチノイドを構造基盤とした創薬研究に貢献すると期待できます。
これまで非環式レチノイドの作用には異常細胞の増殖シグナルを抑制することなどが知られていましたが、実際にその作用に非環式レチノイドがどのように関わっているのか、特にどのタンパク質と結合するのかは明らかではありませんでした。
今回、国際共同研究グループは非環式レチノイドのイソプレン側鎖とカルボキシ基末端がTG2と結合することで、TG2の立体構造を変化させ、そのタンパク質架橋酵素活性を阻害することを明らかにしました。さらにTG2阻害剤が肝がん細胞の幹細胞化と細胞増殖を特異的に阻害することを見いだし、TG2の分子標的としてヘパラン硫酸シグナル経路[3]を同定しました。
本研究は、科学雑誌『Cell Death & Disease』オンライン版(6月13日付:日本時間6月13日)に掲載されます。
研究概要図
背景
2020年に世界全体の肝がん死亡者数は83万人を超え、過去20年間で約2倍に増加しています注1)。肝がんの年間発症者数と死亡者数の比率はほぼ1対1となっており、極めて予後の悪いがんの一つです。その原因は、肝がんの根治治療後の再発率が80%に上るにもかかわらず、肝がん治療後の再発を予防する補助療法がいまだに確立されていないことが挙げられます。
非環式レチノイドは、1981年に岐阜大学の武藤泰敏教授(当時)が発表した環状構造を持たない脂溶性ビタミンA類縁体で、正常肝細胞には影響せず、肝がん細胞・幹細胞に対して選択的に異常増殖を抑制し、世界初の肝がん再発予防薬として期待されています注2、3)。
その作用機序として、レチノイン酸受容体RXRαが過剰にリン酸化される反応を抑制して、RXRαの転写因子[4]活性を正常化することのほかに、細胞核に局在するトランスグルタミナーゼ(TG2)というタンパク質を介する転写因子Sp1の架橋を不活性化することで、異常細胞の増殖シグナルを抑制する作用が知られています。しかし、この作用に非環式レチノイドがどのように関わっているのか、特にどのタンパク質と結合するのかは明らかではありませんでした。
- 注1)Sung H, Ferlay J, Siegel R, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3):209-49. doi: 10.3322/caac.21660
- 注2)2016年1月8日プレスリリース「肝がん再発予防薬の作用メカニズムを解明」
- 注3)2018年4月24日プレスリリース「非環式レチノイドによるMYCN陽性肝がん幹細胞の排除」
研究手法と成果
国際共同研究グループは、これまでに非環式レチノイドの活性部位がイソプレン側鎖とカルボキシ基末端(-COOH)であることを同定していました。そこで、この構造の反対側末端を磁性ビーズ「FGビーズ[5]」に固定させ、直接結合するタンパク質を探索しました。その結果、非環式レチノイドが濃度依存的にタンパク質架橋酵素TG2と結合することが分かりました。TG2の立体構造にはOpen構造とClosed構造の二つがあり、立体構造を変化させることでTG2は多彩な機能を発揮します(図1A)。
次に、ネイティブ電気泳動[6]とX線小角散乱法(SAXS法)[7]を用いて、非環式レチノイドによって溶液中のTG2の立体構造がどのように変化するのかを調べました。ネイティブ電気泳動では、非環式レチノイドを添加するとTG2の多重合体(200~350kDa)に相当する複数のバンドが観測されました(図1BのACR)。さらに、タンパク質構造データバンク(PDB)[8]に登録されているTG2の二つの結晶構造を基に、SAXS法で得られた散乱曲線に対してOpen構造/Closed構造の割合を計算しました。すると、非環式レチノイドを添加することにより、タンパク質架橋酵素活性を持つOpen構造のTG2が誘導される傾向が見られました。非環式レチノイドとグアノシン三リン酸(GTP)を添加すると、GTP加水分解酵素(GTPase)[9]活性を持つClosed構造のTG2に変化しました(図1C)。
これらの結果は、非環式レチノイドのイソプレン側鎖とカルボキシ基末端がTG2と直接結合し、そのタンパク質の立体構造を変化させることを示しています。
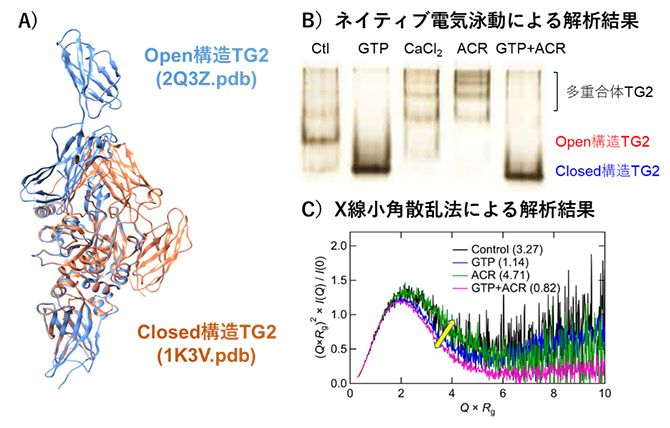
図1 非環式レチノイドによるTG2のタンパク質立体構造への影響
- (A)PDBデータベースによるOpen構造TG2(2Q3Z.pdb)とClosed構造TG2(1K3V.pdb)の結晶構造。青色がOpen構造、茶色がClosed構造を示す。
- (B)TG2をネイティブ電気泳動で解析した銀染色像。Closed構造TG2を誘導するグアノシン三リン酸(GTP)、Open構造TG2を誘導する塩化カルシウム(CaCl2)、非環式レチノイド(ACR)で処理した。TG2にACRを添加すると、TG2の多重合体に相当する複数のバンドが見られた(右から2番目)。GTPとACRで処理すると、Closed構造TG2となった(右端)。
- (C)X線小角散乱法で解析した散乱曲線の無次元クラツキープロット。実験はKEKフォトンファクトリーのBL-10Cで行われた。プロットの形状から分子量や分子の大きさに関係なくタンパク質の構造状態を推定し比較することができる。釣鐘状のピークの出現は、図1(A)のようにタンパク質が一定の形状に折り畳まれていることを示唆しているが、ピークの高さが減少しながらピークの幅が狭くなるほど、TG2はよりコンパクトなClosed構造になると考えられる。( )内はTG2のOpen構造/Closed構造の割合を示す。TG2にACRを添加すると割合は4.71となり、Open構造が誘導される傾向が見られた(緑線)。そのTG2にGTPを添加すると割合は0.82となり、Closed構造に変化した(ピンク線)。
次に、非環式レチノイドはTG2重合体の形成を誘導することで、TG2のタンパク質架橋酵素活性を阻害することを見いだしました。そこで、TG2の機能を一部欠損させて、肝がん細胞の幹細胞化と細胞増殖にどのように影響するかを調べました。TG2遺伝子をノックダウン[10]すると、肝がん細胞増殖の抑制とともに、幹細胞化の指標となるマーカー遺伝子EpCAMやMYCNの発現や3次元スフェロイド[11]形成能の阻害が観察されました(図2A)。
さらに、蛍光活性化セルソーティング(FACS)技術[12]を用いて、単離されたEpCAM陽性肝がん幹細胞を調べた結果、TG2遺伝子とTG2タンパク質の高い発現が見られました。また、TG2阻害剤NC9はEpCAM陽性肝がん幹細胞に対して特異的に細胞死を誘導することが分かりました(図2B)。以上の結果から、TG2は肝がん細胞・幹細胞を標的とする新たな肝がん治療/予防の標的であることを発見しました。
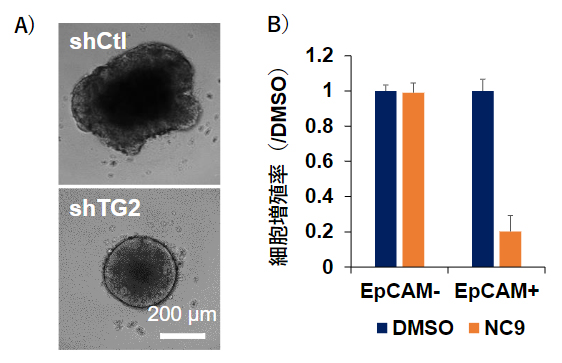
図2 肝がん細胞におけるTG2の機能欠損解析
- (A)コントロール(shCtl)とTG2(shTG2)にshRNAレンチウイルスを感染させた肝がん細胞の3次元スフェロイド像。TG2遺伝子のノックダウンにより、肝がん細胞の3次元スフェロイド形成能の阻害が見られた(下)。つまり、肝がん細胞は集合体を形成しにくくなった。
- (B)FACS技術で分離したEpCAM陰性肝がん細胞(EpCAM-)とEpCAM陽性肝がん幹細胞(EpCAM+)を溶媒コントロール(DMSO)とTG2阻害剤NC9で処理し、DMSOに対する細胞増殖率を示している。NC9によるEpCAM+肝がん幹細胞に対する選択的な増殖阻害活性が見られた。
最後に、肝がん細胞においてTG2の標的分子を探索しました。プロテオーム解析[13]では、がんの発生と進行に関わるヘパラン硫酸プロテオグリカン[14]の合成酵素EXT1がTG2遺伝子の下流で制御されることが分かりました。siRNA[15]を用いた機能欠損解析では、EXT1ノックダウンにより肝がん細胞株の増殖が抑制されました。さらに、ヘパラン硫酸に対する免疫染色法[16]により、EpCAM陽性肝がん幹細胞ではヘパラン硫酸が高く発現し、TG2との強い共発現が見られました。さらにTG2阻害剤NC9を添加することにより、肝がん細胞のヘパラン硫酸の発現が強く抑制されました(図3)。この結果は、TG2がヘパラン硫酸シグナルを介して肝がん幹細胞増殖を制御する可能性を示しています。
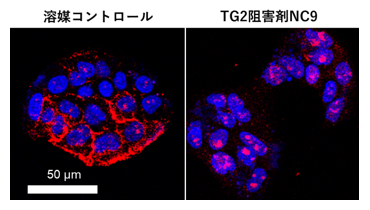
図3 肝がん細胞におけるTG2によるヘパラン硫酸の制御
溶媒コントロールとTG2阻害剤NC9で処理した肝がん細胞の蛍光免疫染色像。細胞の核をDAPI(青色)で、へパラン硫酸を赤色で蛍光染色しそれぞれ観察した。NC9処理により、ヘパラン硫酸発現の抑制が見られた(右)。
今後の期待
本研究では、非環式レチノイドによる肝がん幹細胞の選択的排除において、TG2の立体構造に依存したタンパク質架橋酵素活性の制御、ならびにTG2の分子標的がヘパラン硫酸シグナルであることを明らかにしました。特に、非環式レチノイドのイソプレン側鎖とカルボキシ基末端構造がTG2と結合することがTG2の立体構造の制御に重要であると判明しました。
本成果は今後、TG2の非環式レチノイドとの結合部位やヘパラン硫酸の結合タンパク質を特定することで、非環式レチノイドを構造基盤とした肝がん再発予防を含めたさまざまな創薬研究の足掛かりになると期待できます。
補足説明
- 1.非環式レチノイド
一般名:ペレチノイン、英語名:acyclic retinoid(略称:ACR)。世界初の肝がん再発化学予防候補薬(開発コード名はNIK-333)として第Ⅲ相臨床試験を実施してきたが、承認までには至っていない。肝がん幹細胞に対する特異的分子標的の解明は重要な課題になっている。 - 2.トランスグルタミナーゼ(TG2)
タンパク質同士を共有結合させる架橋反応を触媒する酵素。タンパク質中のアミノ酸グルタミンを利用してペプチド結合を形成させるため、この名が付けられた。立体構造の変化により多彩な機能を発揮する。 - 3.ヘパラン硫酸シグナル経路
ヘパラン硫酸と呼ばれる特定の糖鎖が関与する細胞間のシグナル伝達経路のこと。ヘパラン硫酸は、細胞外マトリックスや細胞表面の糖タンパク質に結合する硫酸化多糖で、細胞のシグナル伝達や細胞間相互作用に重要な役割を果たしている。 - 4.転写因子
特定のDNA配列に結合し、遺伝子発現を制御するタンパク質の一群。遺伝子発現のスイッチに例えられ、遺伝子発現を促進するものを転写活性化因子、抑えるものを転写抑制因子と呼ぶ。 - 5.FGビーズ
薬剤に結合するタンパク質群を単離するための磁性ナノアフィニティ粒子のこと。東京工業大学の半田宏教授(当時)が開発した。磁性鉄(Fe3O4)をコアに持つ粒径140~200nmの微粒子であり、物理化学的に安定かつ、非特異的な吸着が非常に抑えられている。FGビーズ、もしくは半田ビーズと呼ばれる。 - 6.ネイティブ電気泳動
ポリアクリルアミドゲル電気泳動法(PAGE)のうち、未変性(生理構造を保った状態)のタンパク質をそのまま泳動する方法。タンパク質の分子量のほか、形状や表面電荷などによってゲル中での泳動が影響されるため、従来のタンパク質の変性を伴う方法では必ずしも分子量に従った分離ができないが、ネイティブ電気泳動ではそうした影響を排除した分離が可能である。 - 7.X線小角散乱法(SAXS法)
X線を試料物質に照射し、散乱されたX線のうち散乱角が小さい領域(約5°以下)を計測することで、物質のナノスケールの構造情報を得る手法。タンパク質を解析する場合は基本的に溶液中に溶けている状態を計測するため、より生体に近い状態の構造情報を得られる。 - 8.タンパク質構造データバンク(PDB)
X線結晶構造解析やクライオ電子顕微鏡を用いた単粒子解析などによって決定されたタンパク質などの生体高分子の3次元原子座標を蓄積している国際的な公共データベース。PDBはProtein Data Bankの略。 - 9.GTP加水分解酵素(GTPase)
GTP(グアノシン三リン酸)の高エネルギーリン酸エステルを加水分解し、GDP(グアノシン二リン酸)と無機リン酸を生成する酵素のこと。生体内のGTP(GDP)と結合するタンパク質の中には、GTP結合型とGDP結合型で立体構造が変わることにより、細胞内信号伝達を調節するものが多く存在する。 - 10.ノックダウン
特定のDNAの遺伝子情報を基にRNAへの変換過程を阻害することで、その遺伝子の機能を大きく減弱させること。 - 11.3次元スフェロイド
細胞が球状の集合体を形成する細胞培養モデルのこと。従来の2次元培養に比べて、細胞-細胞相互作用や細胞-基質相互作用など、より生理的な環境に近い条件を模倣する。 - 12.蛍光活性化セルソーティング(FACS)技術
細胞の特性や蛍光標識に基づいて、レーザー光によって単一の細胞を高速かつ精密に分離・分類する技術のこと。本研究では、肝がん幹細胞マーカーEpCAMを染色したものを対象に、染色強度によりEpCAM陰性と陽性細胞を分離するのに用いた。FACSはFluorescent activated cell sorterの略。 - 13.プロテオーム解析
タンパク質(プロテイン)の発現量を網羅的に解析する技術。タンパク質は鎖状につながったアミノ酸が立体構造をとることで出来上がっているため、アミノ酸配列を解読することにより、タンパク質を同定できる。この原理を利用して、試料中のタンパク質を断片化して質量分析計により質量数を測定することで、どんなタンパク質がどれくらいの量、試料中に存在しているのかを知ることができる。 - 14.ヘパラン硫酸プロテオグリカン
ヘパラン硫酸が結合したタンパク質のこと。細胞表面や細胞と細胞の間を埋める細胞外マトリクスの主要成分で、多種多様な細胞外シグナル分子と結合し、それらの分子の空間配置や受容体結合を調節している。 - 15.siRNA
21~25塩基対の二本鎖RNA。合成したsiRNAを細胞に取り込ませることにより、相補的な配列を持つ遺伝子の発現を抑制できる。siRNAはsmall interfering RNAの略。 - 16.免疫染色法
組織におけるタンパク質の存在を、抗体を利用して可視化、検出する技術。
国際共同研究グループ
理化学研究所
生命医科学研究センター 細胞機能変換技術研究チーム
チームリーダー 鈴木 治和(スズキ・ハルカズ)
研究員 秦 咸陽(シン・カンヨウ/Qin Xian-Yang)
国際プログラム・アソシエイト 許 雅麗(キョ・ガレイ)
人材派遣(研究当時)高橋 昌剛(タカハシ・マサタカ)
開拓研究本部 肝がん予防研究ユニット(研究当時)
ユニットリーダー(研究当時)小嶋 聡一(コジマ・ソウイチ)
上級研究員(研究当時)古谷 裕(フルタニ・ユタカ)
研究員(研究当時)ガイユスト・ルック(Gailhouste Luc)
国際プログラム・アソシエイト(研究当時)ラジャン・シュレスタ(Rajan Shrestha)
国際プログラム・アソシエイト(研究当時)蘇 婷(ソウ・テイ)
生命機能科学研究センター タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(シロウズ・ミカコ)
技師(研究当時)村山(加藤)美幸(ムラヤマ・カトウ・ミユキ)
環境資源科学研究センター 生命分子解析ユニット
ユニットリーダー 堂前 直(ドウマエ・ナオシ)
高エネルギー加速器研究機構 物質構造科学研究所
教授 清水 伸隆(シミズ・ノブタカ)
研究員(研究当時)米澤 健人(ヨネザワ・ケント)
(現 奈良先端科学技術大学院大学 特任助教)
神戸薬科大学 薬学部
教授(研究当時)和田 昭盛(ワダ・アキモリ)
准教授 山野 由美子(ヤマノ・ユミコ)
東京医科歯科大学 生体材料工学研究所
教授 影近 弘之(カゲチカ・ヒロユキ)
准教授 藤井 晋也(フジイ・シンヤ)
岐阜大学大学院 医学研究科 消化器内科学/血液・感染症内科学
教授 清水 雅仁(シミズ・マサヒト)
講師 白上 洋平(シラカミ・ヨウヘイ)
東京慈恵会医科大学 臨床検査医学講座
教授(研究当時、現 客員教授)松浦 知和(マツウラ・トモカズ)
准教授 政木 隆博(マサキ・タカヒロ)
オタワ大学(カナダ)
教授 ケイロ・ジェフレイ(Keillor Jeffrey)
南京大学(中国)
教授 ユウ・ブンクエイ(Yu Wenkui)
研究支援
本研究は、日本医療研究開発機構(AMED)医療分野国際科学技術共同研究開発推進事業戦略的国際共同研究プログラム(SICORP)e-ASIA共同研究プログラム「肝がんに対するMYCN/NCYM標的治療薬の開発(JP22jm0210092s0101、研究代表者:筆宝義隆)」、同肝炎等克服実用化研究事業「がん幹細胞遺伝子の発現動態の追跡を基軸とした肝がんの病態解明と創薬研究(JP22fk0210100h0001、研究代表者:秦咸陽)」、同B型肝炎創薬実用化等研究事業「次世代抗B型肝炎ウイルス薬導出に向けた創薬研究(JP21fk0310112、研究代表者:小嶋聡一/松浦知和)」、同創薬等ライフサイエンス研究支援基盤事業創薬等先端技術支援基盤プラットフォーム(BINDS)「タンパク質架橋酵素トランスグルタミナーゼ2の立体構造制御を介した肝癌細胞死経路の解明(JP21am0101071/JP21am0101082、支援番号1276)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「脂肪肝を背景にしたエンドトキシン過剰反応における膜脂質構造と分子間接着因子の関与(20K07349、研究代表者:秦咸陽)」「情報科学的手法を活用したSEC-SAXS連続データの全自動解析ソフトウェア開発(19K06516、研究代表者:清水伸隆)」、東京生化学研究会研究助成金「トランスオミックスによる肝線維化・発がんの病態解明(研究代表者:秦咸陽)」、理研研究奨励ファンド「A draft trans-omic network of membrane signaling in hepatic tumorigenesis(研究代表者:秦咸陽)」、同IMSセンター長裁量経費「Role of hematopoietic stem cell signatures in oncogenic transformation of liver tumorigenesis(研究代表者:秦咸陽)」による助成を受けて行われました。
原論文情報
- Qin XY, Furutani Y, Yonezawa K, Shimizu N, Kato-Murayama M, Shirouzu M, Xu Y, Yamano Y, Wada A, Gailhouste L, Shrestha R, Takahashi M, Keillor JW, Su T, Yu W, Fujii S, Kagechika H, Dohmae N, Shirakami Y, Shimizu M, Masaki T, Matsuura T, Suzuki H, Kojima S, "Targeting transglutaminase 2 mediated exostosin glycosyltransferase 1 signaling in liver cancer stem cells with acyclic retinoid", Cell Death & Disease, 10.1038/s41419-023-05847-4
発表者
理化学研究所
生命医科学研究センター 細胞機能変換技術研究チーム
チームリーダー 鈴木 治和(スズキ・ハルカズ)
研究員 秦 咸陽(シン・カンヨウ/Qin Xian-Yang)
高エネルギー加速器研究機構 物質構造科学研究所
教授 清水 伸隆(シミズ・ノブタカ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
高エネルギー加速器研究機構 広報室
Tel: 029-879-6047
Email: press [at] kek.jp
※[at]は@に置き換えてください。
