理化学研究所(理研)生命機能科学研究センター 合成生物学研究チームのアーサー・ミリウス 研究員(研究当時、現 大阪大学 免疫学フロンティア研究センター 特任研究員)、山田 陸裕 客員研究員(大阪大学大学院 医学系研究科 特任研究員)、上田 泰己 チームリーダー、クイーンズランド工科大学のディミトリ・ペリン 准教授らの国際共同研究グループは、体内時計遺伝子[1]のmRNA(メッセンジャーRNA)[2]中に、タンパク質合成を制御し睡眠覚醒サイクルに影響を与えるリボソーム[3]結合配列を発見しました。
本研究成果は、睡眠異常とそれに関連する遺伝子変異の同定と検証を進める上で重要で基礎的な知識です。
私たちの体内に備わっている体内時計は、日常の活動を制御し健康を維持するために不可欠です。体内時計遺伝子は転写ネットワークを構成し、互いに抑制したり活性化したりし合うことで、概日周期と呼ばれる約24時間の発現周期を刻んでいます。体内時計遺伝子では、mRNAとその翻訳産物であるタンパク質の発現のピークに時間差があることが分かっていますが、この時間差を生み出す仕組みやその生物学的な意義についてはこれまで不明でした。
国際共同研究グループは、タンパク質翻訳装置であるリボソームが約24時間周期でリズミカルにmRNAに結合し、mRNAの翻訳を時間的に制御していることを明らかにしました。この結合配列を変異させたマウスは睡眠時間が減少したことから、転写後プロセス[2]が体内時計および睡眠制御において極めて重要であることが示されました。
本研究は、科学雑誌『Proceedings of the National Academy of Sciences(PNAS)』オンライン版(9月28日付)に掲載されました。
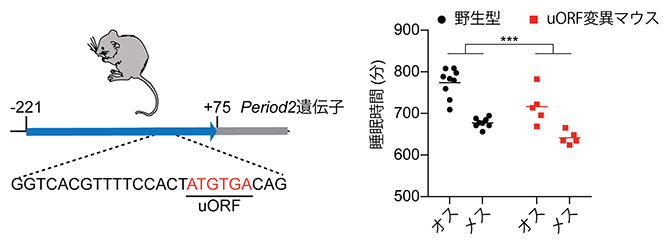
マウスの体内時計遺伝子のリボソーム結合配列(uORF)と、その変異がもたらす睡眠減少
背景
ヒトを含め多くの生物が持つ1日約24時間の概日時計(体内時計)は、日常の活動を制御し健康を維持するために不可欠のものです。体内時計は複数の遺伝子による転写ネットワークで構成されており、遺伝子同士が互いの発現を抑制したり活性化したりし合うことで、概日周期と呼ばれる約24時間の発現周期が刻まれることが知られています。
上田チームリーダーらの研究チームはこれまでにマウスを用いて、体内時計に影響する光を排除した恒常的な暗闇の中における約24時間周期の遺伝子レベルの変化を定量し、体内時計遺伝子の転写産物であるmRNAと、その翻訳産物であるタンパク質の発現タイミングを詳細に解析しました。その結果、両者のピークがほぼ一致している遺伝子もあれば、タンパク質の発現ピークがmRNAの発現ピークより数時間以上遅れる遺伝子もあることを見いだしていました注1)。しかし、この時間差を生み出す仕組みやその生物学的な意義についての研究領域はこれまで未開拓でした。
- 注1)2016年5月31日プレスリリース「新規タンパク質定量法「MS-QBiC」による体内時刻の測定」
研究手法と成果
タンパク質の発現ピークがmRNAよりも遅れる理由として、転写されたmRNAがリボソームでタンパク質に翻訳されるまでの間に、何らかの制御がなされている可能性が考えられます。
そこで国際共同研究グループは、リボソームプロファイリング[4]と呼ばれる手法を用いて、リボソームがmRNAに結合するタイミングをゲノムワイドに調査し、結合タイミングとタンパク質発現ピーク時間との関係を調べました。その結果、両者がよく一致する体内時計遺伝子Period2[5]のコーディング配列[6]上流にオープンリーディングフレーム[6](upstream open reading frame:uORF)が存在し、これにリボソームが結合していることを発見しました(図1)。また、同様のuORFは概日周期を持つ多くの遺伝子に見られ、これらのuORFがあると、下流の遺伝子コーディング配列へのリボソーム結合が減少したり、概日周期でのタンパク質発現が減少したりすることが分かりました。以上の結果は、体内時計遺伝子のタンパク質が概日周期で発現するためにuORFが重要な役割を果たしている可能性を示しています。
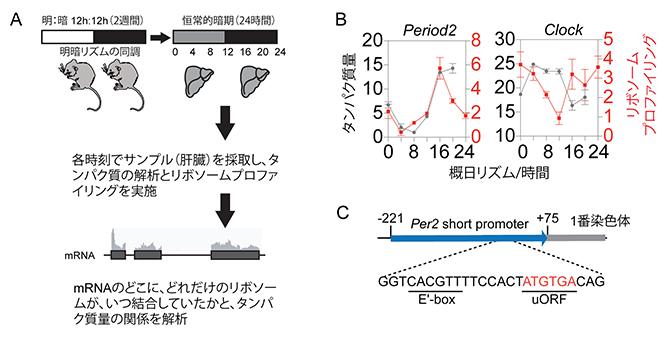
図1 リボソーム結合タイミングとタンパク質量発現ピークの関係
- A)リボソームプロファイリングの模式図。マウス集団の体内時計を人工的な明暗リズムで2週間同調させた後、暗黒下に移す。肝臓で発現する遺伝子の約10%は概日リズムを刻むことが知られており、本研究でも肝臓を解析対象にリボソームプロファイリングを行った。
- B)解析結果の例。黒の折れ線は1細胞当たりのタンパク質量(グラフ左の縦軸。数値は、分子の個数の千の位)を、赤の折れ線はリボソーム結合量(グラフ右の縦軸。数値は、解析した100万のRNA配列について一つの遺伝子の長さを1,000塩基と換算したときのリボソーム結合配列の数)を示す。Period2とClockはどちらも体内時計遺伝子だが、Period2では二つのピークがほぼ一致しているのに対し、Clockは一致していない。
- C)Period2遺伝子のuORF。転写制御領域(Per2 short promoter)内に、開始コドン(ATG)と終止コドン(TGA)の配列のみから成るuORFが存在する。矢印は転写の方向、数字は転写開始点を+1としたときの配列の位置、E'-boxは転写因子の結合配列をそれぞれ示す。
さらに、バイオインフォマティクス[7]を用いた解析により、マウスと人間の遺伝子の約半分には少なくとも一つのuORFがあり、体内時計関連遺伝子の約75%がuORFを持っていることが分かりました。これは、概日時計遺伝子がuORFを介した転写後制御を受けている可能性を裏付けるものです。
uORFの機能をさらに詳しく検討するため、Period2遺伝子のuORFを変異させたときのタンパク質量や個体への影響を調べました。まず、uORFの開始コドンを1文字変異させたレポーター遺伝子[8]を培養細胞で発現させたところ、概日リズムは再現できましたが、タンパク質の量は野生型のレポーター遺伝子と比較して上昇していました(図2A)。
同様のuORF変異を持つ変異マウスを作成したところ、興味深い結果が得られました。Period2遺伝子mRNAの発現量を測定したところ、変異マウスでは野生型マウスに比べてmRNAについても有意に増加していました(図2B)。このことから、uORFの転写後制御が翻訳のみならず、mRNAの安定性にも関わることが示唆されました。またこの変異マウスでは睡眠リズムに異常が生じ、明期(昼)と暗期(夜)の切り替わりの時間帯にマウスの睡眠時間が顕著に減少していました(図2C)。
これらの結果は、体内時計遺伝子そのものを変異させなくても、その転写後制御を担うuORFを変異させることで個体の睡眠に影響を与えることを示しています。つまり、uORFを介した転写後制御が、遺伝子の発現という細胞レベルの現象にとどまらず、睡眠という個体レベルでの生理現象に重要な役割を果たしていることが分かりました。
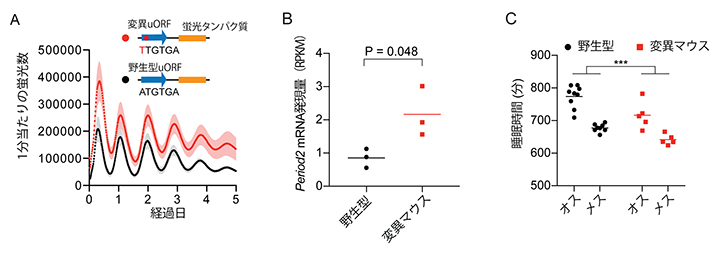
図2 uORF変異によるタンパク質量、mRNA発現量、睡眠への影響
- A)uORFを含むPeriod2遺伝子のプロモーター配列に蛍光タンパク質の遺伝子を融合させたレポーター遺伝子を作成し、培養細胞に遺伝子導入した。1分当たりの蛍光を測定することでタンパク質量を調べた結果、変異uORFレポーターでも概日リズムは観察されたが、タンパク質量は野生型に比べて上昇していた。
- B)マウスゲノムのPeriod2遺伝子のuORFに変異を導入したマウスのPeriod2 mRNA発現量。24時間周期のうちPeriod2遺伝子の発現レベルが最も低下する2~4時間の測定をしたところ、変異マウスのmRNA量は野生型に比べて有意に上昇していた。
- C)Period2遺伝子のuORFに変異を導入したマウスは、明期(昼)と暗期(夜)の切り替わりの時間帯の睡眠時間がオス・メスともに減少した。
今後の期待
Period2遺伝子は、体内時計を制御する転写ネットワークの中で中心的な抑制フィードバックループを形成しており、その重要性は今回見いだされた睡眠調節だけにとどまらないと考えられます。Period2遺伝子の発現は乳がんで乱れ、急性骨髄性白血病の患者で低下することが知られています。また、Period2遺伝子の阻害はマウスにおいて腫瘍形成を引き起こします。従って、本研究によるPeriod2遺伝子の転写後制御に関わる知見は、例えばがんによって正常な体内時計の機能が阻害される過程に関する新しい洞察や、また時間依存的な治療効果を持つ薬の改善に役立つなど、医学を含むさまざまな分野への貢献が期待されます。
また、本研究ではマウスを用いましたが、今回得られた知見がヒトにおいて睡眠異常を伴う遺伝子変異についての理解につながることを期待しています。
補足説明
- 1.体内時計遺伝子
約24時間(概日)周期でリズムを発振する機構をつかさどる遺伝子。生物種を超えて共通している遺伝子も多い。 - 2.mRNA(メッセンジャーRNA)、転写後プロセス
細胞が合成するタンパク質のアミノ酸の並び方の情報(コドン)を持つRNAをmRNAと呼ぶ。真核生物では、DNAから転写された直後のmRNA前駆体に含まれるタンパク質情報を持たない配列(イントロン)が除去され、成熟したmRNAにリボソームが結合してタンパク質が合成される。このように転写後に起きるさまざまな反応を本稿では転写後プロセスと呼んでいる。 - 3.リボソーム
細胞内でタンパク質の合成を行う翻訳装置。mRNA(メッセンジャーRNA)に結合してリボ核酸(RNA)の配列情報からタンパク質に翻訳する。 - 4.リボソームプロファイリング
2012年にハワードヒューズ医科大学の研究者らが開発した手法で、RNAに結合したリボソームの正確な位置を特定し、細胞内の翻訳反応を網羅的に解析する。 - 5.Period2
ショウジョウバエの変異体解析で発見された時計遺伝子Periodの哺乳類ホモログの一つ。発現のリズムが24周期で変動する。 - 6.コーディング配列、オープンリーディングフレーム
DNAやmRNAの配列の中で、タンパク質のアミノ酸配列に対応した塩基配列領域をコーディング配列と呼ぶ。コーディング配列は終止コドンが現れるまで連続していると見なされ、終止コドンから次の終止コドンまでをオープンリーディングフレーム(open reading frame:ORF)と呼ぶ。タンパク質の合成は多くの場合、開始コドンから始まるため、開始コドンから終止コドンまでをタンパク質合成が可能な部分としてORFと見なすことも多い。 - 7.バイオインフォマティクス
DNA配列やタンパク質立体構造などの生命情報を対象としたデータ解析を扱う生命科学分野およびその方法論を指す言葉。 - 8.レポーター遺伝子
解析対象の遺伝子の発現を簡便に検出、定量する目的で利用される遺伝子のこと。遺伝子組換え技術により、目的の遺伝子のプロモーター下流に蛍光タンパク質などの遺伝子を連結し、遺伝子発現を解析する。
国際共同研究グループ
理化学研究所 生命機能科学研究センター
合成生物学研究チーム
チームリーダー 上田 泰己(ウエダ・ヒロキ)
研究員(研究当時)アーサー・ミリウス(Arthur Millius)
(現 大阪大学 免疫学フロンティア研究センター 特任研究員)
客員研究員 山田 陸裕(ヤマダ・リクヒロ)
(大阪大学大学院 医学系研究科 特任研究員)
テクニカルスタッフⅠ 藤島 博史(フジシマ・ヒロシ)
高速ゲノム変異マウス作製チーム(研究当時)
チームリーダー(研究当時)隅山 健太(スミヤマ・ケンタ)
(現 合成生物学研究チーム 客員研究員、名古屋大学 大学院生命農学研究科 教授)
大阪大学 免疫学フロンティア研究センター
教授 ダロン・スタンドリー(Daron M. Standley)
特任准教授 前田 和彦(マエダ・カズヒコ)
クイーンズランド工科大学(オーストラリア)
准教授 ディミトリ・ペリン(Dimitri Perrin)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、科学技術振興機構(JST)ERATO上田生体時間プロジェクト(研究代表者:上田泰己、JPMJER2001)、日本学術振興会(JSPS)科学研究費助成事業基盤研究(S)「哺乳類生体リズム振動体の設計(研究代表者:上田泰己、18H05270)」、同基盤研究(C)「マウス睡眠EEG/EMGデータ自動ステージ判定アルゴリズムと周辺ソフトウェア開発(研究代表者:山田陸裕、21K06385)」、同若手研究「Translation control of circadian rhythms(研究代表者:Arthur Millius、18K14755)」、Human Frontier Science Program grant 2018「Sleep, the clock, and the brain: a neuromathematical approach(研究代表者:上田泰己)」、同Postdoctoral Fellowship(Arthur Millius)、文部科学省「光・量子飛躍フラッグシッププログラム(Q-LEAP)JPMXS0120330644」、日本医療研究開発機構(AMED)先端的バイオ創薬等基盤技術開発事業「先端的医療技術に対する全臓器・全身スケールでの評価技術基盤の開発(研究開発代表者:上田泰己、JP20am0401011)」、同生命科学・創薬技術支援基盤事業(BINDS)JP22ama121025の助成を受けて行われました。
原論文情報
- Arthur Millius, Rikuhiro G. Yamada, Hiroshi Fujishima, Kazuhiko Maeda, Daron M. Standley, Kenta Sumiyama, Dimitri Perrin, and Hiroki R. Ueda, "Circadian ribosome profiling reveals a role for the Period2 upstream opening reading frame in sleep", The Proceedings of the National Academy of Sciences of the United States of America (PNAS), 10.1073/pnas.2214636120
発表者
理化学研究所
生命機能科学研究センター 合成生物学研究チーム
チームリーダー 上田 泰己(ウエダ・ヒロキ)
研究員(研究当時) アーサー・ミリウス(Arthur Millius)
(現 大阪大学 免疫学フロンティア研究センター 特任研究員)
客員研究員 山田 陸裕(ヤマダ・リクヒロ)
(大阪大学大学院 医学系研究科 特任研究員)
クイーンズランド工科大学(オーストラリア)
准教授 ディミトリ・ペリン(Dimitri Perrin)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
産業利用に関するお問い合わせ
関連リンク
大阪大学免疫学フロンティア研究センターNews & Topics「睡眠制御における転写後プロセスの役割を解明(A. Millius et al., in PNAS)」
